细胞穿透肽Tat—LK15介导siRNA的转染效率和细胞毒性研究
2014-04-29饶云彭捷吴昊澎曹仲文陆建华屠伟峰
饶 云 彭 捷 吴昊澎 曹仲文 陆建华 屠伟峰

摘 要:通过与Lipofectamine TM RNAiMAX(Lipo)比较,探讨细胞穿透肽Tal-LK15对人肾上皮细胞(human enbryonic kidney 293T cells,293T)和大鼠视神经节细胞(retinal ganglion cell ling,RGC-5)转染小干扰RNA(smallinterfernce RNA,siRNA)的效率和细胞毒性,为后期实验提供依据。以羧基荧光素(carboxyfluorescein,FAM)标记的siRNA为报告基因,不同剂量的Tat-LK15 (Tat-LK15组)和Lipo(Lipo组)为转染试剂,分别转染293T和RGC-5细胞转染24 h后荧光显微镜观察FAM荧光强度,计算转染效率,并以CCK-8法检测细胞毒性。随着Tat-LK15 和Lipo剂量的增加,siRNA转染效率逐渐提高。 当Tat-LK15与siRNA配比为2:1(μg/μg)时,RGC-5细胞的转染效率达到最高((87.3±4.5)%),低于Lipo与siRNA配比为5:1(μL/μg)时的最高转染效率((96.2±3.2)%(P<0.05));作用于293T细胞时,两转染试剂的最高转染效率没有统计学差异(P>O.05)转染试剂剂量增加,Lipo细胞毒性显著增加,而TaI-LK15毒性无明显变化。转染效率最高时,Lipo(5μL)组293T和RGC-5的细胞荷活率仅为((77.8±4.1)%,(73.4±7.7)%)显著低于Tal-LK15 (2:1)组同种细胞的存活率((91.0±3.7)%.(90.0±6.1)%)(P<0.05) Tat-LK15可有效地转染siRNA,细胞毒性低,安全性突出.有一定的应用前景。
关键词:细胞穿透肽(CPPs):Tat-LK15;转染试剂:小干扰RNA
中图分类号:R318
文献标识码:A
文章编号:1007—7847(2014)06一0505一06
RNA干扰技术在生物医学研究中已被广泛应用,而转染试剂作为其关键因素一直得到大量关注。常用的小干扰RNA (siRNA)转染方法有病毒载体法、阳离子脂质体介导法和阳离子聚合物法。病毒载体转染效率高,但其制备过程复杂、价格昂贵,免疫原性和生物安全性问题也限制了它的应用。阳离子脂质体细胞毒性相对较高,亦可能干扰细胞代谢。动物实验表明,在体使用阳离子脂质体可诱发肺部炎症,甚至产生严重肺损伤。阳离子聚合物安全窗小,当需要提高转染效率而增加转染试剂剂量时,会明显增加其生物毒性。细胞穿透肽是一类由30个或更少氨基酸组成的富含碱性氨基酸、带正电荷的短肽,可高效介导小分子(蛋白、肽、核酸等)进入不同类型的细胞而发挥生物活性。作为载体工具,细胞穿透肽在基因治疗及新药开发等领域具有很大的研究和应用价值。
HIV-Tat是一段由人类免疫缺陷病毒I型基因编码的反式转录激活因子(transactivator oftranscription, Tat),具有细胞穿透肽活性,能将与之连接的核酸、多肽等以浓度依赖的方式高效快速地导入胞内,且不影响细胞的正常结构和功能;具有转染效率高、毒性低、稳定性好等优点。本实验为提高Tat的转染效率,选择Tat蛋白中具有穿膜功能的核心氨基酸序列(49~57,RKKR-RQRRR)与膜活化蛋白LKI5 (KLLKLLLKLLLKL-LK)融合.合成序列为RKKRRQRRRCJGGKLLKL-LLKLLLKLLK的新型细胞穿透肽Tat-LK15。为研究Tat—LK15的转染效果,本实验拟以最常用的阳离子脂质体类转染试剂Lipofectamine TMRN_AiMAX (Lipo)为对照,转染羧基荧光素(FAM)标记的siRNA,通过荧光显微镜观察Tat-LK15的转染效率,并通过CCK-8法检测其细胞毒性。
1 材料和方法
1.1 材料
人肾上皮细胞(293T)和大鼠视网膜神经节细胞RGC-5(广州莱德尔牛物科技有限公司)、FAM-siRNA(上海吉玛制药技术有限公司)、Tat-LK15(厦门博欣生物科技有限公司)、Lipofec-tamine TM RNAiMAX (Invitrogen,美国)、胎牛血清(Hyclone,美国)、DMEM-高糖培养基(Hyclone,美国)、DMEM -F12培养基(Hyclone,美国)、Opti -MEM培养基(invilrogen,美国)、青链霉素(Hyclone,美国)、PBS磷酸钾缓冲液(Hyclone,美国)、CCK-8溶液(碧云天,上海)、酶标仪(Biocell,奥地利)、细胞恒温培养箱(Thermo,美国)、低速离心机(中佳,北京)、倒置光学显微镜(OLYMPUS CKX41,日本)、超净工作台(AIR TECH,日本)、倒置荧光显微镜(Leica,德国)。
1.2 方法
1.2.1 细胞培养
293T细胞使用DMEM -F12培养基(添加10%的胎牛血清和1%的青链霉素)、RGC-5细胞使用DMEM-高糖培养基(添加10%胎牛血清和1%青链霉素),置于含5%C02、37℃的细胞培养箱内培养。于转染前l d,胰酶消化293T细胞、RGC-5细胞并计数,每孔lxl05接种于24孔培养板中,置于细胞培养箱中培养,使其在转染日细胞密度为300/c~50%左右。
1.2.2 细胞转染
细胞去完全培养基,用PBS洗两遍,加250 μLOpti-MEM培养基准备转染。Opti-MEM培养基125 μL稀释0.3 μg FAM-siRNA(终浓度50nmol/L); Tat-LK15组:Opti-MEM培养基125 μL稀释Tat-LK15,Tat-LKl5与siRNA的质量比分别为1:2 .3:4、1:1、4:3、2:1 (μg/μg),Lipo组:Opti-MEM培养摹125μL稀释Lipo,Lipo 与siRNA剂量比分别为1:1、2:1、3:1、4:1、5:1 (μL/μg)。siRNA溶液和转染试剂溶液混合静止20min后加到相心细胞培养板中,终培养基500μL;各实验组设置4个复孔。4 h后吸去转染培养基,用PBS洗两遍,每孔加入500 μL完全培养基后置于5%CO2、37℃的细胞培养箱内培养。
1.2.3 基因转染效率测定
转染后24 h,倒置荧光显微镜检测FAM显色并拍照。倒置荧光显微镜计算转染效率:每孔寻找3个代表性视野,各观察100个细胞,计算阳性细胞率。普通视野下计得细胞数为N,相同视野换荧光下计得荧光细胞数为n转染效率=n/N×100%。
1.2.4 CCK一8检测细胞毒性
转染后24 h将各孔细胞胰酶消化后分别吸出,每孔按l×10 4细胞接种至96孔培养板置于5%C02、37℃的细胞培养箱内培养24 h。取出96孔细胞板去日培养,用新鲜DMEM培养摹清洗2次,加入10μLCCK-8溶液,继续孵育4 h:以未转染细胞为对照孔,符组设置6个复孔,酶标仪检测波长为450 nm的吸光度(OD),并计算细胞存活率(细胞存活率=转染组细胞(OD)对照组细胞0D×100%)。
1.3 统计学处理
运用SPSSl3.0统计软件,计量资料以均数±标准差(x±s)表示,采用方差分析(ANOVA)F检验对相关数据资料进行统计处理,多样本均数间的两两比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 转染效率
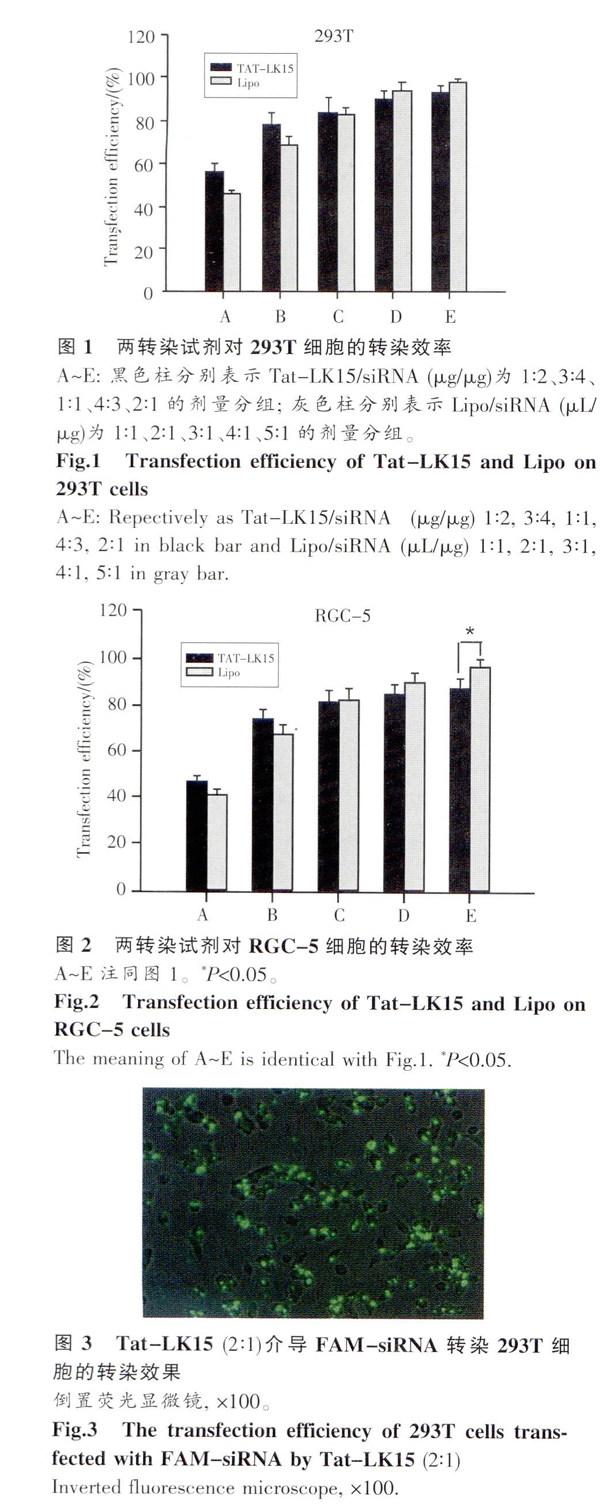
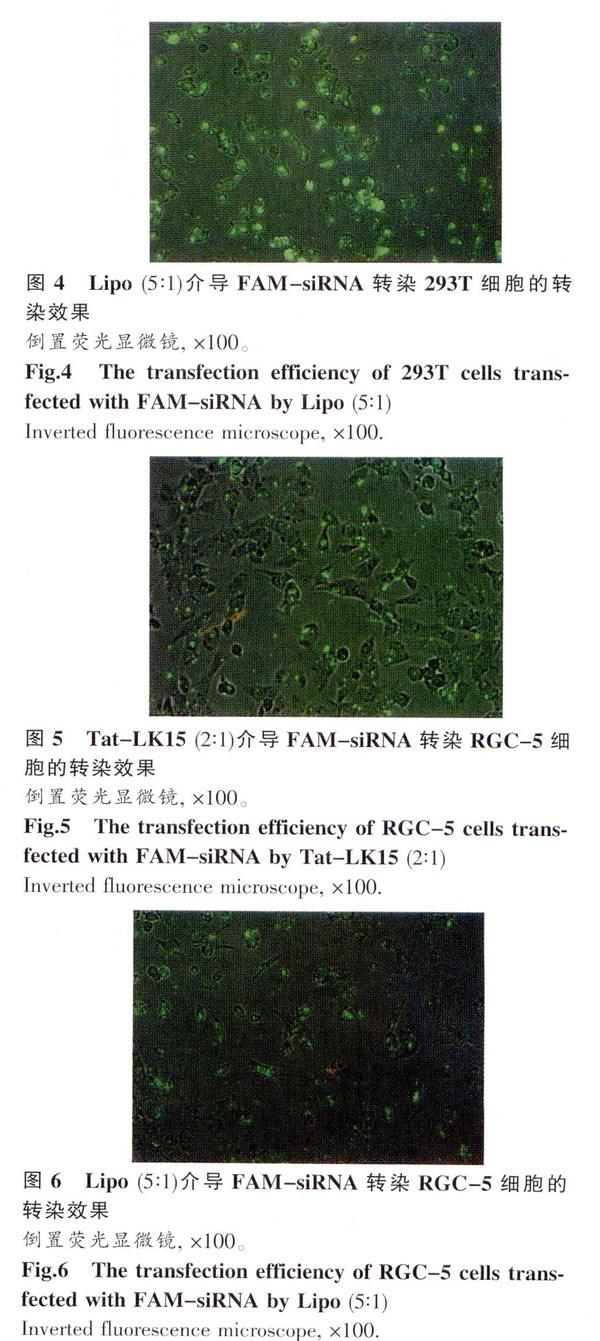
随着Tat-LK15和Lipo剂量增加转染效率增高,但是增长趋势减小。在Tat -LK15组,Tat -LK15与siRNA比例为4:3—2:1 (μg/μg)时,转染效率达到最高,Tat-LK15/siRNA为4:3和2:1时两交联比的293T细胞的转染效率无明显差异(P>0.05,见表1、图1);RGC-5细胞的转染效率也无明显差异(P>0.05,见表l、图2)。Lipo与siRNA为5:1(μL/μg)时两细胞的转染效率达到最高。作用于293T细胞时,Tat-LK15(2:1)转染效率为(93.1±3.0)%与Lipo (5:1)组(98.2±1.6)%差异没有统计学意义(P>0.05,见表l、图3、4)作用于RGC-5细胞时,Tat -LK15(2:1)组转染效率(87.3±4.5)%低于Lipo (5:1)组(96.2±3.2)%(P<0.05.见表l、图5、6);但是与Lipo (4:1)组转染效率为(90.1±4.2)%比较无显著差异(P>0.05)。Tat-LK15对于介导siRNA转染具有良好的转染效率.(见表l、图1~6)。
2.2 细胞毒性
两种转染试剂的细胞毒性随剂量增加而增强,并呈剂量依赖性。Tat-LK15对293T和RGC-5细胞抑制率较小,转染24 h后无明显细胞毒性(图7、8黑色柱);Lipo对细胞具有一定毒性,随剂量增加细胞仔活率明显下降(图7、8灰色柱);作用于293T细胞时,TaI-LK15 (2:1)组转染效率最高,细胞存活率为(91.0±3.7)%,Lipo(5:1)组转染效率最高,细胞毒性也达到最大,细胞存活率为(77.8±4.1)%,两组间差异具有统计学意义(P 3 讨论 脂质体是目前使用最为广泛的非病毒核酸转染试剂,具有转染效率高、可携带基因片段大、无免疫原性、可重复转染等优点。尽管如此,其细胞毒性和在体实验组织损伤却限制了其进一步应用,开发更有效、毒性更小、不干扰细胞生理活动的非脂质体载体已成当务之急。 细胞穿透肽是一类具有穿透细胞膜功能的小分子多肽,可有效介导比其分子质量大近100倍的外源性疏水大分子(蛋白、核酸等)进入细胞内,而示见其对宿主细胞有明显毒副作用。HIV -Tat蛋白则是现今研究最广泛的细胞穿透肽之一,其主要机制可能包括:通过脂质层的被动转运,Tat上大量碱性氨基酸携带的正电荷与细胞表面的负电荷通过静电作用转运物质;网格蛋白介导的内吞;巨吞饮介导的内吞等。Tat蛋白结构域碱性区中49~57位氨基酸(RKKRRQRRR),即蛋白转导域 (protein transduction domain, PTD)是HIV-Tat 蛋白中一个富含碱性氨基酸的具有穿膜活性的最小多肽片段。Nagahara和Schwarze等分别证实了Tat蛋白转导域离体和在体条件下都具有蛋白转导作用。由于单纯Tat介导核酸的转染效率不甚理想,为优化Tal转染核酸的效率,Eguchi等通过结合一个双链RNA结合域(doublestrand RNA binding domain,DRBD)构成PTD-DRBD融合蛋白,后者可以包裹siRNA 上带负电荷的骨架,避免其沉淀聚集,从而显著改善了Tat对siRNA的转染效率,甚至于脂质。 Saleh和Arthanari等则指出,Tat经LK15 (KLLKLLLKL-LLKLLK)修饰构成的Tat-LKl5 可高效地介导基因传递,而细胞毒性在其浓度为10μmol/L时.即使用剂量的50倍才开始出现。因此Tat-LKl5可能是一种转染效率高细胞毒性小的良好siRNA载体工具。 本研究显示Tat-LK15/siRNA对293细胞和RGC-5细胞具有良好的转染效率,虽然略低于Lipo,但最高转染效率也可达(93.1±3.0)%和(87.3±4.5)%,表明Tat转染效率较高且具有转染多种细胞的潜能,与相关文献报道一致。Tat-LKl5/siRNA(μg/μg)在1:2—4:3时,转染效率显著增高;而4:3组与 2:1组的转染效率无明显差异,表明在4:3时Tat-LKl5与siRNA交联可能达到饱和Tat -LK15组细胞存活率最低分别为(91.0±3.7)%,和(90.0±6.1)%,未见明显的细胞毒性,Lipo组siRNA转染效率随Lipo剂量增加而相应增高,转染效率可由40%升高至95%左右,而细胞毒性也显著增强,细胞存活率由92%降至70%左右,由此可见,Tat-LKl5具有良好的核酸转染效率,其生物安全性则表现得更为突出。 综上所述,细胞穿透肽Tat-LK15具有良好的核酸转染效率,且细胞毒性低,生物安全性好,是一种有一定应用前景的非病毒核酸转染载体,通过不断改进和优化其转染方法及条件,可用于转染siRNA沉默目的基因的相关研究。本实验结果为后期应用Tat-LK15介导基因治疗提供了理论依据。
