2型糖尿病患者合并非酒精性脂肪肝及脂肪肝纤维化的危险因素分析
2014-04-28魏美林王倩倩韩峻峰包玉倩贾伟平
魏美林,王倩倩,韩峻峰,魏 丽,包玉倩,贾伟平
(上海交通大学附属第六人民医院内分泌代谢科,上海市糖尿病研究所,上海 200233)
随着生活方式改变,非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)及2型糖尿病(type 2 diabetes mellitus,T2DM)发病率逐年提高,而且两者关系紧密,在临床上并存并不少见。国外研究显示,NAFLD在T2DM之中的患病率达到70%~90%,而国内有调查显示的患病率为42.1%[1]。一方面,NAFLD导致胰岛素抵抗及高胰岛素血症为主的代谢紊乱;另一方面,T2DM亦是NAFLD的危险因素[2]。在所有的NAFLD中,伴有肝纤维化的比例为17%~21%[3]。NAFLD纤维化评分(nonalcoholic fatty liver disease fibrosis score,NAFLDFS)是近年来关于NAFLD患者肝纤维化程度的一种非侵入性评分系统[4],应用高低诊断阈值诊断及排除NAFLD肝纤维化的准确率较高。目前对T2DM合并NAFLD的肝损害及纤维化程度的相关研究较少,本研究旨在对T2DM合并NAFLD及NAFLD肝纤维化的危险因素进行探讨。
1 对象与方法
1.1 对象
收集2008年5月至2009年12月期间上海交通大学附属第六人民医院内分泌科住院的T2DM患者1 109例,进行回顾性横断面研究,并剔除慢性病毒性肝炎、自身免疫性肝病、药物性肝病、有饮酒史(乙醇摄入量男性>140g/周,女性>70g/周)、半年内有使用影响血小板计数水平药物或患有血液病及资料不全患者。年龄(59.5±12.6)岁,其中男性620名,女性489名。
1.2 方法
采集所有患者病史资料,项目包括:现病史、一般情况、性别、年龄、病程、既往史、家族史、饮酒史、身高、体质量、腰围(waist circumference,WC)、臀围(hip circumference,HC)、血压、空腹血糖(fasting blood glucose,FBG)、餐后2h血糖(2-hour postprandial blood glucose,2hPBG)、空腹C肽(fasiting C peptide,FCP)、糖化血红蛋白(hemoglobin Alc,HbA1c)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholestererol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(gamma-glutamyltransferase,GGT)、总胆红素(total bilirubin,TBIL)、白蛋白(albumin,ALB)、尿酸(uric acid,UA)、血小板(platelet,Plt)。体质量指数(body mass index,BMI)=体质量(kg)/身高(m)2;腰臀比(waist hip ratio,WHR)=腰围/臀围。用FCP代替胰岛素改良稳态模型(Homeostasis Model Assessment,HOMA)公式[5]评价胰岛素抵抗,公式为HOMA-C肽=1.5+FBG×FCP/2800,该指数越高说明胰岛素抵抗越明显,越低说明胰岛素敏感性越高。
1.3 诊断标准
NAFLD诊断采用中华医学会《非酒精性脂肪性肝病诊疗指南》中的诊断标准[6]。影像学诊断:规定具备以下3项腹部超声表现中的2项者为弥漫性脂肪肝:(1)肝近场回声弥漫性增强(“明亮肝”),回声强于肾;(2)肝内管道结构显示不清;(3)肝远场回声逐渐衰减。NAFLDFS[4]=-1.675+0.037×年龄(年)+0.094×BMI+1.13×FBG调节受损或者糖尿病(是=1,不是=0)+0.99×AST/ALT-0.013×血小板(109/L)-0.66×白蛋白(g/dl)。按照此评分系统的高低诊断阈值将T2DM合并NAFLD患者分为3个亚组,NAFLDFS>0.676为肝纤维化亚组,-1.455≤NAFLDFS≤0.676为不确定亚组,NAFLDFS<-1.455为无纤维化亚组。
1.4 统计学处理
应用SPSS17.0软件进行统计分析。计量资料符合正态分布者使用±s表示,采用t检验或者单因素方差分析,非正态分布资料使用中位数及四分位数表示,采用秩和检验,计数资料采用卡方检验。多因素分析采用logistic回归。采用Pearson相关系数描述各个指标的相关程度及方向。以P<0.05为差异有统计学意义。
2 结 果
2.1 T2DM组和T2DM合并NAFLD组临床资料比较
在1 109例T2DM患者中,有605(54.6%)例患者合并有NAFLD。与单纯T2DM患者相比,T2DM合并NAFLD患者的BMI、WC、HC、WHR、DBP、ALT、AST、GGT、TBIL、TC、TG、LDL-C、UA、FPG、2hPBG、FCP、HOMA-C肽均更高(P<0.05,表1),而年龄、糖尿病病程、HDL-C则显著低于T2DM患者(P<0.01,表1),校正年龄、性别后差异仍具有统计学意义。
2.2 T2DM合并NAFLD的危险因素分析
以是否合并NAFLD为因变量,以拟选定的年龄、病程等25个可疑因素作为自变量进行二元非条件logistic回归分析。结果采用Forword LR筛选变量,按0.05纳入水准,0.1的剔除水准,进入模型的自变量有BMI、ALT、TG、HDL-C,经校正年龄、性别后BMI[比值比(OR)=1.325,95%CI 1.249~1.406]、ALT(OR=1.025,95%CI 1.013~1.038)、TG(OR=1.283,95%CI 1.105~1.490)、HDL(OR=0.532,95%CI 0.286~0.989),差异仍有统计学意义,提示BMI、ALT、TG升高是T2DM合并NAFLD的危险因素,HDL-C则是保护因素。
2.3 T2DM合并NAFLD肝纤维化患者的临床特点
在所有的T2DM合并NAFLD患者中,纤维化亚组81例,占13.4%。与无纤维化组及不确定两亚组比较,年龄、病程、BMI、WC、HC、SBP、AST/ALT、GGT、HbA1c显著增加(P<0.01),然而ALT、ALB、TG、Plt显著减少(P<0.01或P<0.05),差异具有统计学意义。运用Pearson相关系数描述各个指标的相关程度及方向,显示与年龄、病程、BMI、HC、WC、WHR、SBP、AST/ALT、GGT、HbA1c、FPG、2hPBG呈正相关,而与DBP、ALT、ALB、Plt呈负相关,且具有统计学意义(表3)。

表1 T2DM组和T2DM合并NAFLD组患者临床资料比较Table 1 General characteristics in T2DM and T2DM &NAFLD groups
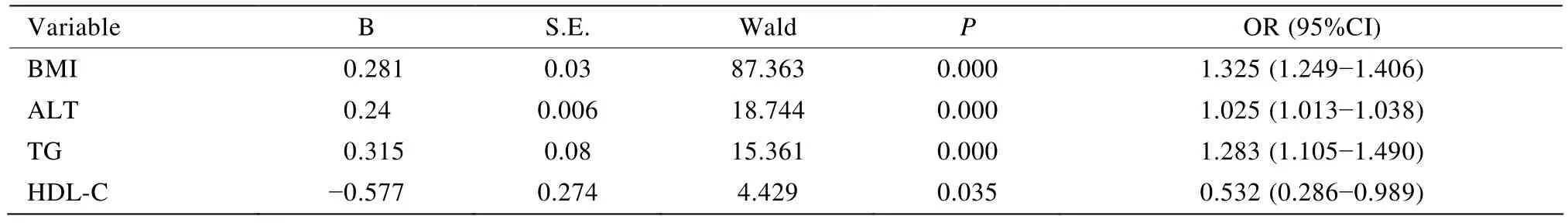
表2 T2DM合并NAFLD的危险因素分析(校正年龄、性别后)Table 2 Risk factors for T2DM complicated NAFLD (adjusted for age and sex)
表3 T2DM合并NAFLD各亚组临床特征比较Table 3 General characteristics of patients in T2DM &NAFLD group (±s )
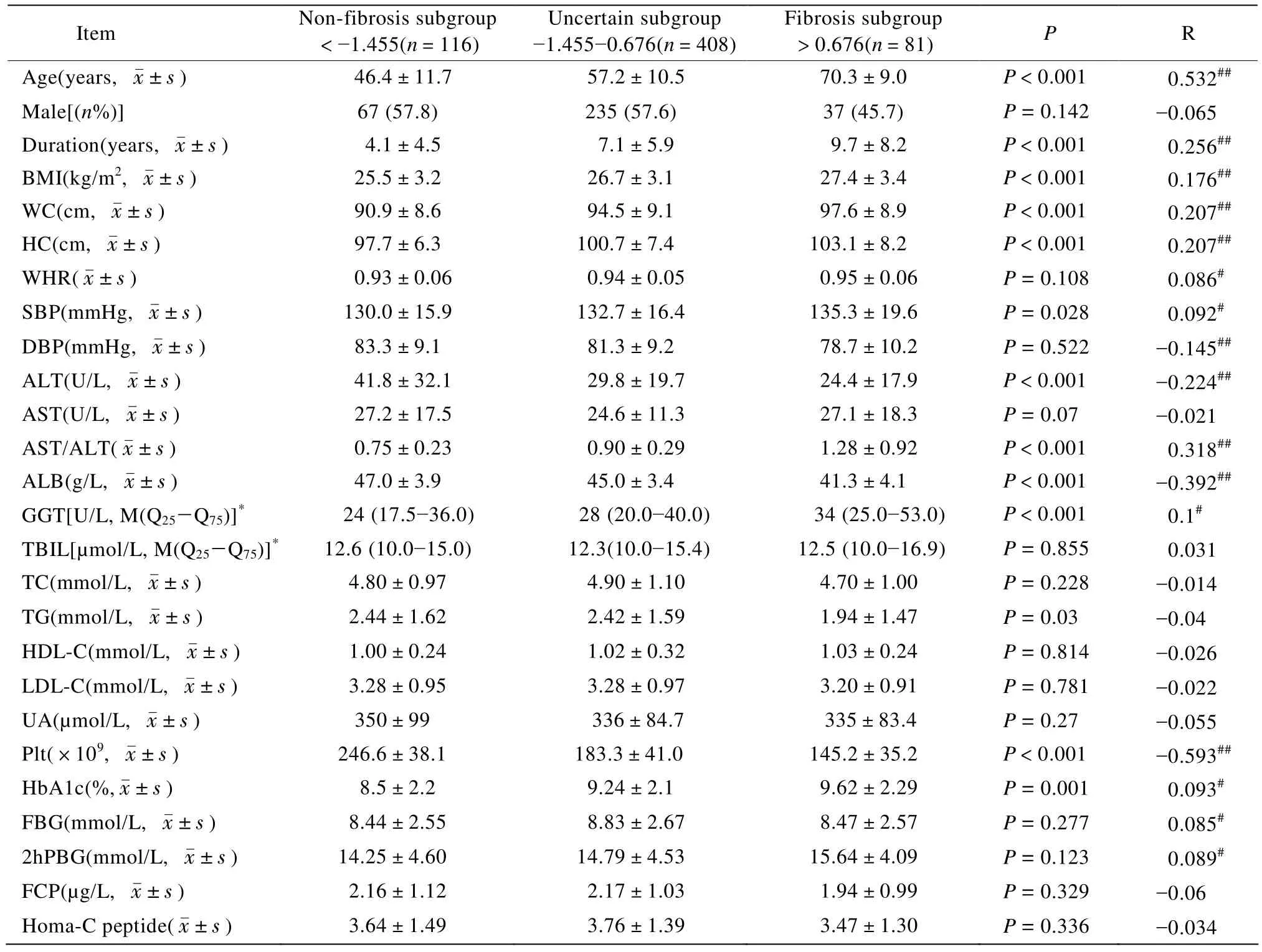
表3 T2DM合并NAFLD各亚组临床特征比较Table 3 General characteristics of patients in T2DM &NAFLD group (±s )
T2DM:type 2 diabetes mellitus;NAFLD:nonalcoholic fatty liver disease;BMI:body mass index;SBP:systolic blood pressure;DBP:diastolic blood pressure;WC:waist circumference;HC:hip circumference;WHR:waist hip ratio;ALT:alanine aminotransferase;AST:aspartate aminotransferase;ALB:albumin;GGT:gamma-glutamyltransferase;TBIL:total bilirubin;TC:total cholesterol;TG:triglycerides;HDL-C:high density lipoprotein cholesterol;LDL-C:low density lipoprotein cholesterol;UA:uric acid;Plt:platelet;HbA1c :hemoglobin Alc;FBG:fasting blood glucose;2hPBG:2-hour postprandial blood glucose;FCP:fasting C peptide. *Non-normal distribution, median(interquartile range). #P<0.05, ##P<0.01
Item Non-fibrosis subgroup<−1.455(n=116)Uncertain subgroup−1.455−0.676(n=408)Fibrosis subgroup>0.676(n=81) P R Age(years, x±s ) 046.4±11.7 057.2±10.5 70.3±9.0 P<0.001 -0.532##Male[(n%)]67 (57.8) 235 (57.6) 37 (45.7) P=0.142 -0.065 Duration(years, x±s ) 04.1±4.5 07.1±5.9 09.7±8.2 P<0.001 -0.256##BMI(kg/m2, x±s ) 25.5±3.2 26.7±3.1 27.4±3.4 P<0.001 -0.176##WC(cm, x±s ) 90.9±8.6 94.5±9.1 97.6±8.9 P<0.001 -0.207##HC(cm, x±s ) 97.7±6.3 100.7±7.40 103.1±8.20 P<0.001 -0.207##WHR(x±s ) 00.93±0.06 00.94±0.05 00.95±0.06 P=0.108 -0.086#SBP(mmHg, x±s ) 130.0±15.9 132.7±16.4 135.3±19.6 P=0.028 -0.092#DBP(mmHg, x±s ) 83.3±9.1 81.3±9.2 078.7±10.2 P=0.522 -0.145##ALT(U/L, x±s ) 041.8±32.1 029.8±19.7 024.4±17.9 P<0.001 -0.224##AST(U/L, x±s ) 027.2±17.5 024.6±11.3 027.1±18.3 P=0.07 -0.021 AST/ALT(x±s ) 00.75±0.23 00.90±0.29 01.28±0.92 P<0.001 -0.318##ALB(g/L, x±s ) 47.0±3.9 45.0±3.4 41.3±4.1 P<0.001 -0.392##GGT[U/L, M(Q25−Q75)]* 0024 (17.5−36.0) 0.028 (20.0−40.0) 00034 (25.0−53.0) P<0.001 -0.1#TBIL[µmol/L, M(Q25−Q75)]* 12.6 (10.0−15.0) .012.3(10.0−15.4) 0.12.5 (10.0−16.9) P=0.855 -0.031 TC(mmol/L, x±s ) 04.80±0.970 04.90±1.10 04.70±1.00 P=0.228 -0.014 TG(mmol/L, x±s ) 2.44±1.62 02.42±1.59 01.94±1.47 P=0.03 -0.04 HDL-C(mmol/L, x±s ) 1.00±0.24 01.02±0.32 01.03±0.24 P=0.814 -0.026 LDL-C(mmol/L, x±s ) 3.28±0.95 03.28±0.97 03.20±0.91 P=0.781 -0.022 UA(µmol/L, x±s ) 350±990 0336±84.7 0335±83.4 P=0.27 -0.055 Plt(×109, x±s ) 246.6±38.10 0.183.3±41.000 0145.2±35.20 P<0.001 -0.593##HbA1c(%,x±s ) 8.5±2.2 09.24±2.10 09.62±2.29 P=0.001 -0.093#FBG(mmol/L, x±s ) 8.44±2.55 008.83±2.670 08.47±2.57 P=0.277 -0.085#2hPBG(mmol/L, x±s ) 14.25±4.600 014.79±4.530 015.64±4.090 P=0.123 -0.089#FCP(µg/L, x±s ) 2.16±1.12 02.17±1.03 01.94±0.99 P=0.329 -0.06 Homa-C peptide(x±s ) 3.64±1.49 03.76±1.39 03.47±1.30 P=0.336 -0.034
2.4 T2DM合并NAFLD肝纤维化的危险因素
将无纤维化、不确定、纤维化3亚组设为因变量,将各亚组之间有统计学差异的自变量选入协变量进行有序多因素logistic回归,结果提示年龄、BMI、ALB、AST/ALT、Plt为危险因素(P<0.01)。按年龄≥50岁、BMI≥25kg/m2、AST/ALT≥0.8、Plt≥200×109、ALB≥45g/L分层分析,比较分层后两亚组肝纤维化的发生率,差异具有统计学意义(P<0.01或P<0.05),提示年龄、BMI、ALB、AST/ALT、Plt是糖尿病合并NAFLD肝纤维化重要的临床参考指标(图1)。
3 讨 论
随着饮食结构及生活方式的改变,T2DM和NAFLD已经成为危害人类健康的常见疾病,尤其是NAFLD患病率明显上升,并一跃成为引起慢性肝脏疾病的首要原因[7],尤其在某些特殊的人群如T2DM患者中,其患病率高,患病人数多,需引起足够的重视。NAFLD是指除外乙醇和其他明确肝损因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,包括单纯性脂肪肝和非酒精性脂肪变性肝炎(NASH),可能进展为肝纤维化、肝硬变及终末期肝病甚至是肝癌[8]。T2DM是NASH的主要危险因子,合并T2DM的NAFLD易发生NASH。有研究对T2DM合并NAFLD的患者进行肝穿刺活检,结果显示63%~87%患者存在NASH,而高达22%~60%的患者存在肝纤维化[9]。肝穿刺活检是目前诊断NAFLD及脂肪肝纤维化程度的金标准,但因其属于有创侵入性检查,可能发生并发症等,在临床中难以有效开展。Angulo等[4]利用常见的临床指标(年龄、BMI、空腹血糖受损或者糖尿病、AST/ALT、血小板、白蛋白),创立并证明了一个NAFLD患者肝纤维化程度的评分。该评分系统的受试者工作特征(receiver operator characteristic,ROC)曲线下面积在试验组及验证组分别为0.88和0.82,通过其高低阈值,可将NAFLD患者分为3组:纤维化组(>0.676)、不确定组(-1455~0.676)及无纤维化组(<-1.455)。此评分已被美国肝病研究联合会(American Association for the Study of Liver Diseases,AASLD)及欧洲肝脏研究联合会(European Association for the Study of the Liver,EASL)推荐用于NAFLD患者肝活检筛查[10],而且对NAFLD患者的长期预后具有预测价值[11]。
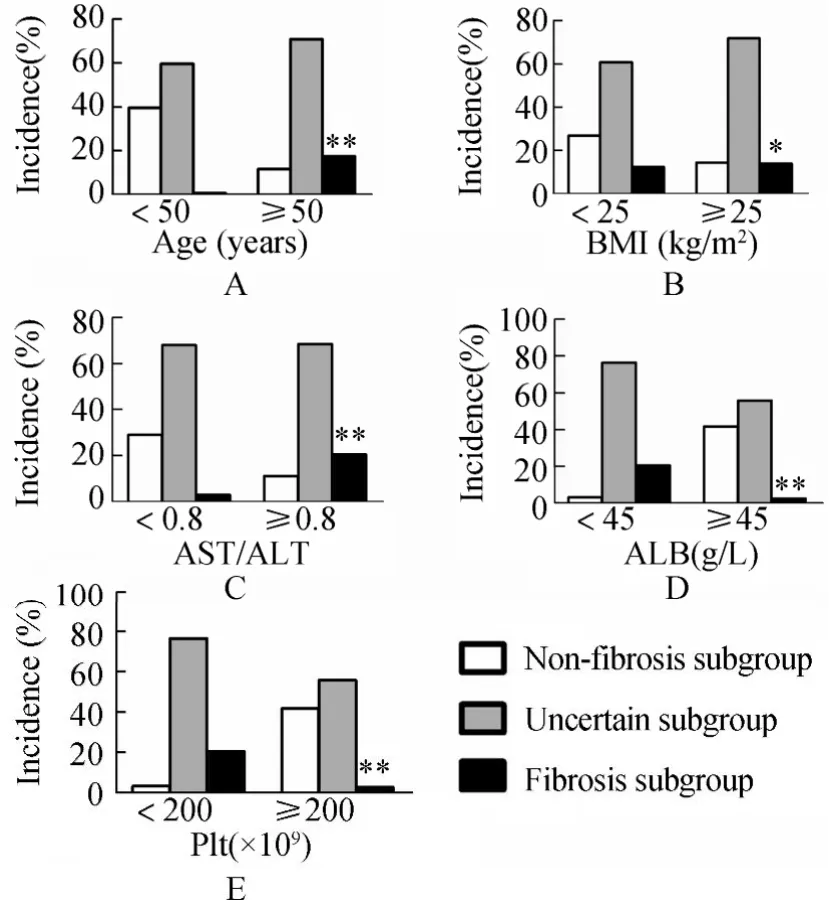
图1 按脂肪肝肝纤维化危险因素分层后无纤维化、不确定纤维化、纤维化的发生率Figure 1 Prevalence of non-fibrosis, uncertain fibrosis and fibrosis in T2DM &NAFLD group after stratification
在NAFLD患者中,合并T2DM会加重脂肪肝纤维化的程度[12]。尽管之前有不少研究报道T2DM合并NAFLD的患病率及其危险因素,但目前研究T2DM合并NAFLD这个特殊人群肝纤维化程度及其危险因素的报道少见。本研究从T2DM是否合并NAFLD、T2DM合并NAFLD是否存在纤维化两个层面进行风险因素分析,发现住院T2DM合并NAFLD患者比例较大,达到了54.6%,与BMI、TG、ALT及HDL-C密切相关,而T2DM合并NAFLD患者中存在一定比例(13.4%)肝纤维化风险,与年龄、BMI、AST/ALT、白蛋白、血小板密切相关。
NAFLD是引起T2DM患者肝酶升高的首要原因,远高于病毒性肝炎和胆道疾病。本研究中T2DM合并NAFLD患者的ALT、AST、GGT水平明显比单纯T2DM患者高,且具有统计学差异。按NAFLDFS将T2DM合并NAFLD组分成3亚组,GGT水平在纤维化组中明显升高,而ALT水平则出现下降。NAFLD发生时,线粒体β−氧化代偿性增加,活性氧自由基产生增加,氧化应激的增加导致单纯性脂肪肝进展为NASH。GGT是谷氨酰转肽酶,参与谷胱甘肽在细胞外分解代谢,而谷胱甘肽是机体重要的抗氧化保护剂。GGT升高反映了肝细胞损伤,肝硬变时GGT可轻中度升高,并可作为肝纤维化简易的评判指标[9]。导致年龄、BMI升高而ALT、Plt、ALB降低的原因与在NAFLDFS计算公式中的位置有关。另外,肝是血小板生成素合成的主要场所,脂肪肝纤维化时肝细胞受损,肝合成蛋白的能力下降,血小板生成素合成减少,亦会导致Plt减少。血压与患者的年龄及BMI等因素密切相关,可能是T2DM合并NAFLD分组后患者收缩压升高的主要原因。肝是糖代谢、脂类代谢的枢纽,肝纤维化时,肝细胞结构及功能遭受不同程度的破坏,势必会导致血糖、血脂的异常。本研究中,T2DM合并NAFLD患者TG水平比单纯T2DM患者高,但伴随着脂肪肝纤维化的发生,TG的水平呈现下降的趋势,而HbA1c水平则出现逐渐升高,这一结果符合目前NAFLD患者肝活检样本量最大的回顾性队列研究结果[12]。TG主要由肝合成,与蛋白质结合成为脂蛋白后才能呈溶解的状态在血浆中转运,肝纤维化后肝功能受损,TG下降与肝内源性脂蛋白合成减少有关。HbA1c反映的是受检者近2~3个月的平均血糖水平,具有变异性小、重复性好等优势,是血糖监控的重要参考指标,而FBG、2hPBG反映的是两个时间点的血糖值,容易波动、重复性差[13]。本研究中FBG在3组之间差异无统计学意义,2hPBG随着纤维化的发生有逐渐上升的趋势,但未出现统计学意义,考虑与肝纤维化后血糖的波动有关[14],提示HbA1c可能是T2DM合并NAFLD肝纤维化患者血糖评估的较稳定指标。肝是维持血糖水平相对稳定的重要器官,肝纤维化后,肝糖摄取减少及肝糖原合成受损,导致HbA1c水平升高。肥胖、糖耐量异常与NAFLD关系密切。反之,T2DM或者糖耐量异常又是NAFLD肝纤维化的危险因素,体外细胞实验表明,高糖、高胰岛素能刺激结缔组织生长因子(connective tissue growth factor,CTGF)表达,CTGF是肝纤维化发生的重要机制之一[15]。
在T2DM合并NAFLD这个特殊人群中,利用NAFLDFS,预测肝纤维化的程度,及早对肝纤维化进行干预,对控制并发症及改善预后具有重要意义。
【参考文献】
[1]Zhou J, Jia WP, Bao YQ,et al. Study on prevalence and risk factors of fatty liver of patients with type 2 diabetes[J]. Nat1 Med J China, 2007, 87(32):2249−2252.[周 健, 贾伟平, 包玉倩, 等. 2型糖尿病患者脂肪肝患病率调查及危险因素分析[J]. 中华医学杂志, 2007,87(32):2249−2252.]
[2]Angulo P. Nonalcoholic fatty liver disease[J]. Rev Gastroentero1 Mex, 2005, 70 Supp1 3:52−56.
[3]Gramlich T, Kleiner DE, McCullough AJ,et al.Pathologic features associated with fibrosis in nonalcoholic fatty liver disease[J]. Hum Pathol, 2004,35(2):196−199.
[4]Angulo P, Hui JM, Marchesini G,et al. The NAFLD fibrosis score:a noninvasive system that identifies liver fibrosis in patients with NAFLD[J]. Hepatology, 2007,45(4):846−854.
[5]LI X, Zhou ZG, Qi HY,et al. Replacement of insulin by fasting C-peptide in modified homeostasis model assessment to eva1uate insu1in resistance and is1et β ce11 function[J]. J Cent South Univ(Med Sci), 2004, 29(4):419−423. [李 霞, 周智广, 亓海英, 等. 用空腹C肽代替胰岛素改良HOMA公式评价胰岛素抵抗和胰岛β细胞功能[J]. 中南大学学报(医学版), 2004, 29(4):419−423.]
[6]Fatty Liver and Alcoholic Liver Disease Study Group of the Chinese Society of Liver Disease. Guidelines for Diagnosis and Treatment of Nonalcoholic Fatty Liver Diseases[J]. Chin J Hepato1, 2006, 14(3):161−163. [中华医学会肝脏病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南[J]. 中华肝脏病杂志, 2006,14(3):161−163.]
[7]Liver Disease and Metabolic Disorders Research Group(preparing), Chinese Society of Endocrinology.Consensus for Diagnosis and Treatment of Nonalcoholic Fatty Liver Diseases and Metabolic Disorders[J]. Chin J Endocrino1 Metab, 2010, 26(7):531−534. [中华医学会内分泌学分会肝病与代谢学组. 中华医学会内分泌学分会“非酒精性脂肪性肝病与相关代谢紊乱诊疗共识”[J].中华内分泌代谢杂志, 2010, 26(7):531−534.]
[8]Adams LA, Lymp JF, St Sauver J,et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study[J]. Gastroenterology, 2005,129(1):113−121.
[9]Leite NC, Villela-Nogueira CA, Pannain VL,et al.Histopathological stages of nonalcoholic fatty liver disease in type 2 diabetes:prevalences and correlated factors[J]. Liver Int, 2011, 31(5):700−706.
[10]Chalasani N, Younossi Z, Lavine JE,et al. The Diagnosis and Management of Non-Alcoholic Fatty Liver Disease:Practice Guideline by the American Gastroenterological Association, American Association for the Study of Liver Diseases, and American College of Gastroenterology[J].Gastroentero1ogy, 2012, 142(7):1592−1609.
[11]Angulo P, Bugianesi E, Bjornsson ES,et al. Simple noninvasive systems predict long-term outcomes of patients with nonalcoholic fatty liver disease[J].Gastroenterology, 2013, 145(4):782−789. e4.
[12]Nakahara T, Hyogo H, Yoneda M,et al. Type 2 diabetes mellitus is associated with the fibrosis severity in patients with nonalcoholic fatty liver disease in a large retrospective cohort of Japanese patients[J]. J Gastroenterol, 2013. [Epub ahead of print]
[13]Kilpatrick ES, Atkin SL. Using haemoglobin A(1c) to diagnose type 2 diabetes or to identify people at high risk of diabetes[J]. BMJ, 2014, 348:g2867.
[14]Hashiba M, Ono M, Hyogo H,et al. Glycemic variability is an independent predictive factor for development of hepatic fibrosis in nonalcoholic fatty liver disease[J].PLoS One, 2013, 8(11):e76161.
[15]Paradis V, Perlemuter G, Bonvoust F,et al. High glucose and hyperinsulinemia stimulate connective tissue growth factor expression:a potential mechanism involved in progression to fibrosis in nonalcoholic steatohepatitis[J].Hepato1ogy, 2001, 34(4 Pt 1):738−744.
