维生素D功能的再认识
2014-04-27王永吉
程 佳, 王永吉
(陕西理工学院维生素D生理与应用研究所,陕西 汉中 723000)
1 维生素D的发现
20世纪早期,美国威斯康辛大学(University ofWisconsin)和耶鲁大学(Yale University)首先发现了维生素A和B[1-2]。维生素A和B的问世清楚地表明人体必需的营养组份——维生素的存在。同时,维生素的发现使远在英国的Mellanby相信佝偻病可能是一种食物营养组份缺乏性疾病[3]。Mellanby通过实验发现混合鱼肝油的食物可以预防和治愈狗的佝偻病。而鱼肝油含有丰富的维生素A,所以Mellanby认为治疗佝偻病是维生素A的另一功能[3]。然而,人工或阳光来源的紫外线照射也能治愈佝偻病[4-5]。当时很难理解毫不相关的鱼肝油和阳光对佝偻病有相同的治疗作用。与此同时,威斯康辛大学的Steenbock不仅证明了接触紫外线照射的动物或食物可以治愈佝偻病[6-7],而且还发现紫外光可以活化食物中的脂质成分[8]。这些结果表明,阳光照射所产生的治愈佝偻病的化合物也可能存在于鱼肝油中。此时,McCollum已从威斯康辛大学转到约翰霍普金斯大学(John Hopkins University),他证明氧破坏了鱼肝油中维生素A的活力,但并没有影响其治愈佝偻病的能力。因此,他将鱼肝油中治疗佝偻病的营养组份命名为“维生素D”(vitamin D)[9],从此开启了维生素D近百年的研究历程[10]。
2 维生素D的功能性代谢
维生素D2和D3是自然界中最主要的维生素D成员。维生素D2来源于植物,而维生素D3则来源于动物。如前所述,鱼肝油的维生素D3含量比较丰富,黄油、奶油和蛋黄中含有一定量的维生素D3,强化维生素D牛奶通常也含有适量的维生素D3[11]。在植物中,尤其是真菌中含有一定量的维生素D2。
在人和动物体内,维生素D3来源于皮肤中的7-脱氢胆固醇(7-dehydrocholesterol,7-DHC),它是维生素D3前体(pre-vitamin D3)。7-DHC在紫外光的作用下才能转化为维生素D3。人体内维生素D3的含量会受到饮食、居住地区纬度、日照时间以及个体肤色、年龄、性别和生理状况(如怀孕)等因素的影响[12]。紫外线也可以将植物和真菌(酵母)中的麦角甾醇(ergosterol)转化为维生素D2。由于维生素D合成与阳光有密切关系,所以维生素D又可称为“阳光维生素”。维生素D2和D3的化学结构极为相似,它们有类似的生理功能,均可作为补充维生素D的原料。
然而,维生素D本身没有生理活性,它只是活性维生素D的前体(prohormone)。如图1所示,维生素D的第一次修饰在肝脏中进行,主要是由肝脏微粒体的细胞色素P450(CYP)2R1酶催化完成25-位的羟基化[13]。此外,还有另一种CYP酶存在的假设,它也可以产生25-羟化维生素D(25(OH)D),但目前尚未得到证实[14]。血液中的维生素D或25(OH)D是当前用于评估人和动物维生素D健康状况的指标。25(OH)D最终会在肾脏近曲小管细胞内(可能还有其它细胞)[15-17]由CYP27B1酶转化为1α,25-二羟基维生素D(1α,25(OH)2D),即活性维生素D[18-20]。维生素D的整个代谢过程会受到精确调控,以保证活性维生素D的正常水平[21-22]。如血液中Ca2+、甲状旁腺激素(parathyroid hormone,PTH)以及成纤维生长因子(fibroblast growth factor 23,FGF23)等参与调节CYP7B1的基因表达和功能[23],影响1α,25(OH)2D的产生。正是由于激素形式的活性维生素D的发现,推动了血浆钙和磷调节维生素D内分泌系统的建立。
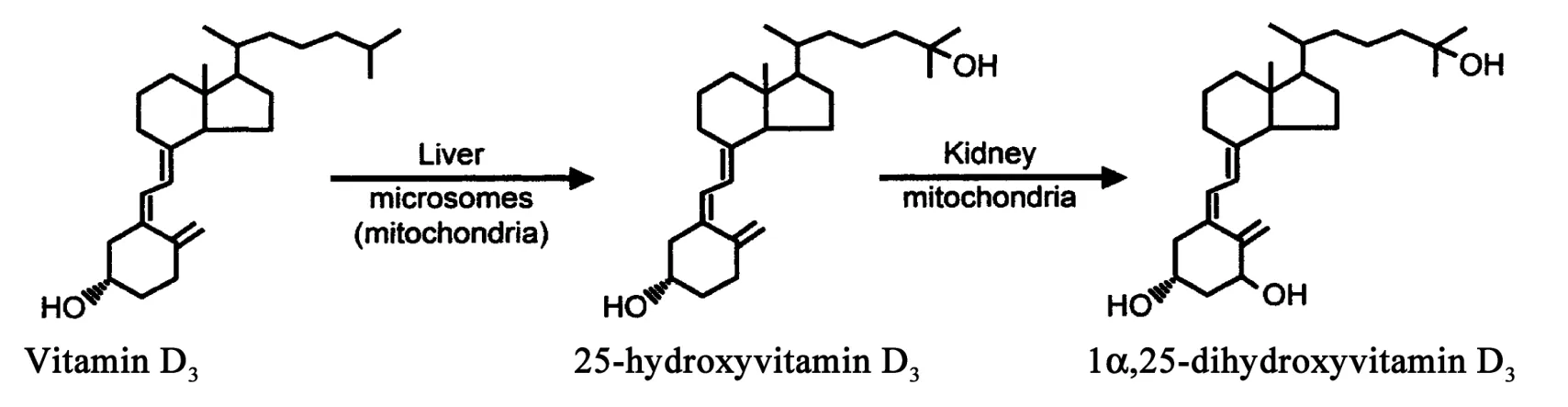
图1 体内维生素D的转化过程
3 维生素D调控靶基因表达
维生素D通过靶细胞核内受体发挥作用的机制是另一项重要发现。Brumbaugh和Haussler[24](1975)第一个鉴定出特异性结合1α,25(OH)2D的蛋白质,即维生素 D受体(vitamin D receptor,VDR)。随后,数个VDR基因敲除动物模型的构建进一步证明了这种受体蛋白质对维生素D功能的必要性[25-26]。尽管,基于体外细胞实验的研究发现,可能还存在不依赖于VDR的非基因组机制[27],但到目前为止,还没有足够的证据表明活体内也会发生这样的机制。
自克隆得到VDR基因[28-29]以及结晶出其配体结合结构域以来[30-31],大量分子水平上的研究试图解释维生素D激素和受体的作用是如何调节基因转录以实现维生素D功能的。在靶基因的转录过程中,维生素D响应元件(vitamin D response elements,VDREs)是由三个非特定碱基对分开的两个六碱基重复体(heximer)组成,VDR与视黄醇X受体(retinoid X receptor,RXR)形成的二聚体能够识别并结合VDREs[32]。维生素D的靶基因上可能存在多个这样的结合位点[33]。研究显示,大约3%的小鼠或人类基因会受维生素D内分泌系统直接或间接的调控[34]。而在1α,25(OH)2D靶基因转录的调节区域,已经发现有1600~2800个VDR的结合位点,但目前只验证了其中的一小部分[35-36]。
人类的VDR基因位于染色体12q12-q14,含11个外显子,全长约10 kb,由427个氨基酸残基构成,分子量48 kDa,含有多个功能域[37]。核受体VDR属于类固醇/甲状腺激素受体超家族的成员之一。如图2所示,1α,25(OH)2D进入细胞后,结合在VDR的配体结合域上,引起VDR构象改变,与视黄酸X受体形成二聚体[38]。激活的VDR结合于靶基因 VDREs,激活或抑制靶基因的表达[39]。研究发现,VDR在小肠、肾脏和骨组织中的表达量较高[40],因此这些组织都是维生素D重要的靶器官。

图2 维生素D受体调控靶基因转录的机理
4 维生素D的经典生理功能
血浆钙水平对骨骼的矿化,防止低血钙引起的抽搐、痉挛等症状都是必需的。维生素D能够通过以下3种机制增加血浆钙:首先是增加肠对钙的主动转运,由肠内腔细胞逆钙浓度梯度自肠腔向血浆转运[41-42]。同时,活性维生素D还调节磷酸盐的吸收[43-44]。其次,当饮食中的钙含量极低时,肠道内钙运输系统不能维持血钙的过饱和水平情况下,为防止低血钙抽搐,动员破骨细胞使骨钙从骨流体隔室(bone fluid compartment)转送到血浆隔室(plasma compartment)。这一过程引起了骨吸收(resorption),却提高了血浆钙水平[45-47]。在钙动员的过程中需要两种激素,即维生素D激素和甲状旁腺激素(parathyroid hormone,PTH)。PTH引起的骨吸收需要维生素D,反之亦然[48-49]。第三,维生素D激素和PTH协同调节远端肾小管,由肾脏回收尿液中1%的钙[50]。尽管从尿液中回收的钙量微乎其微(0.07 g/d),但对钙稳态的贡献是必不可少的。
血清钙的水平被严格控制在1mmol/L的离子钙或10 mg/dL总钙的范围内。当Ca2+浓度略低于正常水平,甲状旁腺就会分泌PTH。一方面,PTH作用于成骨细胞,以促进破骨细胞的骨吸收过程[51];另一方面,PTH还可以与维生素D激素一起作用于远端肾小管,以影响钙的重吸收过程[50]。此外,PTH主要刺激肾脏产生维生素D激素[21-22,52]。由此产生的维生素D激素会作用于小肠、骨骼和肾脏,这有利于小肠钙的主动转运,骨骼的再吸收和肾脏钙的重吸收过程,以提高血浆中的钙浓度,清除设定点(set point),并关闭PTH的分泌。上述过程还会由甲状腺滤泡旁(parafollicular)或C细胞分泌的降钙素(calcitonin)参与调控。降钙素除了可以阻断骨的再吸收以防止血清钙浓度过高[53],还可以下调维生素D激素水平,以确保在高血浆钙离子浓度的条件下,尽量减少维生素D激素[54]。
5 维生素D调节钙磷代谢以外的生理功能
由于VDR分布于机体的多种组织和器官[55-57],所以维生素D在调节钙磷代谢以外的生理功能同样值得关注。维生素D的活性代谢产物最先应用于治疗失去肾脏的病人,因为他们无法产生血液循环1α,25(OH)2D,因此导致低钙血症,并引起甲状旁腺分泌大量的PTH。PTH进一步与少量残留的维生素D激素共同过度侵蚀骨组织,最终导致肾性骨病。而在临床实践中,维生素D药物可以抑制PTH的过度产生和甲状旁腺增生[58-59]。实际上,这也是当今维生素D激素及其类似物在医药领域应用的主要方式。目前,至少有4种1α,25(OH)2D的类似物正在使用或研发,它们被用于治疗肾衰竭继发性甲状旁腺功能亢进(secondary hyperparathyroidism)。
研究结果显示,VDR存在于免疫细胞中[40]。同时巨噬细胞的免疫活性依赖于25(OH)D的水平,其内有CYP27B1的表达和1α,25(OH)2D的合成[60]。这些结果都表明维生素D在免疫系统中的重要作用。I型糖尿病和多发性硬化症(multiple sclerosis,MS)等自身免疫性疾病已被列为维生素D药物治疗的潜在领域。在患有 I型糖尿病的小鼠胰岛细胞中检测出大量 VDR的表达[40]。Zella等人[61](2003)的研究表明:非肥胖糖尿病(NOD)小鼠缺乏维生素D会增加其发病率,而补充维生素D3能显著降低或延迟I型糖尿病的发病。重要的是,1α,25(OH)2D能够阻止糖尿病的发生(Hansen et al,unpublished results)。由此可见,维生素D有可能预防I型糖尿病的发生。多发性硬化症(MS)是一种在北半球和南半球的高纬度地区发病率高,但在赤道地区极少出现的疾病[62],其可能与维生素D的水平有关。进一步研究发现,在MS的小鼠模型中,1α,25(OH)2D可阻断其自身免疫性脑脊髓炎(EAE)[63],但同时伴有高钙血症。因而,尚不能确定是维生素D还是钙抑制了EAE的发病[64]。
有关研究显示,大肠癌和乳腺癌的发病率降低与血液中高浓度的1α,25(OH)2D密切相关[65]。目前,有些回顾性流行病学的研究(retrospective epidemiological study)同样支持了这个观点[65]。Abe等人(1981)认为 1α,25(OH)2D可抑制体外培养白血病细胞的生长,促进其分化为单核细胞[66]。1α,25(OH)2D通过调控乳腺、结肠、前列腺等各组织中的靶基因,进一步调节细胞增殖,刺激分化,诱导凋亡以及抑制血管生成[67]。因此,维生素D可能会有效的治疗或预防癌症。然而,各项研究结果并不一致,如维生素D对癌细胞生长或癌症发病率没有任何效果[65];1α,25(OH)2D也没有对体内大肠肿瘤有显著的作用[68]。我们的研究表明,在多种肿瘤细胞中存在VDR。而VDR的存在是细胞对维生素D药物反应的决定性因素[69],因此,我们认为维生素D系统在肿瘤发生和发展过程中有一定的作用。
6 小结
研究表明,健康人体血液25(OH)D含量应维持在30~60 ng/mL(75~150 nmol/L)范围内[11],低于30 ng/mL的人群应适当补充维生素D。国际学术界建议的维生素D每天摄入量要高于WTO的推荐用量(400 IU或10μg/天)。可以肯定的是,适量补充维生素D能够改善人体健康水平,对预防和治疗包括骨质疏松、自体免疫疾病、糖尿病、癌症和心血管病在内的多种疾病的发生和发展有一定的积极意义[12,70-71]。随着我国城市化进程的加快、生活方式的改变以及老龄化社会的到来,维生素D的健康状况必将受到越来越多的重视。
[1]MCCOLLUM E V,DAVISM.The necessity of certain lipins in the diet during growth[J].J.Biol.Chem.,1913(15):167-175.
[2]MCCOLLUM E V,SIMMONSN,PITZW.The relation of the unidentified dietary factors,the fat-soluble A and water-soluble B of the diet to the growth promoting properties ofmilk[J].J.Biol.Chem.,1916(27):33-38.
[3]MELLANBY E.An experimental investigation on rickets[J].Lancet,1919(1):407-412.
[4]BILLSC E.Chemistry[M]//SEBERLL JrW H,HARRISR S.The Vitamins Chemistry,Physiology,Pathology:vol.II.New York:Academic Press,1954:162.
[5]CHICK H,PALZELL E J,HUMME EM.Studies of rickets in Vienna 1919-1922[R]//Medical Research Council,Special Report:No.77.London:HMSO,1923.
[6]STEENBOCK H.The induction of growth promoting and calcifying properties in a ration by exposure to light[J].Science,1924(60):224-225.
[7]STEENBOCK H,BLACK A.Fat-soluble vitamins.XVII.The induction ofgrowth promoting and calcifying properties in a ration by exposure to ultraviolet light[J].J.Biol.Chem.,1924(61):405-422.
[8]STEENBOCK H,BLACK A.Fat-soluble vitamins.XXIII.The induction of growth promoting and calcifying properties in rats and their unsaponifiable constituents by exposure to light[J].J.Biol.Chem.,1925(64):263-298.
[9]MCCOLLUM E V,SIMMONDSN,BECKER JE,et al.An experimental demonstration of the existence of a vitamin which promotes calcium deposition[J].J.Biol.Chem.,1922(53):293-298.
[10]DELUCA H F.Vitamin D:Bones and beyond[J].JAnim Sci.,2014,92(3):917-929.
[11]HOLICK M F.Vitamin D Deficiency[J].N Engl JMed,2007(357):266-281.
[12]PAUL Lips,NATASJA Van Schoor.Worldwide Vitamin D Status[M]//FELDMAN D,PIKE JW,ADAMS JS.Vita-min D:vol VII.3rd ed.Burlington:Elsevier Academic Press,2011:947-957.
[13]CHENG JB,MOTOLA D L,MANGELSDORFD J,etal.De-orphanization of cytochrome P4502R1:amicrosomal vitamin D 25-hydroxylase[J].J.Biol.Chem.,2003,278(39):38084-38093.
[14]ZHU JG,OCHALEK JT,KAUFMANNM,et al.CYP2R1 is amajor,butnot exclusive,contributor to 25-hydroxyvitamin D production in vivo[J].Proc.Natl.Acad.Sci.USA,2013,110(39):15650-15655.
[15]BRUNETTE M G,CHAN M,FERRIERE C,et al.Site of 1,25-dihydroxyvitamin D3synthesis in the kidney[J].Nature,1978(276):287-289.
[16]FRASER DR,KODICEK E.Unique biosynthesis by kidney of a biologically active vitamin D metabolite[J].Nature,1970(228):764-766.
[17]GRAY R,BOYLE I,DELUCA H F.Vitamin Dmetabolism:The role of kidney tissue[J].Science,1971(172):1232-1234.
[18]SHINKIT,SHIMADA H ,AKINO S,et al.Cloning and expression of rat25-hydroxyvitamin D3-1α-hydroxylase cDNA[J].Proc.Natl.Acad.Sci.USA,1997,94(24):12920-12925.
[19]ST-ARNAUD R,MESSERLIAN S,MOIR JM,et al.The 25-hydroxyvitamin D 1α-hydroxylase genemaps to the pseudovitamin D deficiency rickets(PDDR)disease locus[J].J.Boneminer.Res.,1997,12(10):1552-1558.
[20]TAKAYAMA K,KITANAKA S,SATO T,et al.25-Hydroxyvitamin D3-1α-hydroxylase and vitamin D synthesis[J].Science,1997(277):1827-1830.
[21]BOYLE IT,GRAY R W,DELUCA H F.Regulation by calcium of in vivo synthesis of 1,25-dihydroxycholecalciferol and 21,25-dihydroxycholecalciferol[J].Proc.Natl.Acad.Sci.USA,1971,68(9):2131-2134.
[22]DELUCA H F.Vitamin D:The vitamin and the hormone[J].Fed.Proc.,1974,33(11):2211-2219.
[23]ZIEROLD C,DARWISH H M,DELUCA H F.Two vitamin D response elements function in the rat1,25-dihydroxyvitamin D 24-hydroxylase promoter[J].J.Biol.Chem.,1995,270(4):1675-1678.
[24]BRUMBAUGH P F,HAUSSLER M R.Specific binding of 1α,25-dihydroxycholecalciferol to nuclear components of chick intestine[J].J.Biol.Chem.,1975,250(4):1588-1594.
[25]LIY C,PIRRO A E,AMLINGM,etal.Targeted ablation of the vitamin D receptor:An animalmodel of vitamin D-dependent rickets type IIwith alopecia[J].Proc.Natl.Acad.Sci.USA,1997,94(18):9831-9835.
[26]YOSHIZAWA T,HANDA Y,UEMATSU Y,etal.Mice lacking the vitamin D receptor exhibit impaired bone formation,uterine hypoplasia and growth retardation after weaning[J].Nat.Genet.,1997,16(4):391-396.
[27]NORMAN AW.1α,25(OH)2-vitamin D3mediated rapid and genomic responses are dependent upon critical structurefunction relationships for both the ligand and receptor(s)[M]//FELDMAN D,PIKE JW,GLORIEUX F H.Vitamins:vol II.2nd ed.Burlington:Elsevier Academic Press,2005:381-410.
[28]BAKER A R,MCDONNELLD P,HUGHESM,etal.Cloning and expression of full-length cDNA encoding human vitamin D receptor[J].Proc.Natl.Acad.Sci.USA,1988,85(10):3294-3298.
[29]BURMESTER J K,MAEDA N,DELUCA H F.Isolation and expression of rat 1,25-dihydroxyvitamin D3receptor cDNA[J].Proc.Natl.Acad.Sci.USA,1988,85(4):1005-1009.
[30]ROCHEL N,WURTZ JM,MITSCHLER A,et al.The crystal structure of the nuclear receptor for vitamin D bound to its natural ligand[J].Mol.Cell,2000,5(1):173-179.
[31]VANHOOKE JL,BENNINGM M,BAUER CB,etal.Molecular structure of the rat vitamin D receptor ligand binding domain complexed with 2-carbonsubstituted vitamin D3hormone analogues and a LXXLL-containing coactivator peptide[J].Biochemistry,2004,43(14):4101-4110.
[32]UMESONO K,MURAKAMIK K,THOMPSON CC,et al.Direct repeats as selective response elements for the thyroid hormone,retinoic acid,and vitamin D3receptors[J].Cell,1991,65(7):1255-1266.
[33]PIKE JW.Genome-wide principles ofgene regulation by the vitamin D receptor and its activating ligand[J].Mol.Cell.Endocrinol.,2011(347):3-10.
[34]KRIEBITZSCH C,VERLINDEN L,EELEN G,et al.The impact of 1,25(OH)2D3and its structural analogs on gene expression in cancer cells-amicroarray approach[J].Anticancer Res,2009,29(9):3471-3483.
[35]CARLBERG C,SEUTER S,HEIKKINEN S.The firstgenome-wide view of vitamin D receptor locations and theirmechanistic implications[J].Anticancer Res,2012,32(1):271-282.
[36]PIKE JW,MEYER M B.The vitamin D receptor:new paradigms for the regulation of gene expression by 1,25-dihydroxyvitamin D3[J].Rheum.Dis.Clin.North Am,2012,38(1):13-27.
[37]SZPIRER J,SZPIRER C,RIVIERE M,et al.The Sp1 transcription factor gene(SP1)and the 1,25-dihydroxyvitamin D3receptor gene(VDR)are colocalized on human chromosome arm 12q and rat chromosome 7[J].Genomics.1991,11(1):168-173.
[38]YLIKOMI T,LAAKSI I,LOU Y R,et al.Antiproliferative action of vitamin D[J].J Vitamins and Hormones,2002(64):357-406.
[39]ISSA L L,LEONG G M,EISMAN JA.Molecular mechanism of vitamin D receptor action[J].Inflamm Res,1998,47(12):451-475.
[40]WANG Y,ZHU J,DELUCA H F.Where is the vitamin D receptor?[J].Arch.Biochem.Biophys.,2012,523(1):123-133.
[41]DOWDLE E B,SCHACHTER D,SCHENKER H.Requirement for vitamin D for the active transport of calcium by the intestine[J].Am.J.Physiol.,1960(198):269-274.
[42]WALLING M W,ROTHMAN SS.Phosphate-independent,carrier-mediated active transport of calcium by rat intestine[J].Am.J.Physiol.,1969,217(4):1144-1148.
[43]CHEN T C,CASTILLO L,KORYCKA-DAJLM,et al.Role of vitamin Dmetabolites in phosphate transport of rat intestine[J].J.Nutr.,1974,104(8):1056-1060.
[44]LEE D B,WALLINGM W,CORRY D B.Phosphate transport across rat jejunum:influence of sodium,pH,and 1,25-dihydroxyvitamin D3[J].Am.J.Physiol.,1986(251):90-95.
[45]CARLSSON A.Tracer experiment on the effect of vitamin D on the skeletalmetabolism of calcium and phosphorus[J].Acta Physiol.Scand.,1952(26):212-220.
[46]BAUER G CH,CARLSSON A,LINDQUISTB.Evaluation of accretion,resorption and exchange reactions in the skeleton[J].Kungl.Fysiograf.Sallskapets I.Lund Forhandlingar,1955(25):3-18.
[47]JONESG,STRUGNELL SA,DELUCA H F.Current understanding of themolecular actions of vitamin D[J].Physiol.Rev.,1998,78(4):1193-1231.
[48]RASMUSSEN H,DELUCA H,ARNAUD C,et al.The relationship between vitamin D and parathyroid hormone[J].J.Clin.Invest.,1963(42):1940-1946.
[49]GARABEDIANM,TANAKA Y,HOLICK M F,etal.Response of intestinal calcium transportand bone calcium mobilization to 1,25-dihydroxyvitamin D3in thyroparathyroidectomized rats[J].Endocrinology,1974,94(4):1022-1027.
[50]YAMAMOTO M,KAWANOBE Y,TAKAHASHIH,et al.Vitamin D deficiency and renal calcium transport in the rat[J].J.Clin.Invest.,1984,74(2):507-513.
[51]HEERSCHE JN M,BELLOW C G,AUBIN JE.Cellular actions of parathyroid hormone on osteoblast and osteoclast differentiation[M]//Bilezikian JP,Marcus R,Levine M A.The Parathyroids:Basic and Clinical Concepts.New York:Raven Press,1994:83-91.
[52]GARABEDIAN M,HOLICK M F,DELUCA H F,et al.Control of 25-hydroxycholecalciferolmetabolism by parathyroid glands[J].Proc.Natl.Acad.Sci.USA,1972,69(7):1673-1676.
[53]DEFTOSL J.Regulation of calcitonin secretion:Effects of species,age,and sex[M]//COHN D V,TALMAGE R V,MATTHEWS JL.Hormonal Control of Calcium Metabolism.Proceedings of the Seventh International Conference on Calcium Regulating Hormones.New York:Excerpta Medica,1981:266-280.
[54]SHINKIT,UENO Y,DELUACA H F,et al.Calcitonin is amajor regulator for the expression of renal 25-hydroxyvitamin D3-1α-hydroxylase gene in normocalcemic rats[J].Proc.Natl.Acad.Sci.,1999,96(14):8253-8258.
[55]PLUM L A,DELUCA H F.Vitamin D,disease and therapeutic opportunities[J].NatRev Drug Discov,2010,9(12):941-955.
[56]WANG Y,DELUCA H F.Is the Vitamin DReceptor Found in Muscle?[J].Endocrinology,2011,152(2):354-363.
[57]WANG Y,BORCHERTM L,DELUCA H F.Identification of the vitamin D receptor in various cells of themouse kidney[J].Kidney Int,2012,81(10):993-1001.
[58]LLACH F,KESHAV G,GOLDBLATM V,etal.Suppression of parathyroid hormone secretion in hemodialysis patients by a novel vitamin D analogue:19-nor-1,25-dihydroxyvitamin D2[J].Am.J.Kidney Dis.,1998(32):48-54.
[59]SLATOPOLSKY E,FINCH JL,BROWN A J,et al.Effect of2-methylene-19-nor-(20S)-1α-hydroxybishomopregnacalciferol(2MbisP),an analog of vitamin D,on secondary hyperparathyroidism[J].J.Boneminer.Res.,2007,22(5):686-694.
[60]REN S,NGUYEN L,WU S,et al.Alternative splicing of vitamin D-24-hydroxylase:a novelmechanism for the regulation of extrarenal 1,25-dihydroxyvitamin D synthesis[J].J.Biol.Chem,2005,280(21):20604-20611.
[61]ZELLA JB,DELUCA H F.Vitamin D and autoimmune diabetes[J].J.Cell.Biochem.,2003,88(2):216-222.
[62]GOLDBERG P.Multiple sclerosis:Vitamin D and calcium as environmental determinants of prevalence(a viewpoint).Part1:Biochemical and genetic factors[J].Int.J.Environ.Studies,1974(6):19-27.
[63]CANTORNA M T,HAYESCE,DELUCA H F.1,25-Dihydroxyvitamin D3reversibly blocks the progression of relapsing encephalomyelitis,amodel ofmultiple sclerosis[J].Proc.Natl.Acad.Sci.USA,1996,93(15):7861-7864.
[64]DELUCA H F,PLUM L A.Vitamin D deficiency diminishes the severity and delays onset of experimental autoimmune encephalomyelitis[J].Arch.Biochem.Biophys.,2011,513(2):140-143.
[65]ROSSA C,TAYLOR C L,YAKTINE A L,et al.Institute of Medicine Committee to Review Dietary Reference Intakes for Vitamin D and Calcium[M].Washington:The National Academies Press,2011:135-147.
[66]ABE E,MIYAURA C,SAKAGAMIH,et al.Differentiation ofmouse myeloid leukemia cells induced by 1α,25-dihydroxyvitamin D3[J].Proc.Natl.Acad.Sci.,1981,78(8):4990-4994.
[67]DEEB K K,TRUMPD L,JOHNSON CS.Vitamin D signalling pathways in cancer:potential for anticancer therapeutics[J].Nat Rev Cancer,2007,7(9):684-700.
[68]IRVING A A,HALBERG R B,ALBRECHTD M,et al.Supplementation by vitamin D compounds does not affect colonic tumor development in vitamin D sufficientmurine[J].Arch.Biochem.Biophys.,2011(515):64-71.
[69]PIKE JW,ZELLA LA,MEYERM B,etal.Molecular actions of1,25-dihydroxyvitamin D3on genes involved in calcium homeostasis[J].JBoneminer Res,2007,22(2):16-19.
[70]LIPSP.Vitamin D hysiology[J].Prog Biophys Mol Biol,2006,92(1):4-8.
[71]BELLE Van T L,GYSEMANSC,MATHIEU C.Vitamin D and diabetes:the odd couple[J].Trends EndocrinolMetab,2013,24(11):561-568.
