催化剂对非水解溶胶-凝胶法低温制备氧化钛的影响
2014-04-26廖奇丽江伟辉彭永烽
廖奇丽,江伟辉,冯 果,彭永烽
(1. 佛山市华夏建筑陶瓷研究开发中心有限公司,广东 佛山 528061;2. 景德镇陶瓷学院,江西 景德镇 333001;3. 司马化工(佛山)有限公司,广东 佛山 528000)
催化剂对非水解溶胶-凝胶法低温制备氧化钛的影响
廖奇丽1,江伟辉2,冯 果2,彭永烽3
(1. 佛山市华夏建筑陶瓷研究开发中心有限公司,广东 佛山 528061;2. 景德镇陶瓷学院,江西 景德镇 333001;3. 司马化工(佛山)有限公司,广东 佛山 528000)
以四氯化钛为钛源、无水乙醇为氧供体兼溶剂,通过引入催化剂碘化锂,采用非水解溶胶-凝胶法88℃低温制备了锐钛矿型纳米氧化钛。借助XRD、TEM和FT-IR等测试手段研究了催化剂对氧化钛低温形成的影响。结果发现:催化剂的引入促进了在溶胶非水解缩聚反应过程中Ti-O-Ti键合的形成,有利于在后续的回流工艺中Ti-O-Ti键合的过饱和析晶,这是非水解低温制备氧化钛的关键;制备的纳米氧化钛具有非常高的光催化活性,加入甲基橙溶液后就有明显的降解效果,光降解率达38.8%;紫外光照2 h后的光降解率达76.8%。
氧化钛;非水解溶胶-凝胶法;乙醇;碘化锂
0 引 言
纳米氧化钛是一种重要的半导体光催化材料,它具有光催化活性高、化学性质稳定、耐化学腐蚀、廉价、无毒等特性,因而在污水处理及空气净化等方面有极好的应用价值[1~4]。TiO2有锐钛矿型、金红石型和板钛矿型三种,而有光催化作用的主要是锐钛矿型和金红石型。氧化钛的晶型和晶粒大小会显著影响其光催化效果[5]。目前纳米氧化钛的制备方法多种多样,主要有:气相氧化法[6]、水热合成法[7]、化学气相沉积法[8]、溶胶-凝胶模板法[9]。溶胶-凝胶法能制备出形貌可控、多孔的纳米氧化钛材料。然而在大多数情况下,溶胶-凝胶法获得的凝胶在低温下是无定形的,也没有光催化性能。为了使凝胶晶化,一般采用溶剂热或煅烧工艺处理,但溶剂热条件要求苛刻,进一步的煅烧处理常常导致晶粒尺寸增加,同时其比表面积和活性也会大大降低。常压低温直接晶化的纳米氧化钛制备方法的出现不仅能够有效地解决上述问题,同时,这一工艺还有节能和可直接在棉花、木材和塑料等材料上负载氧化钛的优点[10]。
在过去的几十年里,已有一些以四氯化钛为前驱体和采用不同的氧供体,通过脱卤代烷的非水解机制低温直接晶化得到了锐钛矿型纳米氧化钛的报道[11-14],这些报道通过选择一些反应活性较高的氧供体,如叔丁醇、苯甲醇等,并在超声辐射或紫外辐射的条件下促进非水解缩聚反应低温制备纳米氧化钛。上述方法存在着原料毒性大、反应剧烈不易控制等缺点。以四氯化钛为钛源、以无毒的乙醇为氧供体和溶剂,通过引入LiI作为催化剂低温制备出纳米氧化钛,具有工艺简单、反应过程容易控制等优点。目前尚未见通过催化剂来促进非水解反应低温制备纳米氧化钛的相关报道。
1 实 验
1.1 样品制备
在分别量取18mL无水乙醇(AR)放入干燥的锥形瓶A、B中,B中加入0.6 gLiI(AR),搅拌至LiI完全溶解。将锥形瓶A、B置于冰水混合物中,用吸量管两次量取8mlTiCl4(CR),迅速将吸量管插入锥形瓶A、B中至无水乙醇液面以下,使TiCl4缓慢与醇混合,形成TiCl4醇溶液,60 ℃回流1 h 后再向其中加入60 mL无水乙醇,88 ℃回流24 h后加乙醇洗涤抽滤,再用丙酮(AR)和乙醇各洗涤两次得到粉体样品,其中没有加催化剂的样品a为灰白色,而加催化剂的样品b呈黄色。
1.2 表征
利用德国D8X射线衍射仪和日本电子公司生产的GEM-2000FXⅡ型高分辨率透射电镜对所得的TiO2粉体进行晶体结构和形貌分析;利用美国Nicolet 5700型傅立叶变换红外光谱仪分析溶胶-凝胶转变过程中化学键合的变化;借助美国ASAP2020M型全自动比表面积分析仪测定粉体的比表面积;利用722型可见光分光光度计测试了粉体的光催化性能。
粉体光催化实验是以甲基橙水溶液(10 mg/L)为测试溶液,30 W紫外杀菌灯(波长254 nm)为光源,玻璃培养皿为反应器,在培养皿中,加入一定量的纳米氧化钛粉体和250 ml甲基橙溶液,搅拌均匀后放在紫外灯正下方照射,光心距为33 cm,间隔一定时间取样,经离心(转速为2000 r/min,时间为15 min)后测定。甲基橙溶液的浓度根据其吸光度的变化计算得到,再由所得的浓度值根据下式计算甲基橙的光降解率d:

其中:C0为原始浓度;C为降解后浓度。用VIS-7220型分光光度计测量溶液吸光度,测量波长为465 nm。

图1 样品a和b的XRD图谱Fig.1 XRD patterns of samples a and b
2 结果与讨论
图1为a样品(未加催化剂)、b样品(加催化剂)的XRD图谱。可以看出,没有加催化剂的样品a中在锐钛矿型氧化钛(101)面特征峰附近有一较宽的相对强度很弱的馒头峰,峰位2θ=24.52°,这个可能由锐钛矿型氧化钛(101)特征峰位置宽化和偏移形成,除此以外,别的位置没有明显衍射特称峰,结合文献[15]推断a样品以无定形的TiO2为主。而加催化剂的样品b衍射图谱中出现了锐钛矿特征衍射峰,表明样品晶化程度较好,晶体发育较为完整。
为了进一步了解样品b的显微结构,图2给出了样品b的TEM照片,从图2的(a)可以看出:制备的锐钛矿型氧化钛近似球状,团聚程度较轻,分散性较好,而且为多孔的结构,其显微结构的无序性是由于纳米氧化钛的团聚造成的。从粉体相应的电子衍射照片图可以看出:晶体的发育良好。从更高倍的图2(b)和2(c)中可以看出氧化钛的平均粒径为6~7 nm,晶粒的均匀性较好,并出现晶格条纹,表明晶体结晶良好,中间孔隙清晰,说明粉体具有多孔的结构。通过吸附/解吸测出粉体的比表面积为154 m2/g,同时测得粉体的密度为3.9 g/cm3,得出粉体的平均粒径为9.9 nm,与对粉体的101面对应的衍射峰采用谢乐公式计算的粉体的粒径为9.7 nm相近,但比图2的(b)和(c)TEM的平均粒径6~7 nm偏大,这可能是由于在TEM制样过程中,利用超声分散方法把纳米锐钛矿粉体团聚的颗粒及周围的有机物分散开来引起的,因此,样品b的平均粒径约为6~9.9 nm。

图2 样品b的TEM分析Fig.2 TEM images of sample b
红外吸收光谱法是利用物质的分子对红外辐射的吸收得到与分子结构相应的红外光图谱,从而来鉴别分子结构的方法。红外光谱可用于从特征吸收来识别不同分子的结构,即与已知化合物的光谱进行比较来识别分子中的官能团。为深入研究催化剂在以乙醇为氧供体非水解低温制备氧化钛的催化机制,采用傅立叶变换红外光谱对比研究了加催化剂和没加催化剂样品的溶胶-凝胶反应过程。首先借助红外研究了催化剂的加入对乙醇结构的影响。图3是乙醇和催化剂-乙醇溶液的红外图谱,为了使催化剂对乙醇的作用更加明显,催化剂-乙醇溶液的碘化锂和乙醇的摩尔比为1∶1。

图3 乙醇和催化剂-乙醇溶液的红外图谱Fig.3 IR spectra of ethanol and catalyst-ethanol solution
对比乙醇的红外图谱,在催化剂-乙醇溶液的红外图谱中,663.4 cm-1的O-H弯曲振动峰[16、17]红移至491.8 cm-1;1330.6 cm-1处的O-H的弯曲振动峰[16、17]消失,说明乙醇内分子内的O-H键削弱;而3332.4 cm-1处的分子间缔合O-H吸收峰[16、17]蓝移至3384.5 cm-1,说明乙醇中分子间缔合的氢键增强,这与实验过程中在实验选用的催化剂和乙醇的摩尔比0.0033∶1下,体系的沸腾温度88 ℃高于乙醇的沸点78 ℃以及对应浓度的四氯化钛乙醇溶液的沸点82.5 ℃。这是由于乙醇中的碘化锂解离成强Lewis酸Li+和弱Lewis碱I-,Li+可与Lewis碱乙醇配位[18]:
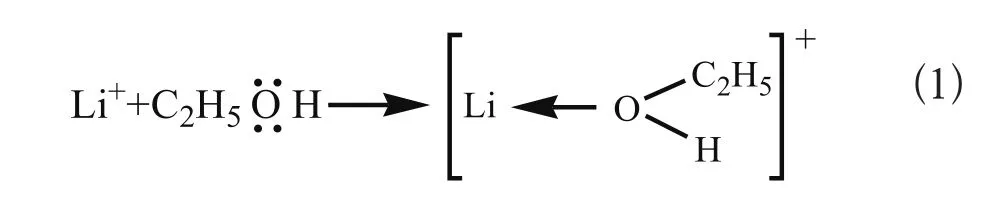
在Li+的诱导作用下,能降低O上的电荷密度,削弱了C-O和O-H,使乙醇分子易受亲核攻击或键裂[19],同时被削弱的C-O和O-H中的O易与周围的乙醇分子中的OH的氢配位形成氢键,乙醇的分子间力增大。结果说明催化剂的加入使乙醇分子中的O-H键削弱,乙醇的极性增强。
在引入催化剂低温制备氧化钛的实验中发现:在四氯化钛加入催化剂-乙醇溶液的过程中产生了大量的黄烟,而且得到的溶液为红褐色,而没加催化剂时,溶液为黄绿色。为了探明加催化剂时产生的黄烟为何种气体,将这种气体冷凝回流收集溶解于苯中,测试了苯和气体-苯溶液的红外如图4。从图4中可以看出两条红外曲线唯一的区别在于气体-苯溶液的红外图谱中在738.6 cm-1多出了一个吸收峰,这个吸收峰为C-Cl键的特征振动峰[21],说明产生的气体中存在C-Cl键,为卤代烷。

图4 苯和气体苯-溶液的红外图谱Fig.4 IR spectra of benzene and gas-benzene solution
为了进一步研究催化剂溶胶在回流过程中对锐钛矿型纳米氧化钛产生的过程及机理,对没有加催化剂和加催化剂的溶胶进行了红外光谱分析如图5。从图5中可以看出:与没有加催化剂的溶胶样品相比,加催化剂的溶胶的红外图谱中在542 cm-1和453 cm-1处出现了Ti-O-Ti键合的振动峰,833 cm-1和922 cm-1处C-O(-Ti)的振动峰减弱[22-26],而且在指纹区1110cm-1处出现了C-O-C键的特征伸缩振动峰[27]。说明催化剂的加入促进了非水解缩聚反应的进行,在溶胶中就形成了Ti-O-Ti键合,这是常压低温制备氧化钛的前提;同时溶胶中醚的特征振动峰的出现揭示了催化剂的加入使非水解缩聚反应过程中不仅有卤代烷脱去,而且有醚脱去,这是因为催化剂加入后,乙醇分子的极性增加,这使得TiCl4醇解形成TiCl2(OC2H5)2•C2H5OH后,乙醇分子中O-H的极性还足以促使进一步亲核取代反应的发生[20],形成的最终产物为TiCl4-x(OC2H5)x•C2H5OH(2<x<4),缩聚脱去的乙氧基∶氯基>1∶1。
图6为粉体b的红外图谱。从图6中可以看出:相对溶胶的红外图谱(见图5)而言,在粉体的红外图谱中,Ti-O-Ti的振动峰明显强化、宽化,而C-O(-Ti)和C-H的振动峰消失,说明非水解缩聚反应进行非常完全。同时结合粉体的XRD图谱可知形成了锐钛矿型氧化钛,这主要是因为Ti-O-Ti键合通过桥氧与其它Ti-O-Ti键合形成钛氧八面体,在溶剂乙醇不断循环流动的过程中,溶剂使凝胶网络结构坍塌,同时溶剂的蒸发造成局部Ti-O-Ti键合过饱和,并重排析出,形成共面的钛氧八面体—锐钛矿型氧化钛[28]。其中溶液循环流动法是从溶液中生长晶体的一种重要的方法[29]。
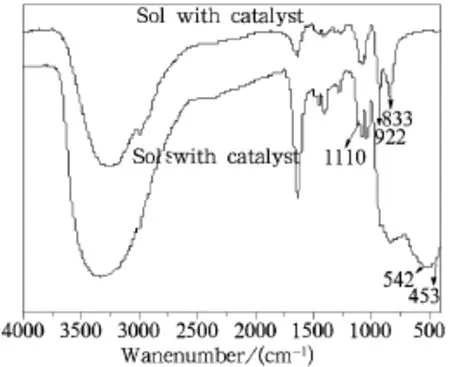
图5 两种溶胶的红外图谱Fig.5 IR spectra of two sols
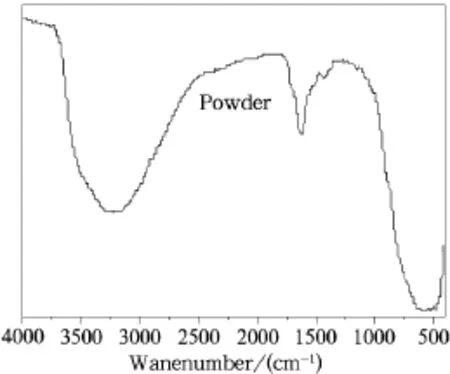
图6 溶胶和粉体的红外图谱Fig.6 IR spectra of sol and powder
综合上面的红外分析结果,总结出在这一工艺过程中,锐钛矿的形成机制为:
其中,催化剂的加入促进了非水解缩聚形成Ti-O-Ti键合的反应的进行,其催化的基本原理是催化剂中的阳离子Li+是强Lewis酸,Li+可与Lewis碱乙醇配位,在Li+的诱导作用下,能降低O上的电荷密度,削弱了C-O和O-H,使乙醇分子易受亲核攻击或键裂;同时催化剂中的阴离子I-是一种能快速与碳正离子结合的Lewis软碱,它既是一种很好的亲核试剂,又是一种很好的离去基团,是非水解脱卤代烷反应非常好的催化剂。由此可见,催化剂LiI的加入促进了形成Ti-O-Ti键合的非水解缩聚反应的进行。
图7给出了样品b对甲基橙的降解率随时间的变化关系。从图7可以看出,加入甲基橙的样品b有明显的降解效果,光降解率为38.8%,随着紫外光照时间的加长,光降解率明显增强,紫外光照2 h后的光降解率达76.8%,这主要是由于粉体的粒径细小为纳米级、其比表面积大、活性强及表面羟基化程度高共同作用的结果。
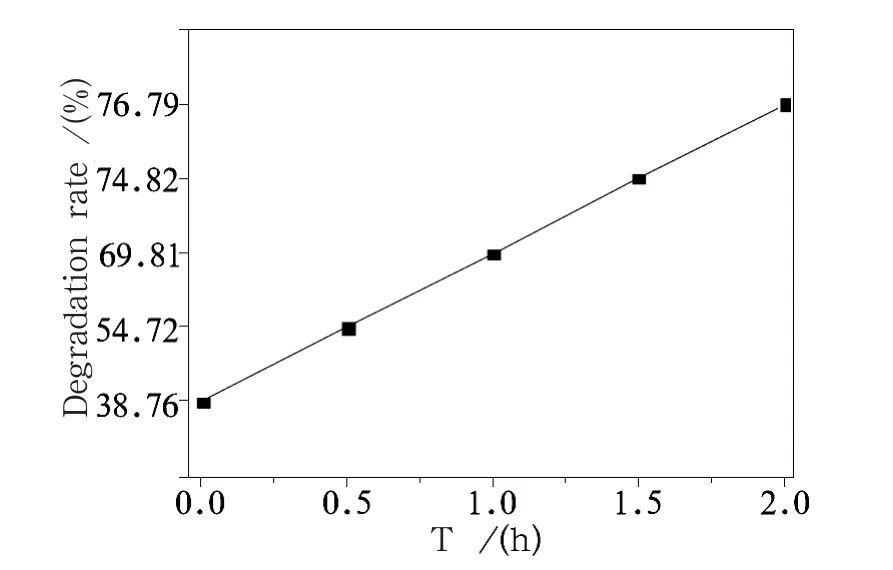
图7 样品b光降解率Fig.7 Degradation rate of powder b
3 结 论
以四氯化钛为钛源、无水乙醇为氧供体和溶剂,采用非水解溶胶-凝胶工艺,在引入催化剂LiI的条件下回流,可制备出粒径在6~9.9 nm左右,比表面积达154 m2/g多孔的锐钛矿型纳米氧化钛。催化剂LiI的作用机制为:LiI中的阳离子Li+是强Lewis酸,可与Lewis碱乙醇配位,削弱了C-O和O-H,使乙醇分子易受亲核攻击或键裂;催化剂中的阴离子I-既是一种很好的亲核试剂,又是一种很好的离去基团,对形成Ti-O-Ti键合的脱卤代烷亲核取代反应起到了催化作用,这两点使得在溶胶中就形成了大量的Ti-O-Ti键合。同时在回流的条件下,Ti-O-Ti键合局部过饱和、重排析出,形成共面的钛氧八面体—锐钛矿型氧化钛。其中在溶胶中形成大量的Ti-O-Ti键合是常压低温制备纳米氧化钛的关键。制得的纳米氧化钛具有良好的光催化活性,加入甲基橙溶液后的光降解率就达38.8%;紫外光照2 h后的光降解率为76.8%。
[1] ZHANG L D, MOU J M. Nanometer Material and Nanostructure.[M] Bejing : Science Press, 2001: 59-90 (in Chinese).
[2] HE B P, WANG Z S. Environmental Science, 1994,15(3): 80-84 (in Chinese).
[3] YONEYAMA H. Crit. Rev. Solid State Mater. Sci.,1993, 18: 69-74.
[4] HU C, WANG Y Z. Environmental Science, 2000,21(3):71-75 (in Chinese).
[5] OFFMANN M R, MARTIN S T, CHOI W, et al. Chem. Mater., 1997, 6: 9-14.
[6] GARNWEITNER G, ANTONIETTI M, NIEDERBERGER M. Chem. Commun., 2005: 397-399.
[7] YU Kaifeng, ZHAO Jingzhe, GUO Yupeng, et al. Materials Letters, 2005, 59: 2515-2519.
[8] ZABAN A, ARUMA S T, TIROSH S, et al. J. Phys. Chem. B, 2000, 104: 4130.
[9] SADEGHZADEH-ATTAR A, MIRDAMADI S,HAJIESMAEILBAIGI F, et al. J. Mater. Sci. Technol., 2007, 23(5): 610-613.
[10] MATSUSA A, MATODA T, KOGURE T, et al. J. Sol-gel Sci. Technol., 2003, 27: 61.
[11] ARNAL P, CORRIU R J P, LECELEREQ D, et al. Chem. Mater., 1997, 9: 694.
[12] LAFOND V, MUTIN P H, VIOUX A. J. Mol. Catal. A: Chem., 2002, 81: 182.
[13] HE Heyong, FAN Kangnian. Appl. Catal. B:Environ., 2007, 76: 82-91.
[14] ZHU Jian, BIAN Zhenfen, REN Jie, et al. Catalysis Communications, 2007, 8: 971-976.
[15] LV D F, BIAN F R, XU K, et al. Journal of Inorganic Materials, 2007, 22(1): 59-64 (in Chinese).
[16] TRENTLER T J, DENLER T E, BERTONE J F, et al. J. Am. Chem. Soc., 1999, 121(7): 1613-1614.
[17] NIEDERBERGER M, GARNWEITNER G. Chem. Eur. J., 2006, 12(28): 7282-7302.
[18] HAN W P, et al. The Introduction to Catalytic Chemistry. Beijing: Science Press, 2003: 437~439 (in Chinese).
[19] LI X C. Jiangxi Normal University Journal, 1980, 1:53-73 (in Chinese).
[20] BRADLEY D C, MEHROTRA R C, GAUR O P. Metal Alkoxide. London: Academic Press Inc. Ltd.,1978: 15-20.
[21] COATES J. Encyclopedia of Analytical Chemistry. Hoboken, NJ: John Wiley & Sons, Inc., 2000:10815-10837.
[22] BRADLEY D C, MEHROTRA R C, GAUR O P. New York: Academic Press, 1978: 119-121.
[23] DOU Y W, XU M X, XU T X. Journal of the Chinese Ceramic Society, 2002, 30: 87~89 (in Chinese) ZHANG W W, CHEN Y Q. Journal of Ceramics,2004, 25(4): 235-238 (in Chinese).
[24] LYNCH C T, MAZDIYASNI K S, SMITH J S, et al. Analytical Chemistry, 1964, 36(12): 2332-2337.
[25] PONCELET O, GUILMENT J, TRUCHET S. Mat. Res. Symp. Proc., 1994, 346: 655-660.
[26] Ye W L. Taibei: National Cheng Kung University,2002 (in Chinese).
[27] DHAGE S R, CHOUBE V D, SAMUEL V, et al. Materials Letters, 2004, 58(1): 2310-2313.
[28] ZHANG L K, SUN J T, YUAN L J, et al. Inorganic Synthetic Chemistry, 2004: 236-239 (in Chinese).
The Effects of the Catalyst on the Low Temperature Synthesis of Titania via a Nonhydrolytic Sol-gel Route
LIAO Qili1, JIANG Weihui2, FENG Guo2, PENG Yongfeng3
(1. Foshan Huaxia Building Ceramic R & D Center Co., Ltd., Foshan 528061, Guangdong, China; 2. Jingdezhen Ceramic Institute, Jingdezhen 333001, Jiangxi, China; 3. Zschimmer-Schwarz Chemical (Foshan) Co., Ltd., Foshan 528000, Guangdong, China)
Nanosized anatase titania has been prepared by non-hydrolytic sol-gel method at 88 ℃ by using titanium tetrachloride as titanium source, ethanol as oxygen donor and solvent, LiI as catalyst. The effects of the catalyst on the low temperature synthesis of nanosized titania has been studied by XRD, TEM and FT-IR. The results showed that: the introduction of the catalyst promotes the formation of Ti-O-Ti bond in the sol which is favorable to supersaturated crystallization of Ti-O-Ti bond. It is also the key to low temperature synthesis of titania. Meanwhile the photo catalytic degradation of methyl orange shows the titania has excellent photo catalytic activity, and the photodegradation rate reaches 38.8% with the titania added to the methyl orange solution and 76.8% under 2h ultraviolet irradiation.
titanium dioxide; nonhydrolytic sol–gel method; ethanol; lithium iodide
TQ174.75
A
1000-2278(2014)01-0017-05
2013-10-11。
2013-10-20。
广东省部产学研结合项目(项目编号:2011A091000024)专项资金资助
廖奇丽(1981-),女,工程师。
江伟辉(1965-),男,博士,教授。
Received date:2013-10-11. Revised date:2013-10-20.
Correspondent author:JIANG Weihui(1965-),male,Ph.D., Professor.
E-mail:jwhjiang@163.com
