叶用芥菜小孢子离体培养条件
2014-04-26吴慧敏何勇邵泱峰朱祝军符庆功
吴慧敏,何勇,邵泱峰,朱祝军,符庆功
(1.浙江农林大学浙江省农产品品质改良技术研究重点实验室,浙江临安 311300;2.浙江省临安市农业技术推广中心,浙江临安 311300)
叶用芥菜小孢子离体培养条件
吴慧敏1,何勇1,邵泱峰2,朱祝军1,符庆功1
(1.浙江农林大学浙江省农产品品质改良技术研究重点实验室,浙江临安 311300;2.浙江省临安市农业技术推广中心,浙江临安 311300)
以5个叶用芥菜Brassica juncea var.foliosa品种为试材,研究了游离小孢子培养过程中基因型、低温预处理、高温热激、更新及加液和秋水仙碱等对小孢子胚状体发生的影响。结果表明:有4个品种获得胚状体,各品种间胚状体产量存在显著差异,‘特选九心芥’胚产量最高;4℃低温预处理24~48 h及33~34℃高温热激处理24~48 h对诱导胚状体发生和发育有促进作用;更新和添加培养基处理也可促进胚状体发生,以质量浓度为170.0 g·L-1的蔗糖起始培养48 h后添加等质量浓度90.0 g·L-1蔗糖培养基处理效果最佳;1~10 mg·L-1秋水仙碱24~48 h处理可提高小孢子培养反应,增加供试材料胚产量。图1表5参19
园艺学;叶用芥菜;小孢子培养;胚状体;热激;秋水仙碱
叶用芥菜Brassica juncea var.foliosa为十字花科Brassicaceae芸薹属Brassica1~2年生草本植物,其营养丰富,鲜食、加工均宜,深受广大人民群众喜爱,是中国栽培最为普遍的芥菜类蔬菜。目前,生产上叶用芥菜仍以常规品种为主[1],传统育种获得纯系及性状稳定后代需要多代自交和后代性状选择,所需年限较长[2]。利用游离小孢子培养技术获得纯合系,从而缩短杂交育种年限,提高选择效力,加快优良性状转移是当前叶用芥菜育种的重要技术方法和理想途径,目前已在甘蓝型油菜Brassica napus,白菜Brassica campestris ssp.chinensis,青花菜Brassica oleracea var.italica,甘蓝Brassica oleracea等芸薹属蔬菜作物育种中得到广泛应用[3-7]。与芸薹属其他蔬菜相比,芥菜种Brassica juncea蔬菜游离小孢子培养建立困难,相关研究报道不多。目前,在叶用芥菜小孢子离体培养技术体系方面,也仅在金丝芥Brassica juncea var.multisecta,雪里Brassica juncea var.multiceps,结球芥Brassica juncea var.capitata、独山大叶青Brassica juncea var.rugosa等部分品种上有少量研究报道[8-13]。小孢子诱导分化困难、成胚率低,仍然是当前叶用芥菜游离小孢子培养技术体系建立的主要问题。本试验以5个不同叶用芥菜品种为材料,研究了不同遗传背景、低温预处理、高温热击、培养基更新及加液、秋水仙碱处理对小孢子胚状体发生及发育的影响,以期为叶用芥菜小孢子培养技术的有效利用提供参考。
1 材料与方法
1.1 材料
以‘四季客家芥,‘上海金丝芥,‘温州芥菜,‘特选九心芥,‘花叶香芥菜,等5个叶用芥菜品种为试验材料。2010年和2011年秋季播种,塑料大棚内越冬后于第2年春季3-4月花期进行小孢子培养。
1.2 花蕾的选择和表面灭菌
临近开花时,选取长度10 cm左右的主花序或顶部一级分枝花序于4℃保湿放置1~3 d,醋酸洋红染色后镜检观测小孢子发育时期,选取单核晚期小孢子所占比例较大的花蕾(直径2~3mm),先用体积分数为75%的乙醇浸泡30 s,再用体积分数为0.1%的氯化汞(HgCl2)处理10 min,无菌水冲洗5次。
1.3 小孢子分离及培养
以质量分数为13%的蔗糖B5液体培养基(含B5大量元素、微量元素、铁盐和有机成分,pH 5.8,高温灭菌)为小孢子收集培养基;以不同蔗糖质量浓度NLN培养基为小孢子培养液(含NLN大量元素、微量元素、铁盐和有机成分,蔗糖质量浓度为90.0~170.0 g·L-1,pH 5.8,过滤灭菌)。表面灭菌后的花蕾放入无菌试管中·皿-1(加约3mL B5培养基),用无菌玻璃棒挤压花蕾散出小孢子,经38μm滤网过滤,收集滤液至10 mL离心管,600 r·min-1离心3 min,弃上清,加入B5培养基重新悬浮小孢子,离心重复3次。最后加入小孢子培养液,用血球计数器调整小孢子浓度为1×108个·L-1,分装至60 mm×15 mm培养皿,3 mL·皿-1,Parafilm膜封口,33℃高温热激处理24 h后,转入25℃静置暗培养,待肉眼可见白色胚状体后,转至50 r·min-1的摇床震荡培养。
接种30 d后统计胚状体数量及子叶胚比例(将胚状体分为子叶形胚和其他类型2种),用Duncan,s新复极差法进行显著差异性分析。
1.4 小孢子发育细胞学与形态观察
小孢子培养期间,用Nikon倒置显微镜(TS100-F)观察小孢子细胞发育及形态变化,并拍照记录。
1.5 胚状体分化及植株再生
将子叶胚在光下培养转绿后接种于B5+0.5mg·L-16-卞基氨基嘌呤(6-BA)+0.1mg·L-1萘乙酸(NAA)胚分化培养基上,萌发出芽后再转入B5+0.2 mg·L-1NAA生根培养基上,生根形成完整植株;分化及生根培养基蔗糖质量浓度均为30.0 g·L-1,琼脂7.0 g·L-1,pH 5.8,高温灭菌。
1.6 影响小孢子胚胎发生的单因素试验
1.6.1 低温预处理的影响供试材料花序保湿条件下,4℃低温预处理24,48,72 h后分别进行小孢子游离培养,以不进行低温预处理为对照。
1.6.2 高温热激处理的影响供试材料分离出的游离小孢子在33,34,35℃静置暗培养条件下分别进行24,48,72 h热激处理,然后转到25℃继续培养,以25℃恒温培养作对照。
1.6.3 更新及添加培养基的影响刚分离的小孢子在不同蔗糖质量浓度NLN培养基中33℃热激培养48 h后,经过更换或添加等量培养基等不同处理后转到25℃继续培养,以NLN-13培养基持续培养为对照。其中NLN-9,NLN-13,NLN-17培养基均以NLN培养基为基本培养基,蔗糖质量浓度分别为90.0g·L-1,130.0 g·L-1和170.0 g·L-1。
1.6.4 秋水仙碱的影响将质量浓度分别为1.0,10.0,50.0,100.0 mg·L-1的秋水仙碱添加至NLN-13小孢子培养基中,悬浮刚分离纯化的小孢子培养24~48 h后,转入不含秋水仙碱的NLN-13培养基中继续培养,以不含秋水仙碱培养基培养作对照。
以上各因素试验每个处理培养30个花蕾的小孢子,重复3次,30 d后观察胚状体发生情况,统计胚状体总数及子叶胚数量。
2 结果与分析
2.1 叶用芥菜小孢子胚胎发生及植株再生
小孢子培养过程中,细胞学观察发现,刚游离的小孢子(图1-Ⅰ)经高温热激处理后部分小孢子先是体积膨大(图1-Ⅱ),之后少数膨大小孢子发生1次细胞分裂(图1-Ⅲ),后经多次细胞分裂(图1-Ⅳ),继续发育形成球形胚,心型胚(图1-Ⅴ)和鱼雷型胚(图1-Ⅵ)等,将光照条件下培养转绿的子叶型胚(图1-Ⅶ,1-Ⅷ)转入固体培养基进行胚萌发、分化、生根后获得再生植株(图1-Ⅸ)。
2.2 基因型对小孢子胚状体诱导的影响
由表1可知:供试品种游离小孢子经33℃高温处理24 h,有‘上海金丝芥,‘特选九心芥,‘花叶香芥菜,3个品种产生胚状体。不同基因型材料间胚状体产量差异显著,同时还发现产胚数量多的材料,子叶胚所占比例也相应较高。‘特选九心芥,出胚总数最多,平均产胚2.20个·蕾-1,子叶胚比例也高达50.0%;‘花叶香芥菜,获得胚状体数量最少,平均产胚0.22个·蕾-1,子叶胚比例仅为34.7%;而‘四季客家芥,‘温州芥菜,未能诱导出胚,经33℃热激培养4 h后,显微镜下观察到上述两品种有少量小孢子膨大现象,但之后未见有进一步的细胞分裂。

图1 叶用芥菜小孢子离体培养过程中胚的发育及植株再生过程Figure 1 Developmentof embryos and plant regeneration duringmicrospores culture in Brassica juncea var.foliosa
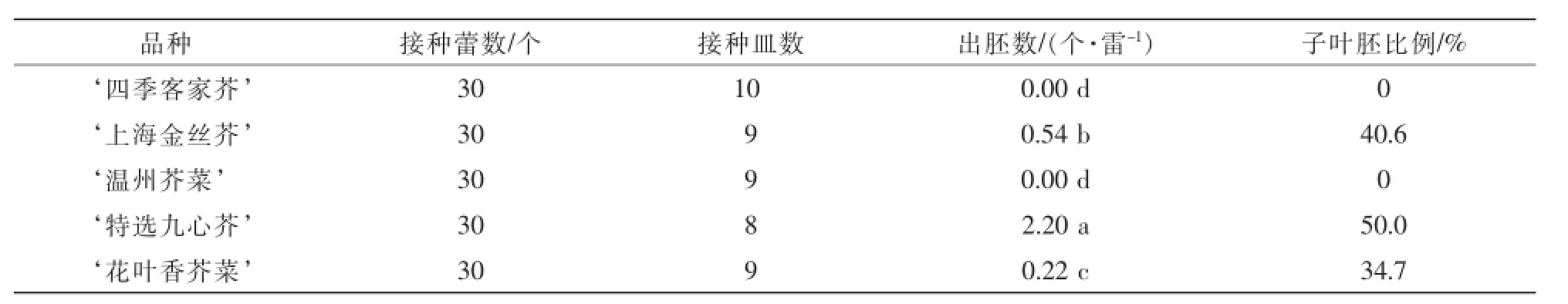
表1 不同基因型叶用芥菜小孢子胚胎发生的差异Table 1 Differences ofmicrospore embryogenesis in different genotypes of Brassica juncea var.foliosa
2.3 低温预处理对胚状体诱导的影响
从表2可以看出:低温处理24~48 h条件下供试材料产胚数量较高。‘上海金丝芥,最佳低温预处理时间为48 h,平均出胚0.88个·蕾-1,为对照的1.5倍;‘特选九心芥,经24~48 h低温预处理胚状体发生能力明显提高,但随着时间延长至72 h,出胚数由2.57个·蕾-1减少至1.59个·蕾-1,产胚能力明显下降;与对照相比,‘花叶香芥菜,低温预处理胚状体数量差异不明显。

表2 低温预处理对叶用芥菜小孢子胚胎发生的影响Table 2 Effect of low temperature pretreatment onmicrospore embryogenesisof Brassica juncea var.foliosa
2.4 高温热激处理对胚状体诱导的影响
由表3可知:不同热激处理温度和时间,供试材料小孢子产胚量差异显著。33~34℃高温热激处理能显著提高大部分材料胚状体发生频率,35℃处理的胚状体的发生数量则明显减少。此外,高温热激处理时间亦对小孢子产胚量有一定影响,33~34℃条件下处理24~48 h小孢子胚状体诱导率较高;‘特选九心芥,在33℃热激处理48 h条件下出胚量最高,平均产胚2.71个·蕾-1,随着热激处理时间延长至72 h,产胚量明显下降;‘上海金丝芥,则以34℃处理24 h最佳,‘花叶香芥菜,以34℃处理48 h效果最佳。对照处理5个基因型材料则均未诱导出胚状体。
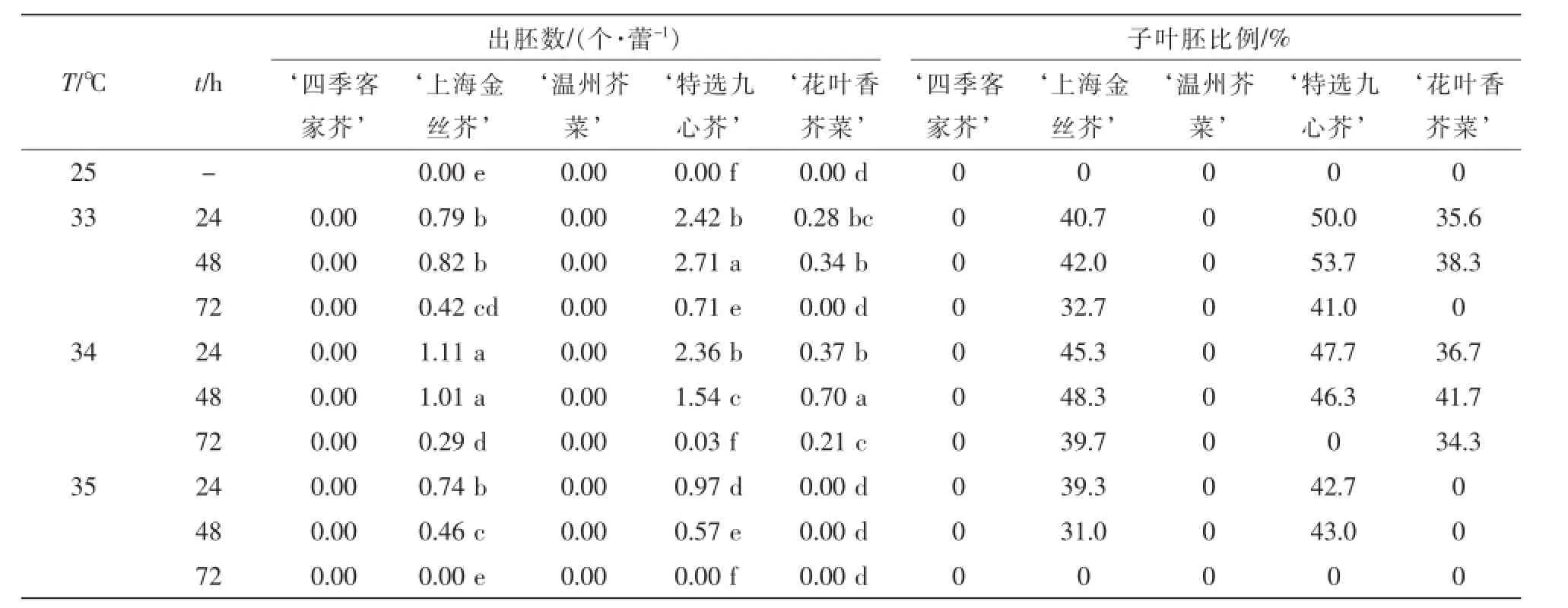
表3 高温处理对叶用芥菜小孢子胚胎发生的影响Table 3 Effect of high temperature onmicrospore embryogenesis of Brassica juncea var.foliosa
2.5 更新及添加培养基对胚状体诱导的影响
从表4可以看出:在6个处理中,质量浓度为17%的蔗糖起始培养后添加等量的90.0 g·L-1蔗糖培养基培养效果最好。该处理能显著提高‘上海金丝芥,‘特选九心芥,‘花叶香芥菜,胚状体发生频率;170.0 g·L-1蔗糖培养基培养48 h,重新离心更换130.0 g·L-1蔗糖培养基亦能显著提高‘上海金丝芥,‘花叶香芥菜,产胚能力;而170.0 g·L-1蔗糖持续培养则严重抑制小孢子胚状体发育,所有供试材料均无法获得胚状体。130.0 g·L-1蔗糖起始培养后更新或加液等处理对小孢子胚状体诱导的影响则因材料不同而效果不尽相同。

表4 更新及加液对叶用芥菜小孢子胚胎发生的影响Table 4 Effect ofadding and replacingmedium onmicrospore embryogenesis of Brassica juncea var.foliosa
2.6 秋水仙碱对胚状体诱导的影响
由表5结果可以看出:适宜的秋水仙碱质量浓度及其时间处理能够有效促进小孢子胚胎发生。试验中,1.0~10.0 mg·L-1低质量浓度秋水仙碱处理能显著提高大部分材料产胚量,随着质量浓度提高,100.0 mg·L-1秋水仙碱处理则明显抑制胚状体的产生。1.0 mg·L-1秋水仙碱处理24~48 h,能显著提高‘特选九心芥,出胚量,最高达3.16个·蕾-1;10.0mg·L-1秋水仙碱处理24~48 h,则显著提高‘花叶香芥菜,胚产量;10.0 mg·L-1秋水仙碱处理48 h比24 h不仅显著增加胚产量,子叶胚比例亦提高5.7%。‘上海金丝芥,最佳处理条件为50.0mg·L-1处理24 h,出胚量最高达1.68个·蕾-1,处理时间延长为48 h,出胚量则迅速降低仅为0.99个·蕾-1。可见较低质量浓度秋水仙碱及适宜时间组合有助于促进胚状体产生,高质量浓度秋水仙碱及长时间处理则会造成毒害。
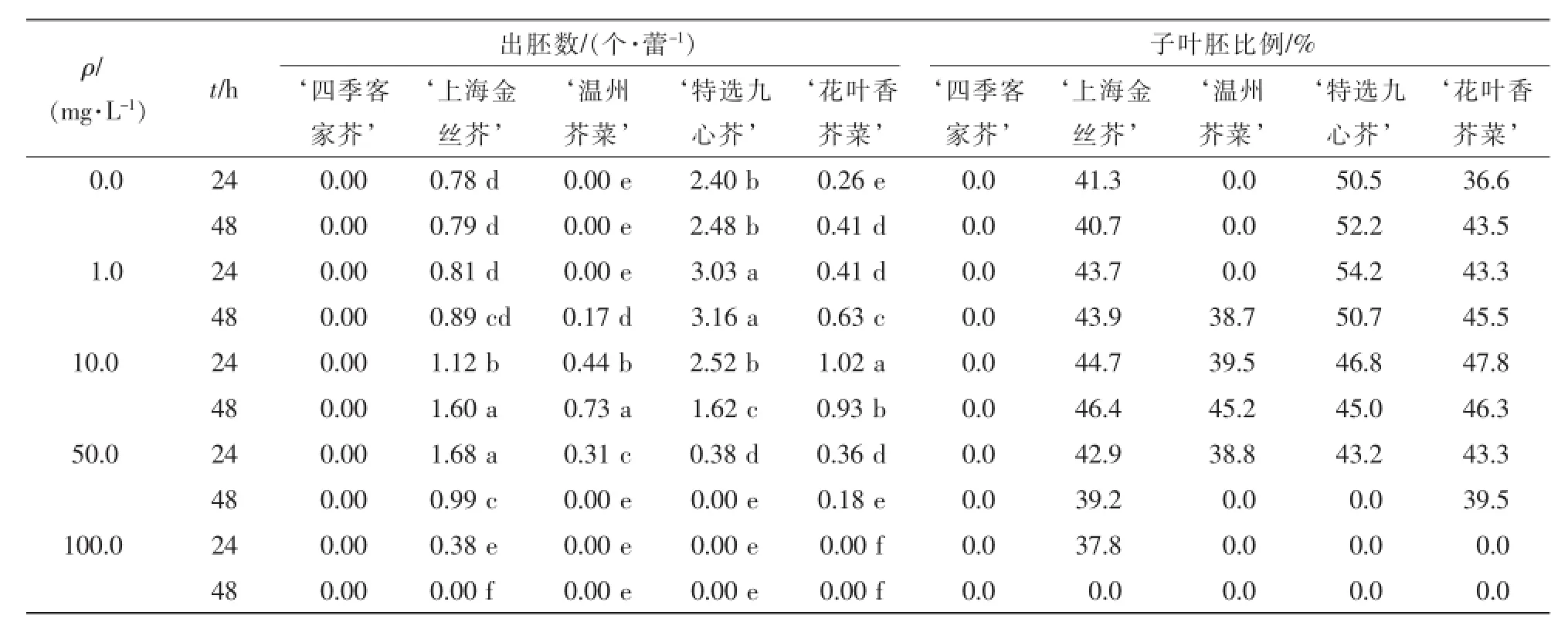
表5 秋水仙碱处理对叶用芥菜小孢子胚胎发生的影响Table 5 Effect of colchicine treatmenton microspore embryogenesis of Brassica juncea var.foliosa
3 讨论
材料的遗传背景对小孢子胚状体发生有较大影响,相同条件下,不同基因型材料小孢子培养效果存在显著差异。刘冬等[8]利用7种基因型芥菜进行小孢子培养试验,6种基因型获得了小孢子胚,3种基因型得到了再生植株;本试验以5个叶用芥菜品种为材料,最终有4个基因型材料成功诱导胚状体,胚产量最高为3.16个·蕾-1,而有的材料未能出胚或产量较低,供试基因型之间小孢子胚状体发生能力差异很大,这与前人结论一致。
适宜的温度和时间处理可以改善小孢子代谢,利于小孢子适应离体后培养环境,促进其正常生长。王亦菲等[14]研究表明:4℃低温预处理油菜1~2 d有利于提高胚胎发生。但耿建峰等[7]报道接种前低温预处理花蕾对白菜小孢子胚诱导率影响差异不大,超过5 d反而下降。本试验中不同基因型叶用芥菜对低温预处理反应不同,有些品种低温预处理24~48 h能显著提高胚状体的产量,有些则与对照无明显差异,因而,实践应用中应根据具体材料做相应探索与研究。
高温热激对于启动小孢子分裂和改变小孢子定向发育具有重要作用,广泛应用于芸薹属作物花药培养和游离小孢子培养。刘冬等[8]报道对芥菜小孢子采用25,30,33,35℃热激处理3 d,只有33℃处理出胚。本试验表明33~34℃高温热激处理叶用芥菜小孢子24~48 h对胚状体诱导效果较好,72 h培养明显降低胚状体的发生频率。
蔗糖是小孢子培养过程中主要碳源和渗透压调节剂,糖质量浓度对维持小孢子活力及胚状体的发生有重要影响。采用更新或加液培养能显著提高胚产量,在芸薹属其他作物游离小孢子培养中已有报道[15-17]。本试验采用质量浓度为170.0 g·L-1的蔗糖培养基培养48 h后添加等量的90.0 g·L-1蔗糖培养基,使终质量浓度为130.0 g·L-1,显著提高了叶用芥菜小孢子产胚数量。试验中,添加培养基处理胚状体诱导率显著好于培养基更新处理,可能与低质量浓度蔗糖培养基等量添加既可以补充营养物质、降低培养液中不利代谢产物浓度,又可以避免培养基更新时重新离心对小孢子造成的伤害有关。
秋水仙碱直接处理游离小孢子提高出胚率及成苗率,在油菜等小孢子培养中有较多应用[17-19],但秋水仙碱对叶用芥菜的影响,目前,还未见报道。本试验结果表明:较低质量浓度秋水仙碱处理可以显著提高4个品种胚状体产量;对于难出胚品种‘温州芥菜,,适宜质量浓度的秋水仙碱处理后明显促进胚状体发生。
本试验在比较遗传背景、低温预处理、高温热击等因素对叶用芥菜小孢子胚状体发生影响的基础上,进一步研究了培养液更新及添加、秋水仙碱处理条件下叶用芥菜小孢子胚状体出胚及发育的影响,初步建立了部分叶用芥菜品种的游离小孢子培养体系。但由于影响小孢子胚状体诱导分化的因素极为复杂,目前,叶用芥菜小孢子培养技术体系相关探索与研究也比较少,相比芸薹属其他种蔬菜,现有研究小孢子胚状体诱导率仍然偏低。因此,育种实践中,结合不同育种材料,进一步深入研究、完善叶用芥菜小孢子培养技术,建立稳定、高效的小孢子再生植株获得体系,才能有效加强小孢子培养技术与传统育种技术的结合,提高叶用芥菜的育种效率。
[1]邹瑞昌,万正杰,徐跃进,等.新型叶用芥菜细胞质雄性不育系0912A的花药发育特征[J].华中农业大学学报,2012,31(1):44-49.
ZOU Ruichang,WAN Zhengjie,XU Yuejin,et al.Anther development of 0912A as a novel cytoplasmic male sterile line of leafmustard[J].JHuazhong Agric Univ,2012,31(1):44-49.
[2]杨培新,郑钢勇,谢桂勉,等.小孢子培养技术的芥菜育种应用研究进展[J].海南师范大学学报:自然科学版,2011,24(1):77-80.
YANG Peixin,ZHENG Gangyong,XIE Guimian,et al.Research progress ofmicrospore culture in mustard(Brassica juncea)breeding[J].JHainan Norm Univ Nat Sci,2011,24(1):77-80.
[3]ROBERT L.Induction of haploid plants from isolated pollen of Brassica napus[J].ZPflanzenphysiol,1982,105:427 -434.
[4]SATO T,NISHIO T,HIRAIM.Plant regeneration from isolated microspore cultures of Chinese cabbage(Brassicacampestris spp.pekinenisis)[J].Plant Cell Rep,1989,8:486-488.
[5]张德双,曹鸣庆,秦智伟.绿菜花双核期小孢子比例对游离小孢子培养的影响[J].园艺学报,1998,25(2):201-202.
ZHANG Deshuang,CAO Mingqing,QIN Zhiwei.Effect of binucleate pollen ratio on embryogenesis in isolated microspore culture of broccoli[J].Acta Hortic Sin,1998,25(2):201-202.
[6]方淑桂,陈文辉,曾小玲,等.结球甘蓝游离小孢子培养及植株再生[J].园艺学报,2006,31(1):158-160.
FANG Shugui,CHENWenhui,ZENG Xiaoling,et al.Isolated-microspore culture and plantlet regeneration in cabbage(Brassica oleraceaL.var.capitataL.)[J].Acta Hortic Sin,2006,31(1):158-160.
[7]耿建峰,候喜林,张晓伟,等.影响白菜游离小孢子培养关键因素分析[J].园艺学报,2007,34(1):111-116.
GENG Jianfeng,HOU Xilin,ZHANG Xiaowei,et al.Isolated microspore culture inBrassica campestrisssp.chinensis[J].Acta Hortic Sin,2007,34(1):111-116.
[8]刘冬,郭平仲,刘凡,等.芥菜(Brassica juncea L.)小孢子胚发生和植株再生[J].首都师范大学学报:自然科学版,1997,18(1):76-80.
LIU Dong,GUO Pingzhong,LIU Fan,et al.Embryogenesis and plant regeneration via isolated microspore culture inBrassica junceaL.[J].JCapkal Norm Univ NatSci Ed,1997,18(1):76-80.
[9]陈玉萍,田志宏,陈爱武,等.包心芥菜游离小孢子培养的初步研究[J].华中农业大学学报,1998,17(1):93-95. CHEN Yuping,TIAN Zhihong,CHEN Aiwu,et al.Studies onmicrospore culture of Brassica juncer var.czerniak[J].J Huazhong Agric Univ,1998,17(1):93-95.
[10]虞慧芳,钟新民,顾宏辉,等.航天搭载雪里蕻小孢子培养获得再生植株[J].浙江农业学报,2007,19(5):356-359.
YU Huifang,ZHONG Xinmin,GU Honghui,et al.Obtainingmicrospore-cultured plants in potherb mustard,Brassicajuncea var.multiceps,by space-breeding satellite[J].Acta Agric Zhejiang,2007,19(5):356-359.
[11]ALIM M,KHALEQUE MIAN M A,CUSTERS JBM,et al.Microspore culture and the performance ofmicrospore derived doubled haploid inBrassica juncea(L.)[J].Bangladesh JAgric Res,2008,33(3):571-578.
[12]吴康云,陶莲,李正丽,等.叶用芥菜游离小孢子的培养及其植株再生[J].贵州农业科学,2011,39(8):9-10.
WU Kangyun,TAO Lian,LI Zhengli,et al.Microspore culture and plantlet regeneration in leaf mustard(Brassica juncea)[J].Guizhou Agric Sci,2011,39(8):9-10.
[13]王长龙,杨培新,郑奕雄.结球芥菜游离小孢子培养的胚状体发生[J].江西农业学报,2011,23(11):31-33. WANG Changlong,YANG Peixin,ZHENG Yixiong.Embryogenesis in culture of isolated microspores ofBrassica juncea var.capitata[J].Acta Agric Jiangxi,2011,23(11):31-33.
[14]王亦菲,陆瑞菊,孙月芳,等.大田油菜游离小孢子培养高频胚状体诱导及植株再生[J].中国农学通报,2002,18(1):20-23.
WANG Yifei,LU Ruiju,SUN Yuefang,et al.The high frequency embryos induction and plant regeneration derived from microspores for rapes grown in field[J].Chin Agric Sci Bull,2002,18(1):20-23.
[15]陈军,陈正华,刘澄清,等.甘蓝型油菜游离小孢子培养的胚胎发生[J].作物研究,1995,9(增刊):33-38.
CHEN Jun,CHEN Zhenghua,LIU Chengqing,et al.Embryogenesis of isolated microspore culture inBrassica napus L.[J].Crop Res,1995,9(supp):33-38.
[16]方淑桂,曾小玲,朱朝辉,等.结球甘蓝游离小孢子胚胎发生[J].武汉植物学研究,2005,23(6):530-534.
FANG Shugui,ZENG Xiaoling,ZHU Chaohui,et al.Embryogenesis of isolated-microspore in cabbage(Brassica oleracea var.capitata).[J]JWuhan Bot Res,2005,23(6):530-534.
[17]顾宏辉,张冬青,周伟军.换培养液和秋水仙碱处理对白菜型油菜小孢子胚胎发生的影响[J].作物学报,2004,30(1):78-81.
GU Honghui,ZHANG Dongqing,ZHOUWeijun.Effects ofmedium renovation and colchicine treatment on embryogenesis of isolatedmicrospores inBrassica rapassp.chinensis[J].Acta Agron Sin,2004,30(1):78-81.
[18]陆瑞菊,王亦菲,孙月芳,等.提高青花菜游离小孢子培养反应的研究[J].上海农业学报,2006,22(2):1-4.
LU Ruiju,WANG Yifei,SUN Yuefang,et al.Study on improving responses of isolated microspores culture in broccoli(Brassica oleracea var.italica)[J].Acta Agric Shanghai,2006,22(2):1-4.
[19]杨安平,张恩慧,郑爱泉,等.秋水仙碱对甘蓝游离小孢子胚胎发生及发育的影响[J].西北农林科技大学学报:自然科学版,2010,38(8):131-137.
YANG Anping,ZHANG Enhui,ZHENG Aiquan,et al.Effects of colchicine on embryogenesis and development of isolatedmicrospore inBrassciaoleracea var.capitata[J]JNorthwestA&FUniv NatSciEd,2010,38(8):131-137.
In vitromicrospore culture of leafmustard
WU Huimin1,HE Yong1,SHAO Yangfeng2,ZHU Zhujun1,FU Qinggong1
(1.The Key of Laboratory for Quality Improvement of Agricultural Products of Zhejiang Province,Zhejiang A&F University,Lin,an 311300,Zhejiang,China;2.Agricultural Technology Promotion Center of Lin,an City,Lin,an 311300,Zhejiang,China)
In order to improve the isolated microspore culture system inBrassica juncea var.foliosa,five differentgenotypes ofBrassica juncea var.foliosawere used to investigate the contribution of genotype,cool-pretreatment,heat shock,medium replacement and addition,as well as concentration of colchicine on microspore embryogenesis in vitro.Results showed that embryoids were obtained from four genotypes,and significant differences(P<0.05,Duncan,s MRT)were observed for embryo yield with the highest yield being‘Texuan-jiuxin,.For all cultivars,24-48 h of cool-pretreatment at 4℃and heat shock at 33-34℃improved embryo yields.Also,medium addition and replacement enhanced microspore embryogenesis with the best treatment using a constant volume for a 90.0 g·L-1sucrose medium supplemented to a 170.0 g·L-1sucrose concentration medium after 48 h.In addition,treating the freshly isolated microspore with 1-10 mg·L-1colchicine for 24-48 h greatly improved(P<0.05,Duncan,s MRT)embryo yields of the four cultivars.The present results could be used to obtain haploid efficiently for the plant breeding and basic research inBrassica juncea var.foliosa.[Ch,1 fig.5 tab.19 ref.]
horticulture;leafmustard;microspore culture;embryoid;heat shock;colchicine
S637.2
A
2095-0756(2014)02-0315-07
2013-03-21;
2013-06-18
浙江省教育厅资助项目(2273000001)
吴慧敏,实验师,从事园艺作物遗传育种研究。E-mail:hminw@163.com。通信作者:符庆功,讲师,从事蔬菜种质资源与遗传育种方向研究。E-mail:fuqinggong@163.com
