DNA疫苗及其在卵黄抗体制备中的应用
2014-04-25李再新李丙超胡卫东唐文才
李再新,李丙超,胡卫东,唐文才,文 倩,张 智
(四川理工学院a.化学与制药工程学院;b.生物工程学院,四川 自贡 643000)
DNA疫苗和卵黄抗体作为近年来免疫学新兴的产物受到了广泛关注,两者的优越性随着研究的深入也愈加突显。用DNA疫苗制备卵黄抗体是将两者优越性联合,这种卵黄抗体受到了越来越多的研究人员的青睐,通过这种方法获得的卵黄抗体比常规免疫方法获得的卵黄抗体在疾病的预防和治疗将上更具有优势。
1 DNA疫苗
DNA疫苗是将编码某种抗原蛋白的外源基因直接导入动物体细胞内,利用宿主细胞的表达系统合成外源蛋白,进而诱导宿主免疫系统产生针对该抗原蛋白的免疫应答,以达到预防和治疗疾病的目的。与常规疫苗相比,其优点主要为:DNA疫苗易于设计、构建、改造且成本低,适于规模化生产。DNA疫苗其物理化学性质稳定,便于保存和运输。DNA疫苗通过宿主细胞表达目的抗原蛋白,较之在原核表达系统中表达的蛋白更接近于其抗原蛋白天然结构[1-2],诱导机体产生更强的免疫应答。DNA疫苗在宿主体内表达持久,因此单一剂量的DNA疫苗可激发长时间的免疫,产生特异的交叉保护。此外,通过DNA重组技术可对DNA疫苗制备时载体所携带的基因进行针对性改造和变换,增强了DNA疫苗靶向性和特异性[3-5]。DNA疫苗缺点是仅适用于蛋白质抗原(不适用于非蛋白质抗原,如细菌多糖);有对注射部位细胞生长产生影响的风险;诱导产生的抗体有可能对机体自身的DNA构成威胁;有可能增加机体对抗原的耐受性。
当带有高效表达调控序列的保护性抗原基因导入动物体细胞后,被细胞摄取而进入细胞核,在载体上的启动子调控下,转录出抗原基因mRNA,后者进入胞浆而转译出相应的抗原蛋白。表达的抗原蛋白可以通过2种方式呈递给宿主免疫系统(图1):(1)抗原在细胞内经加工后与MHC I分子结合呈递到细胞表面,最终激活细胞毒CD8+T淋巴细胞(CTL);(2)从细胞中释放出来与B细胞受体结合,释放出的蛋白质被抗原呈递细胞所吸收、降解,然后与MHC II分子结合后最终可激活体液免疫应答。
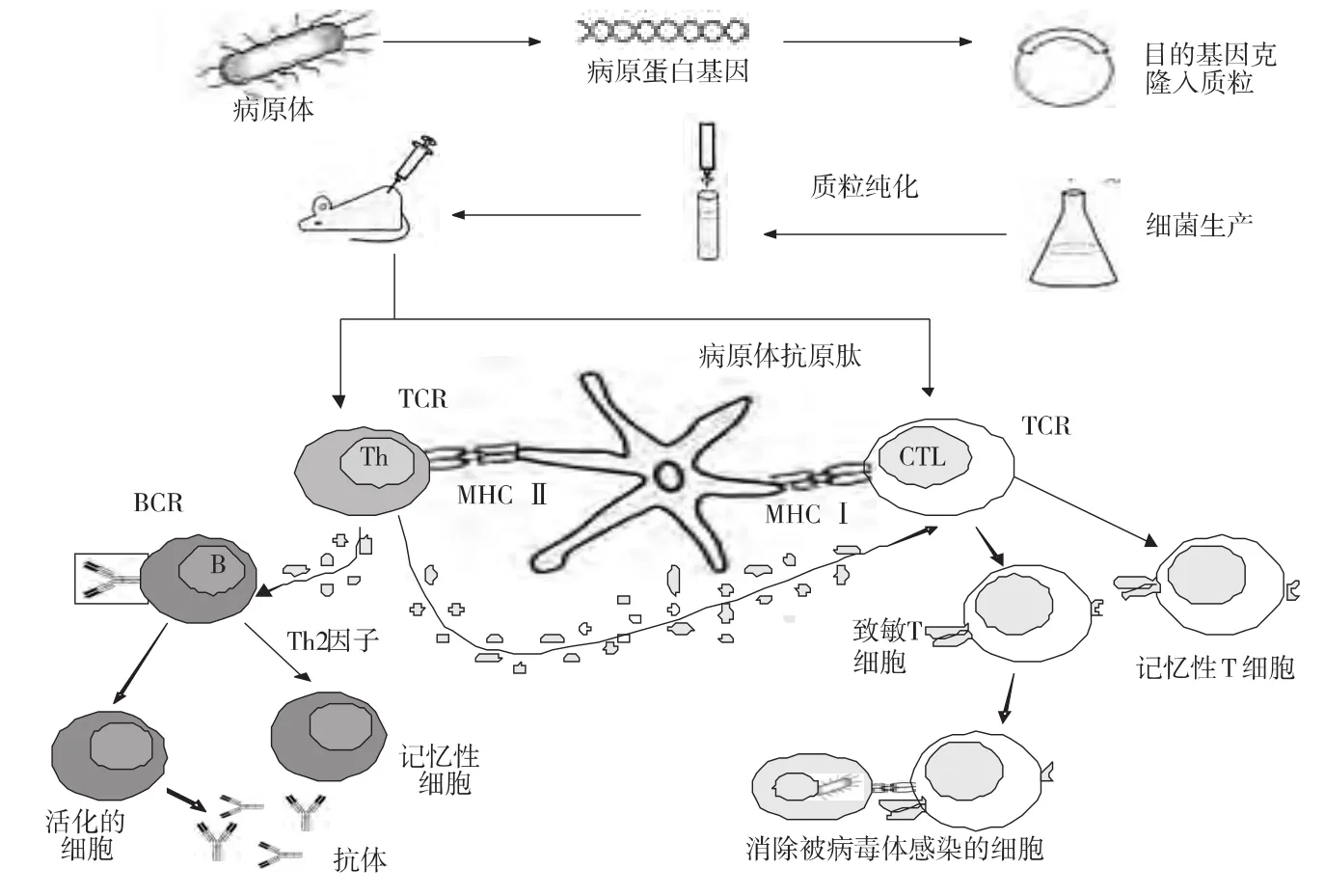
图1 DNA疫苗免疫机理示意图
另外,DNA疫苗免疫部位、宿主表达抗原蛋白的量和免疫调节剂类型等因素,均对DNA疫苗的免疫效果产生相应的影响,其中以免疫途径和免疫佐剂的影响最为显著。Fynan研究发现多种途径合并注射免疫效果最好,其它依次为肌肉、静脉、鼻腔、皮内和皮下接种[6],目前最为有效的免疫途径是使用基因枪将DNA包被的金属颗粒注入表皮细胞。如果用注射器直接注射要求DNA为10~200 ug(鸡、鸭等),基因枪注射要求的DNA量可少至纳克级。在佐剂方面,目前使用的佐剂有多种,其中包括无机佐剂(如氢氧化铝)、有机佐剂(如脂多糖、分支杆菌等)、合成佐剂(如双链多聚肌苷酸、胞苷酸根等)以及近年来发现的细胞因子等[7-11]。
2 卵黄抗体
卵黄抗体的性质与哺乳动物的IgG相似。由图2可知两者均由两条轻链(2L)和两条重链(2H)组成,其中C部为恒定区,V部为可变区。与哺乳动物的IgG比较,卵黄抗体无绞链,而C区较大,因此不能与哺乳动物的补体及类风湿因子结合,所以更安全。正常鸡卵黄抗体的分子量约为180 KDa,其等电点约为5.2。卵黄抗体与一般哺乳动物IgG相比,卵黄抗体具有较强的耐热、耐酸、抗离子强度和一定的抗酶降解能力。
在低于75℃条件下,卵黄抗体具有良好的热稳定性。卵黄抗体粉末制剂在4℃贮存5年或在室温贮存6个月其活性仍无明显变化或下降,65℃时可保持24 h以上,70℃时加热90 min后其活性才明显下降。60℃,30 min条件下巴氏消毒不影响卵黄抗体;高于80℃,大部分卵黄抗体失去活性[12]。卵黄抗体在 pH4.0~11.0时比较稳定,pH3.0~3.5时活性迅速下降,pH12时活性亦有所下降[13],而本实验室制备的轮状病毒卵黄抗体在pH3.0时仍保持较高的活性。卵黄抗体对胃蛋白酶有较高的抵抗力,但对胰蛋白酶敏感。将胃蛋白酶和卵黄抗体在pH2.0温育1 h后,所有活性丧失,但在 pH4.0时1 h后可保持91%的活性,甚至温育10 h后仍有63%活性。卵黄抗体分别与胰蛋白酶和胰凝乳酶温育8 h,活性分别保持39%和41%[12]。

图2 IgG和IgY结构示意图
众所周知,当抗原来源与免疫系统的亲缘性越远产生的免疫反应就越强烈,因此针对哺乳动物性抗原鸡产生的抗体比来自哺乳动物的抗体滴度更好而且成本更低[14-16]。此外,当用哺乳动物蛋白做为抗原时,鸡产生的抗体比相应的哺乳动物产生的抗体能够识别更多的抗原表位[16-19]。鸡的卵黄抗体和哺乳动物的免疫球蛋白不会发生免疫学的组织交叉反应[17]。进化的远缘性决定了在某些类型疾病的预防和治疗中卵黄抗体比IgG更具优势。用同样的抗原免疫鸡和羊,鸡的卵黄抗体在第一次免疫后就表现出很高的免疫亲和性(109 L/mol),而为了达到相似的亲和活性羊必须接受4次同等剂量的免疫[20]。
3 DNA疫苗和卵黄抗体的应用现状
迄今,鲜有DNA疫苗试验能够诱发足够强大的免疫反应来治疗和预防疾病。然而,在2006年6月已经证实禽流感DNA疫苗具有积极结果和一种西尼罗河病毒DNA疫苗能够使马对西尼罗河病毒产生免疫[21],并且2007年8月在DNA疫苗治疗多发性硬化症的报道中证实有显著疗效[22]。目前,将多种病原体的基因构建到同一载体上可制成针对多种病原体的DNA疫苗,这种针对多种病原体的新DNA疫苗在小鼠模型上已经有广泛的研究[21],而且已经被证实通过肌肉免疫或皮下免疫能够诱导产生很强的免疫反应[22]。这项技术目前已经应用于多种疾病,包括流行性感冒、乙型肝炎病毒、疟疾、结核病、SIV(猪流感病毒)、HIV(艾滋病病毒)和多种癌症[21]。
卵黄抗体具有抗胃屏障作用[13],因此口服纯化的卵黄抗体可用于胃肠细菌和病毒感染的被动免疫治疗。现已证实口服从免疫鸡中获得的卵黄抗体可成功治疗多种胃肠道病原体感染。例如,人和牛的轮状病毒、牛冠状病毒、鲁氏耶尔森菌、肠毒素性大肠杆菌、迟钝爱德华菌、葡萄球菌、假单胞菌和幽门螺旋杆菌脲酶 B等[23-24]。
最近有研究表明,使用能够表达幽门螺旋杆菌脲酶B的DNA疫苗免疫产蛋鸭,获得的卵黄抗体,不但具有很高的滴度而且能够特异性识别幽门螺旋杆菌[19]。本实验室通过初步研究也发现使用轮状病毒结构蛋白VP7的DNA疫苗免疫产蛋鸡,获得的卵黄抗体能特异性识别轮状病毒粒子。
4 DNA疫苗制备卵黄抗体的优势
目前已经证实使用鸭乙型肝炎病毒(和人乙型肝炎病毒相似)的DNA疫苗免疫产蛋鸭可以从蛋黄中分离纯化得到相应的抗体[25]。通过肌肉注射将带有能编码目的蛋白序列的质粒注射到机体内,序列在机体细胞内表达成蛋白诱发免疫反应,这样被免疫的鸟类就能作为提供抗原的“工厂”,而不需要再纯化抗原蛋白,因为每个蛋的抗体含量要比从动物血清中平均抗体含量要高很多,因此这种非侵染性的方法可以快速获得大量特异性强、生物活性高的卵黄抗体[25]。这种免疫方法将开辟一个全新的领域。DNA疫苗制备卵黄抗体的优势主要表现在以下5方面:
(1)不再需要纯化抗原蛋白
DNA疫苗制备卵黄抗体是通过基因在动物宿主细胞内直接表达抗原,并诱导机体产生抗体的方法,这种方法避免了传统免疫方法中昂贵繁琐的抗原蛋白纯化的准备工作,以及由于纯化不完全而造成污染的潜在可能。
(2)抗体的质量优势
因为鸟类和哺乳动物有较远的亲缘关系所以对于哺乳动物抗原鸟类表现出更强的免疫应答。此外,鸟类的卵黄抗体有更显著的亲和活性[23,26]。另外现已证实通过核酸免疫得到的卵黄抗体比通过蛋白免疫得到的抗体的抗原表位更接近于病毒感染机体产生的抗体[27]。经核酸免疫产生的抗原在合成和翻译后修饰更接近于它们的天然结果[1-2],因此产生的抗体结果也更接近于天然抗原感染机体产生的抗体。
(3)产量高及生产的可伸缩性
卵黄抗体的生产方法是从蛋黄中大量收集抗体,鸡蛋可以看做一个抗体生产的小型“工厂”,因为从每只蛋中可以纯化得到大约60~100 mg的抗体,生产量可以根据需要进行调节。
(4)非侵染性的抗体生产法
卵黄抗体是通过从接受过免疫的产蛋鸡的鸡蛋中获得,而且每只蛋中得到的抗体要比从兔子血液中得到抗体的平均量高[24],每天收集鸡蛋提取卵黄抗体可以减轻目前用于抗体生产动物(老鼠、兔子)的重复性出血的痛苦。
(5)卵黄抗体作为免疫诊断试剂的优势
因为卵黄抗体不会与哺乳动物的免疫球蛋白、补体及类风湿因子发生血清型交叉性反应,因此卵黄抗体作为免疫荧光检测、免疫组织化学、酶联免疫检测(ELISA)、Western blotting和免疫电泳的免疫诊断工具有特殊的价值[28-29]。
5 展望
综上所述,与常规疫苗比较,DNA疫苗是一种更加安全、快速、有效且成本低的免疫疫苗,卵黄抗体作为一种新型抗体更是具有产量高、效价好、易获取并且适用性广的特点。因此,用DNA疫苗制备特异性卵黄抗体是将两者优点综合,由于在真核细胞内DNA疫苗表达的抗原蛋白更加接近其天然结构,因此获得的卵黄抗体不仅具有诸多优点而且能够更加易于识别和结合病毒粒子从而达到更加理想的治疗和预防的效果。这种新型的抗体生产方法将会为免疫学的研究开辟更加广阔的空间。本实验室欲使用DNA疫苗制备轮状病毒的卵黄抗体,意在生产一种低成本、高效价、安全稳定且适用于婴幼儿治疗及预防由轮状病毒引起的感染性腹泻的卵黄抗体。
[1] Farahnaz M S.Comparison of immune responses against FMD by a DNA vaccine encoding the FMDV/O/IRN/2007 VP1 gene and the conventional inactivated vaccine in an animal model[J].Virologica Sinica,2012,27(5):286-291.
[2] Michel M L.Towards immunotherapy for chronichepatitis B vieus infections[J].Vaccine,2002,20(Suppl 4):83-88.
[3]杨敬,李永清.DNA疫苗在兽医学中的应用预防兽医学进展[J].预防兽医学进展,2001,3(3):12-15.
[4]勒家声.核酸——未来的疫苗[J].中国兽医科技,1996,26(11):40-42.
[5]周方红.DNA疫苗研究进展[J].预防兽医学进展,1999,1(3):17-20.
[6] Fynan E F,Webster R G,Fuller D H.DNA Vaccines:Protective immunizations by Parenteral,Mucasland Gene-Gun Inoculations[J].PNAS,1993,90(24):11478-11482.
[7] Fangliu Yu.Nanoparticle-based adjuvant for enhanced protective efficacy of DNA vaccine Ag85AESAT-6-IL-21 against Mycobacterium tuberculosis infection[J].Nanotechnology Biology and Medicine,2012,8(8):1337-1344.
[8] Shi Changhong.Therapeutic efficacy of a tuberculosis DNA vaccine encoding heat shock protein 65 of Mycobacterium tuberculosis and the human interleukin 2 fusion gene[J].Tuberculosis,2008,89(1):54-61.
[9] Zhou Huaiyu.Protective immune response against Toxoplasma gondii elicited by a recombinant DNA vaccine with a novel genetic adjuvant[J].Vaccine,2012,30(10):1800-1806.
[10] Kevin R P.Immunogenicity and protective efficacy of a vaxfectin-adjuvanted tetravalent dengue DNA vaccine[J].Vaccine,2011,30(2):336-341.
[11] Sumit C.Enhanced immune response of DNA vaccine(VP1-pCDNA)adsorbed on cationic PLG for foot and mouth disease in guinea pigs[J].Virus Genes,2008,37(1):81-87.
[12] Jaradat Z W,Marquardt R R.Studies on the chicken IgY in different sugars,complex carbohydrates and materials[J].Food Agric Immunol,2000,12(4):263-272.
[13] Lee K A.Acid stability of anti Helicobacter pylori IgY in aqueous polyolsolution[J].JBMB,2002,35(9):488-493.
[14]Olovsson M,Larsson A.Biotin labeling of chicken antibodies and their subsequent use in ELISA and immunohistochemistry[J].Comp Immunol Microbiol Infect,1993,16:145-152.
[15] Shimitzu M,Nagashima H,Hashimoto K,et al.Egg yolk antibody(IgY)stability in aqueous solution with high sugar concentrations[J].Food Sci,1994,59:763-772.
[16] Svendsen B,Hau J.Chicken eggs in polyclonal antibody production[J].Scand Sci,1996,23:85-91.
[17] Hadge D,Anbrosuius H.Evolution of low molecular weight immunoglobulins-IV.IgY-like immunoglobulins of birds,reptiles and amphibians,precursors of mammalian IgA[J].Mol Immunol,1984,21:699-707.
[18] Sock H T.A novel cost-effective and efficient chicken egg IgY purification procedure[J].Journal of Immunological Methods,2012,380(1-2):73-76.
[19] Song C S,Yu J H.Antibodies to the a-subunit of in-sulin receptor from eggs of immunized hens[J].Immunol,1985,135:3354-3359.
[20] Wooley J A.Landon J Comparison of antibody production to human interleukine-6(I-L6)by sheep and chickens[J].Immunol Methods,1995,178:253-265.
[21] Davis B S.West Nile Virus Recombinant DNA Vaccine Protects Mouse and Horse from Virus Challenge and Expresses in Vitro a Noninfectious Recombinant Antigen That Can Be Used in Enzyme-Linked Immunosorbent Assays[J].Journal of Virology,2006,75:4040-4047.
[22] Stuve O.DNA Plasmid Vaccination for Multiple Sclerosis[J].Archives of Neurology,2007,64(10):1385-1386.
[23] Ying C D.A dual chicken IgY against rotavirus and norovirus[J].Antiviral Research,2012,97(3):293-300.
[24] Mine Y,Kovacs N J.Chicken egg yolk antibodies as therapeutics in enteric infectious disease:a review[J].J Med Food,2002,5:159-169.
[25] Rollier C,Charollois C.Early life humoral response of ducks to DNA immunization against hepadnavirus large envelope protein[J].Vaccine,2000,18(27):3091-3096.
[26] Krief A,Letesson J J,Billen D.Comparison between“IgY technology”from chickens and“IgG technology”from mice for production of tailormade antibodies[J].Tetrahedron Lett,2002,43:1843-46.
[27] Thermet A,Rollier C,Zoulim F,et al.Progress in DNA vaccine for prophylaxis and therapy of hepatitis B[J].Vaccine,2003,21:659-662.
[28] Higgins D A,Cromie R L,Liu S S,et al.GW.Purification of duck immunoglobulins:an evaluation of protein A and protein G affinity chromatography[J].Vet Immunol Immunopathol,1992,44:169-180.
[29] Warr G W,Magor K,Higgins D E.IgY antibodies for drug target discovery[J].Drug discov Today,2003,8:364-371.
