产淀粉酶非酿酒酵母菌的筛选及产酶特性研究
2014-04-24徐亚男刘秋萍赵九洲史学伟
徐亚男,刘秋萍,王 月,赵九洲,肖 婧,史学伟*
(石河子大学 食品学院,新疆 石河子 832000)
淀粉酶是一类能够催化α-D-吡喃葡糖基之间1-4糖苷键水解的酶类[1],广泛存在于动物、植物和微生物有机体中,作用于淀粉分子产生多种产物,包括糊精、低聚糖及单糖分子等。淀粉酶作为一种生物催化剂,与传统的化学催化剂相比具有催化能力强、底物专一性高等优点[2],已在各个行业中得到广泛应用。在淀粉加工行业中,用酶法糖化制造葡萄糖,使糖纯度高、收得率高[3];用淀粉酶液化和麦芽糖化法制麦芽糖,节约粮食,提高得糖率;α-淀粉酶制造低聚异麦芽糖,不产生界限糊精,有利于过滤[4];α-淀粉酶可将淀粉长链分子水解为短链分子[1],制造淀粉黏合剂,可增大其固体含量,控制淀粉的黏度以适应纸箱行业的需要;在纺织工业中,通常采用分批浸入式和连续式的α-淀粉酶去浆;在临床医学分析和制药工业上,耐酸性强的α-淀粉酶可作为助消化剂添加于消化药中[5];在面包制作中淀粉酶用于改善面包的质量风味、缩短发酵时间、节约用糖[6];此外还广泛用于造纸业和清洁剂工业等。鉴于淀粉酶是用途最广和产量最大的酶这一现状,选育出酶产量高且具有良好性能的淀粉酶产生菌有着重要的应用价值。
非酿酒酵母菌是一类自然存在于葡萄表皮、酿酒环境中,能分泌多种胞外酶,通过代谢和自溶提高发酵食品的感官特性,参与复杂风味物质形成的酵母菌[7]。本研究的目的是在新疆特色葡萄、苹果及奶酪产品中,广泛采集非酿酒酵母菌,以期从中找到产淀粉酶活性较高的菌株。通过对产淀粉酶菌株进行鉴定,对所产淀粉酶的性质进行初步研究,应用于新疆特色酿造发酵行业中,以期改善产品质量,为后期的研究提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
样品采自新疆苹果园腐烂苹果、新疆维吾尔族人自制奶酪、新疆葡萄产区葡萄表皮及土壤,分离纯化、鉴定后选取生长力较好的非酿酒酵母菌株为试验菌株。
1.1.2 培养基[8]
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖2.0%,酵母提取物2.0%,蛋白胨2.0%,琼脂2.0%,pH 7.0,121 ℃灭菌20 min。
酵母膏胨葡萄糖(yeast peptone dextrose,YPD)培养基:葡萄糖2.0%,酵母提取物2.0%,蛋白胨2.0%,pH 7.0,121 ℃灭菌20 min。
筛选培养基:酵母膏0.5%,蛋白胨1.0%,NaCl 1.0%,可溶性淀粉0.2%,琼脂2.0%,pH 7.0,121 ℃灭菌20 min。
种子培养基:酵母膏0.5%,蛋白胨1.0%,NaCl 1.0%,可溶性淀粉0.2%,pH 7.0,121 ℃灭菌20 min。
发酵培养基:酵母膏0.2%,蛋白胨0.8%,可溶性淀粉1.2%,MgSO4·7H2O 0.05%,K2HPO40.1%,pH 7.0,121 ℃灭菌20 min。
试验所用试剂及药品均为分析纯:新疆沃德生物公司。
1.2 仪器与设备
ES120型精密天平:上海力衡仪器仪表有限公司;SW-CJ-2D型超净台:上海尚道仪器设备有限公司;DHP-9162型电热恒温培养箱:上海申贤恒温设备厂;BHWY-211型变频恒温摇床:常州诺基仪器有限公司;TGL-16型台式高速离心机:金坛市城西丽华实验仪器厂;W-201B型数显恒温水浴锅:金坛市国旺实验仪器厂。
1.3 方法
1.3.1 菌株分离纯化
样品经破碎带皮进行自然发酵,发酵启动后以不同浓度梯度涂布于YPD培养基,28 ℃培养48 h后,多次分离划线得到单菌落,接种于YEPD培养基28 ℃培养48 h后,甘油保存于-80 ℃冰箱。苹果样品编号为Ai,奶酪样品编号为Nj,葡萄样品编号为Yz。
1.3.2 26S rDNA基因PCR扩增
根据形态学特征选取生长力较好且具有代表性的菌株按陈杰等[9]的方法进行DNA提取及PCR扩增产物测序。
1.3.3 产酶菌株的筛选
菌悬液于37 ℃涂布于筛选培养基上培养24 h后加稀碘液,静置5 min后即可见清晰的透明圈[10],测量透明圈与菌落直径选取较大的单菌落接种于种子培养基,摇床37 ℃振荡培养24 h,5%接种量于发酵培养基,摇床37 ℃振荡培养24 h。
1.3.4 粗酶液的制备
取发酵液于4 ℃、5 000 r/min 条件下离心5 min,上清液即为粗酶液。
1.3.5 淀粉酶活性测定
取离心后的发酵液0.2 mL与1 mL质量分数为1%的淀粉溶液于37 ℃水浴5 min后沸水浴5 min终止反应,加入1 mL 3,5-二硝基水杨酸(dinitrosalicylic acid,DNS),沸水浴5 min后迅速冷却,10 mL定容,于波长540 nm处测定其吸光度值。以煮沸1%淀粉溶液为空白。酶活力单位定义[11]:在37 ℃,每分钟生成1 μmol/L葡萄糖所用酶量为1个酶活单位(U)。酶活力计算公式如下:

式中:A为根据回归方程计算得葡萄糖含量,mg;N为稀释倍数;t为反应时间,min。
1.3.6 粗酶性质研究
(1)pH值对酶活的影响[12]
分别配制0.1 mol/L Na2HPO4-柠檬酸缓冲溶液(pH 3.0~5.0)、醋酸缓冲溶液(pH 4.0~7.0)、Tris-HCl缓冲溶液(pH 6.0~9.0)、甘氨酸-NaOH缓冲溶液(pH 8.0~10.0),配制1%淀粉溶液作为酶活测定的反应底物,考察pH值对酶活的影响。
(2)pH稳定性研究
粗酶液分别与等量不同pH缓冲液混匀,置于4 ℃冰箱12 h后,调至最适pH测酶活,以最高酶活为100%,其他pH条件下为相对酶活,考察酶pH稳定性。
(3)温度对酶活的影响[13]
控制水浴温度,每10 ℃为一个梯度,温度分别为30 ℃、40 ℃、50 ℃、60 ℃、70 ℃[13],水浴5 min后,测酶活,以确定最适反应温度,考察温度对酶活的影响。
(4)热稳定性研究
粗酶液置于不同温度水浴,30 min后迅速冷却,测酶活,以最高酶活为100%,其他温度条件下为相对酶活,考察酶的热稳定性。
(5)金属离子、抑制剂、螯合剂对酶活的影响[14]
反应体系中加1 mmol/L各种金属离子溶液1 mL:Ca2+、Mg2+、Fe2+、Fe3+、Cu2+;抑制剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS);螯合剂乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),测酶活,以最高酶活为100%,其他金属离子及抑制剂、螯合剂下为相对酶活,考察金属离子、抑制剂、螯合剂对酶活的影响。
1.3.7 数据分析
独立重复进行3次试验,结果表示3次测定的平均值。
2 结果与分析
2.1 基于26S rDNA基因序列的酵母菌株系统发育分析
样品菌株经分离纯化后根据形态学特征,选取37株非酿酒酵母菌进行DNA提取及26S rDNA基因PCR扩增,所得序列提交NCBI,通过Blast工具在GenBank数据库中与已发表的26S rDNA D1/D2区域序列进行同源性比较,构建系统发育树,结果见图1。
2.2 产酶菌株的筛选
将稀碘液滴入筛选培养基,观察颜色变化和水解圈,筛选出11株产淀粉酶菌株。产酶菌株分别为A1、A2、A4、A5、N1、N8、N11、Y13、Y15、Y18、Y19。筛选结果见图2。
由图2可知,A2、A5、N11、Y13的水解圈的直径与菌落直径的比值较大,该比值与液体发酵产酶能力的高低并不成正比关系。因菌落周围降解圈的大小除了与酶的活性有关外,还与菌株自身及酶所需的条件有关。因此,还需对酶进行酶学性质研究,以筛选出高产淀粉酶菌株。
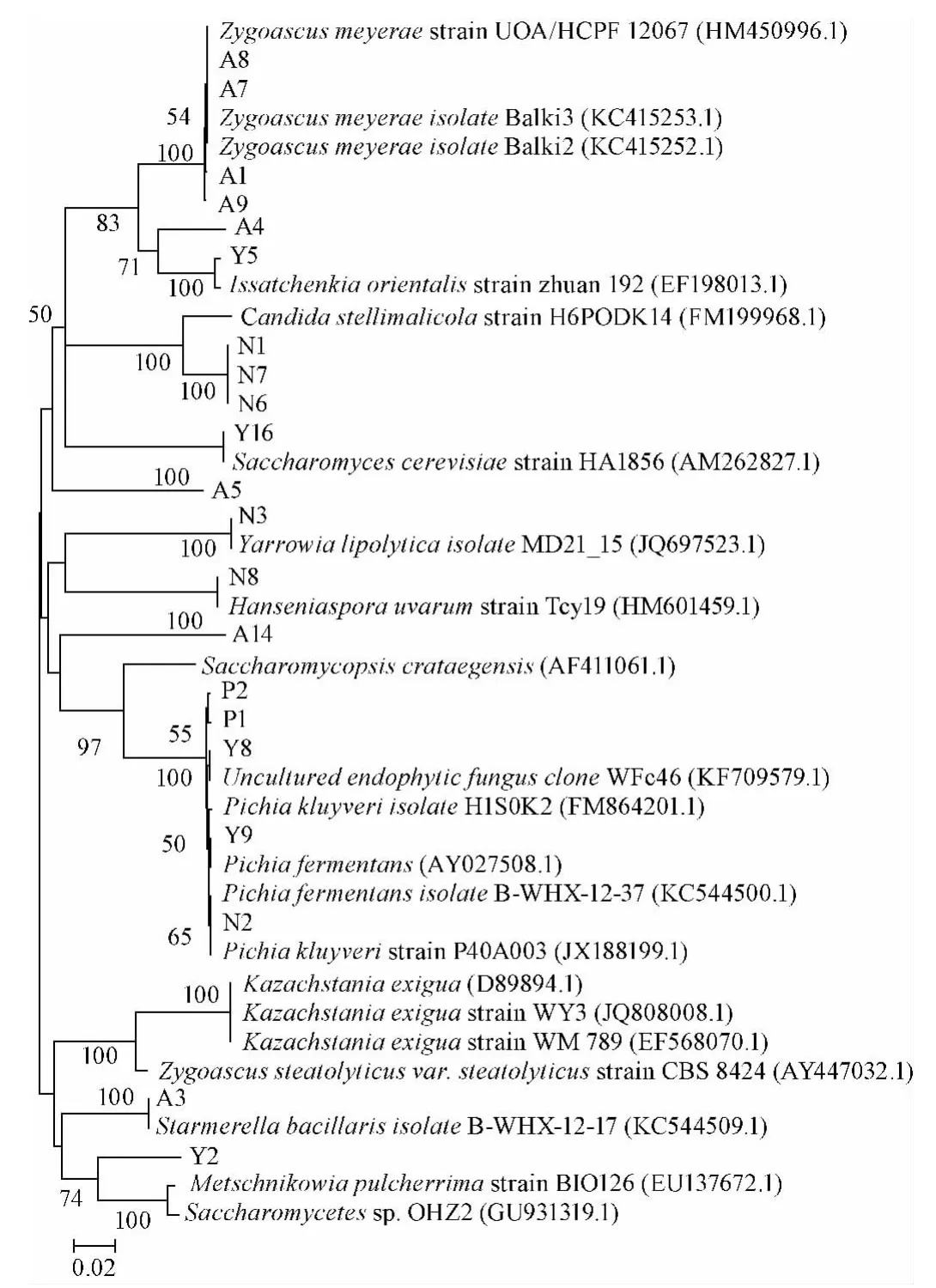
图1 基于26S rDNA序列的37株酵母菌株的系统发育树Fig.1 Phylogenetic tree of the 37 yeast strains based on 26S rDNA sequence

图2 产酶菌株筛选结果Fig.2 Screening results of enzyme production
2.3 粗酶性质试验结果
2.3.1 pH值对淀粉酶酶活性的影响

图3 pH值对淀粉酶活性的影响Fig.3 Effect of pH on amylase activity
酶需要在一定的pH值、温度和金属离子存在下才能发挥作用。pH值影响酶的空间结构、底物与酶的结合、酶活性部位的构象,进而引起酶的构象改变,使结合后不能生成产物,影响酶的活性[15]。由图3可知,在酶活定义37 ℃下测定酶活,随着pH值的升高,各菌株淀粉酶酶活力增大,在pH 7.0~8.0时达到最高(Y19除外),pH继续增加,则酶活力降低较大幅度。其中,Y19在pH值为9.0时酶活力达到最高,呈碱性。菌株A1、A2、A4、A5、Y13、Y15、Y18最适pH值为8.0,呈弱碱性;菌株N1、N8、N11最适pH值为7.0,呈中性。
2.3.2 pH值稳定性研究
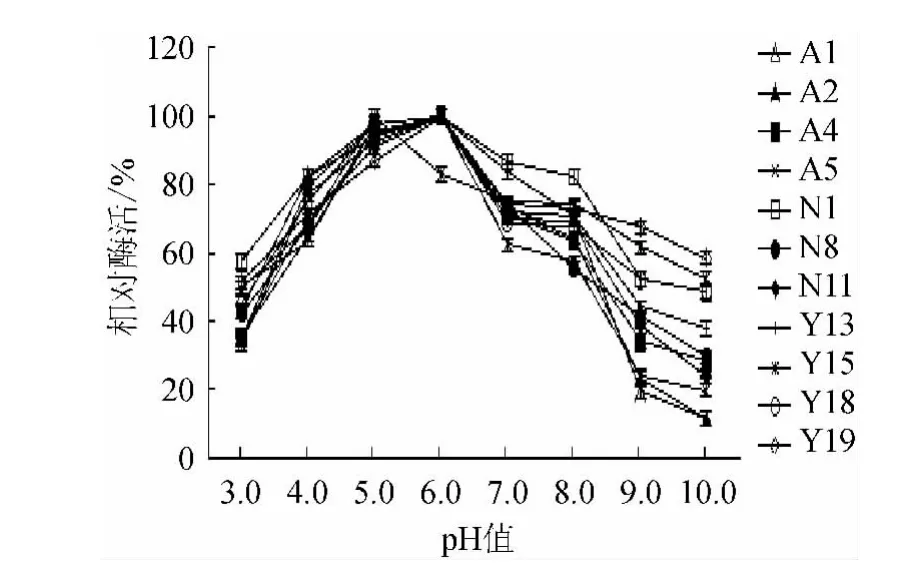
图4 淀粉酶的pH稳定性Fig.4 pH stability of amylase
不同的pH值会对酶的稳定性产生影响。通过对酶的pH值稳定性进行测定,可以找到能够使酶保持相对稳定的pH值条件,以使酶达到最大酶活限度的充分利用,从而对酶进行贮藏或生产[16]。由图4可知,各菌株在pH值为6.0时,酶活力均为最佳(Y15除外),在pH值为5.0时,Y15酶活力最佳。在pH 4.0~8.0范围内,各菌株均可保持较好酶活力,在强酸pH值为3.0、强碱pH值为10.0时,酶活损失较严重,说明菌株不耐强酸强碱。在pH及其稳定性试验中,N1菌株的产淀粉酶的酶活力最高,其他10株则相差不大。
2.3.3 温度对淀粉酶活性的影响
酶促反应受温度的影响:一方面,当温度升高时,反应速率加快;另一方面,随温度的升高,酶蛋白变性逐渐失活,反应速率下降[17]。由图5可知,在各菌株最适pH值作用下,随着温度的升高,各菌株的酶活力增大,在40 ℃时,各菌株均表现了最佳酶活力,随着温度继续升高,酶活力降低。由此可以判定,40 ℃为该菌株所产淀粉酶的最适温度。在此试验中,Y13酶活力最高,略高于N1。其他菌株也表现出较小的差异。

图5 温度对淀粉酶活性的影响Fig.5 Effect of temperature on amylase activity
2.3.4 热稳定性研究
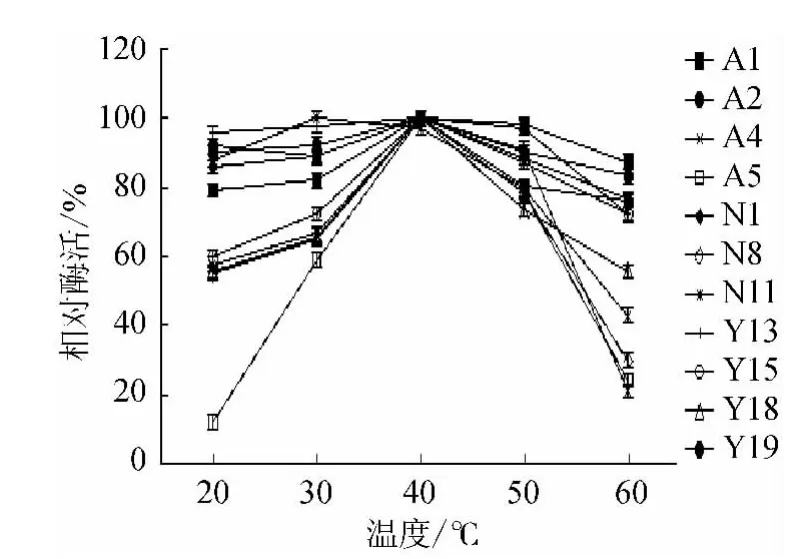
图6 淀粉酶的热稳定性Fig.6 Thermal stability of amylase
热稳定性是酶的重要属性之一[18],任何导致酶的空间结构变化的因素都会影响酶的热稳定性。由图6可知,在40 ℃时,各菌株均表现了最佳酶活力,在30~50 ℃时,各菌株保持了较高的酶活力。A5菌株在20 ℃和60 ℃时,酶活力损失较为严重,损失率分别为为88%和76%。
2.3.5 金属离子、抑制剂、螯合剂对淀粉酶活性的影响
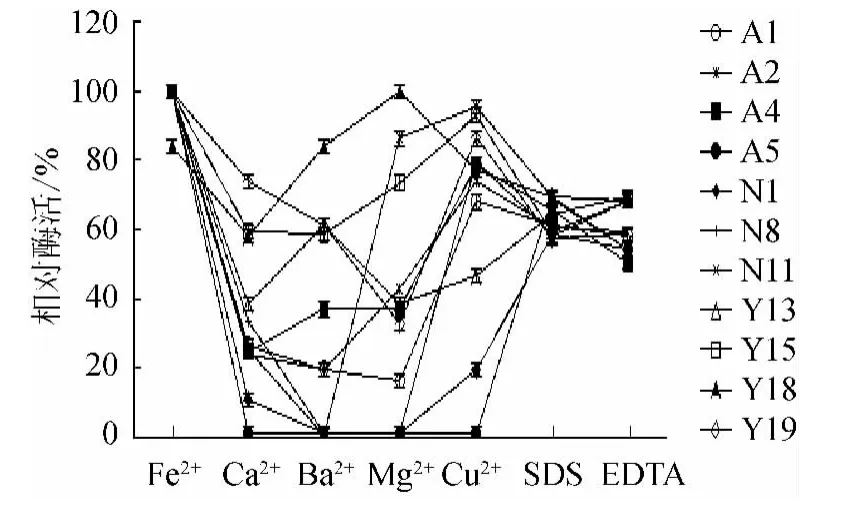
图7 金属离子、抑制剂、螯合剂对酶活力的影响Fig.7 Effect of metal ions,EDTA and SDS on amylase activity
在各菌株最适pH值、温度条件下测酶活结果(图7)可知,Fe2+和Cu2+对各菌株均有较高的激活作用,Fe2+的激活作用最大(Y18除外),Mg2+对Y18有较好的激活作用,其他几种金属离子均对淀粉酶有不同程度的抑制作用,SDS和EDTA均能抑制酶的活性,说明该酶的作用需要金属离子的参与。
3 结论
在新疆葡萄产区葡萄表皮及土壤、腐烂苹果及奶酪产品中广泛采集样品,分离出大量非酿酒酵母菌,对其中37株非酿酒酵母菌进行筛选,经过选择性培养基,成功筛选出11株产淀粉酶酵母菌,酶学性质研究表明,该11株酵母菌在pH 7~9表现了较高的酶活力,在pH 5~6时保持稳定;最适反应温度为40 ℃,在30~50 ℃时保持较高酶活力;金属离子依赖性发现,Fe2+、Mg2+对酶有不同程度的激活作用,Ca2+、Ba2+、Cu2+对酶有抑制作用。SDS、EDTA对酶均有抑制作用,由于EDTA为金属螯合剂,抑制酶活约为50%,可以推测,本试验中酶对二价金属离子具有一定的依赖作用。
在本试验中,N1和Y13表现出较高的酶活力,N1采自奶酪,Y13采自新疆葡萄园区,苹果样品中产酶量相对较少。后期将针对高产淀粉酶菌株进行诱变及分离纯化,对纯酶进行酶学性质的研究。
目前新疆葡萄酒酿造主要以进口酿酒酵母为主,缺乏地域特色。后期研究工作的重点是将本试验筛选高产淀粉酶诱变菌株进行扩大培养制备活性干酵母,与工业酿酒酵母混合发酵酿造葡萄酒,以期改善葡萄酒香气、提高产品质量及设备利用率,同时利用新疆葡萄酒地域优势[19],提高产品竞争力。
[1]SENYAY-ONCEL D,YESIL-CELIKTAS O.Treatment of immobilizedα-amylase under supercritical CO2conditions:Can activity be enhanced after consecutive enzymatic reactions?[J].J Mol Catal B Enzym,2013,91(11):153-162.
[2]BANKAR S B,JADHAV S B,SINGHAL R S,et al.Poly-ε-lysine amylase conjugates to increase the stability of enzyme[J].Food Biosci,2013,12(2):75-84.
[3]HE T,TIAN Y L,QI L,et al.Improved performance of α-amylase immobilized on poly(glycidyl methacrylate-co-ethylenedimethacrylate) beads[J].Int J Biol Macromol,2014,2(1):89-97.
[4]罗志刚,杨景峰,罗发兴.α-淀粉酶的性质及应用[J].食品研究与开发,2007,28(8):163-167.
[5]RANA M,KUMARI A,CHAUHAN G S,et al.Modified chitosan microspheres in non-aggregated amylase immobilization[J].Int J Biol Macromol,2014,66(2):35-48.
[6]彭 艳,赵强宗,徐建祥,等.α-淀粉酶对面包品质的影响[J].食品工业科技,2003,24(3):17-18.
[7]徐艳文,杨 莹,薛军侠,等.26S rDNA-RFLP 分析在非酿酒酵母菌分类研究中的应用[J].微生物学杂志,2007,27(4):23-26.
[8]王晓红.产淀粉酶海洋酵母菌的筛选、鉴定及粗酶性质的研究[D].青岛:中国海洋大学硕士论文,2007.
[9]陈 杰,赵雨薇,史学伟,等.新疆石河子地区酵母菌的生物多样性及系统发育研究[J].中国酿造,2012,31(11):102-105.
[10]李 新,孙 晓,李悦佳,等.中度嗜盐菌LY9 的分离鉴定及其淀粉酶特性研究[J].生物技术,2011,21(3):60-63.
[11]张 镜,李炜东,肖琼娜.PS0312 菌株发酵产淀粉酶及温度与pH 值对酶活力的影响[J].食品科学,2010,31(23):294-299.
[12]韩 萍.低温淀粉酶的分离,纯化及其酶学性质研究[D].昆明:昆明理工大学硕士论文,2007.
[13]陈国伟,许曹鲁,叶海滨,等.温度和pH 对美国红鱼蛋白酶和淀粉酶活力的影响[J].现代渔业信息,2011,26(2):13-16.
[14]BAYSAL Z,BULUT Y,YAVUZ M,et al.Immobilization of α-amylase via adsorption onto bentonite/chitosan composite:Determination of equilibrium,kinetics,and thermodynamic parameters[J].Starch-Stärke,2013,4(2):25-37.
[15]JAISWAL N,PRAKASH O,TALAT M,et al.Application of response surface methodology for the determination of optimum reaction conditions(temperature and pH)for starch hydrolysis by α-amylase[J].Asian J Biochem,2011,6(4):168-184.
[16]THOMA M V,JOKSIMOVIC L,KIRSCHBAUM C,et al.Altered salivary alpha-amylase awakening response in Bosnian War refugees with posttraumatic stress disorder[J].Psychoneuroendocrino,2012,37(6):810-817.
[17]EGAS M C V,DA COSTA M S,COWAN D A.et al.Extracellular α-amylase fromThermus filiformisOrk A2:purification and biochemical characterization[J].Extremophiles,1998,2(1):23-32.
[18]TSUCHIYA K,SAIDIN M Y B,INOUE T,et al.Qualitative measurement of pain by analysing the salivary alpha amylase[J].Precis Eng,2013,38(2):135-144.
[19]王 彬,刘维忠.新疆葡萄酒产业发展战略调整与对策研究[J].中国酿造,2006,25(4):78-79.
