不同浓度艾烟干预12周对大鼠肺与骨骼肌的影响
2014-04-21黄剑韩丽林岷瑜白桦杨佳王磊崔莹雪刘钧天黄畅赵百孝
黄剑 韩丽 林岷瑜 白桦 杨佳 王磊 崔莹雪 刘钧天 黄畅 赵百孝
《灵枢·官能篇》载有“针所不为,灸之所宜”,艾灸疗法具有数千年的历史,是中国传统医学的主流疗法之一,具有广泛的适应证和确切的治疗效果。但艾灸过程中产生一定的烟雾,针灸从业人员和患者常暴露于艾燃烧产生的烟雾中,时有眼睛流泪、咽喉不适等反应[1],大量长期吸入艾烟可能对机体有害[2],严重影响艾灸的应用与推广。研究显示,艾灸导致诊室内可吸入颗粒物(particles with an aerodynamic diameter of less than 10 μm,PM10)浓度升高,超出国家空气质量标准[3],大气可吸入颗粒物的增加可导致慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)住院率和死亡率增加、肺功能下降等[4-5]。
香烟燃烧亦产生一定烟雾,主动吸烟与被动吸烟严重危害人体健康。大量流行病学调查表明,吸烟是COPD 最重要的发病因素,香烟中的毒性成分和外源性活性氧(reactive oxygen species,ROS)可直接诱导肺内发生炎症反应和细胞凋亡。细胞凋亡、氧化损伤和炎症反应三者互为因果,形成闭环链式反应,导致COPD 的发生[6],并伴随骨骼肌炎症反应和营养不良。
本实验通过观察不同浓度艾烟干预大鼠12 周后对其血清瘦素、膈肌和趾长伸肌腱肿瘤坏死因子-ɑ(tumor necrosis factor,TNF-ɑ))、白介素-8(interleukin-8,IL-8)的变化并观察肺、骨骼肌病理改变来探讨艾烟对大鼠肺、骨骼肌的影响,以期为艾烟的安全性评价提供参考。
1 材料与方法
1.1 试剂和仪器
3年陈艾条(规格18 mm ×200 mm ×10 支;南阳汉医有限责任公司生产),全自动电子分析天平(河南爱博特科技发展有限公司生产),动式染毒柜(产品型号HOPE-MED8050,天津开发区合普工贸有限公司生产),JY99-ⅢB 型超声器(宁波新芝科器研究所),5415R 高速离心机(德国Eppendorf 公司),Lambdal P40 紫外可见分光光度仪(美国PE 公司),Multiskan 3 酶标(芬兰Thermo);光学显微镜(Olympus BH,单位编号NO.060107)。
1.2 实验动物与分组
本实验选择7 周龄雌雄Wistar 大鼠40 只,体重(60±10)g,购自北京维通利华实验动物技术有限公司。许可证号:[SCXK(京)2012-0001]。所有动物均用标准饲料喂养,自由进水;饲养环境温度18~22 ℃,采用人工控制照明,保持12 小时光照(8∶00~20∶00)和黑暗(20∶00~次日8∶00)交替循环,相对湿度为50~60%。适应性饲养1 周,按照随机数字表法将40 只大鼠随机分为四组,每组10 只,雌雄各半。空白对照组、低浓度组、中浓度组、高浓度组分别暴露于0 mg/m3、2.5~3.5 mg/m3、8.0~10.0 mg/m3、27.0~29.0 mg/m3艾烟浓度的动态染毒柜中(折算为0%、0.4%、2%、15%的透光率),每组在不同浓度组艾烟中暴露12 周,每天200 分钟,5 次/周,12 周末取材。
1.3 用动式染毒柜进行艾烟干预
该实验选用动式染毒柜可精确控制艾烟浓度并维持染毒环境氧气、温度、湿度、压强的恒定。艾烟浓度用透光率度量,浓度越低,透光率越高。打开染毒柜电源,设置动式染毒柜各项参数:氧气为26%、湿度45~63%、温度20~22 ℃、压强-70 kp、时间200 分钟,观察染毒柜屏幕显示,待染毒柜内艾烟浓度分别达到低、中、高相应浓度,打开舱门,迅速放入动物,待仪器显示干预时间已到,取出动物;空白对照组放置于染毒柜中,设置动式染毒柜各项参数同前,不进行任何干预。
1.4 取材
1.4.1 血清 沿腹白线剪开腹腔,移开肠胃,分离脂肪,找到脊柱,再沿脊柱找到腹主动脉,将注射器针头从远心端向近心端刺入动脉,抽血5 ml。静置2小时后,3000 rpm 离心10 分钟,取上层血清,-20 ℃存放,备检。
1.4.2 膈肌和趾长伸肌腱 沿腹部向上延长正中线切口至大鼠颈部,在膈肌以上横着剪开胸壁,打开胸腔,灭菌组织剪小心分离大鼠膈肌,放入事先用焦碳酸二乙酯(diethy pyrocarbonate,DEPC)处理过的冻存管中,液氮冻存。在大鼠右后肢剪开皮肤,灭菌组织剪分离趾长伸肌腱,放入事先用DEPC处理过的冻存管中,液氮冻存。
1.5 病理学检查
肺、膈肌和趾长伸肌腱用生理盐水冲洗干净后经10%中性甲醛固定,酒精系列脱水,二甲苯透明,石蜡包埋,常规切片,HE 染色,光学显微镜下观察。
1.6 检测指标
瘦素、膈肌和趾长伸肌腱TNF-ɑ、IL-8 含量的测定采用酶联免疫吸附双抗体夹心法(enzyme linked immunosorbent assays,ELISA)原理定量测定血清瘦素、膈肌和趾长伸肌腱TNF-ɑ、IL-8 含量,严格按照试剂盒说明书操作。
1.7 统计学处理
采用SPSS 17.0 统计软件进行统计学处理。指标均采用均值±标准差(±s)表示,若各组数据服从正态分布,组间比较采用单因素方差分析;若不服从正态分布,采用非参数检验,结果以中位数和四分位数间距[M(Q3-Q1)]表示。P<0.05 为有差异,具有统计学意义。
2 结果
2.1 大鼠体重及外观行为变化
艾烟染毒大鼠12 周期间,未出现明显中毒死亡,各组大鼠被毛外观体征、行为活动、精神状态、粪便、食欲等未见明显毒性改变,未见呕吐、流涎等耳鼻眼口等异常分泌物。各组雌性大鼠体重均服从正态分布,采用单因素方差分析;而各组雄性大鼠体重不服从正态分布,采用非参数检验。统计结果表明,可以认为第12 周雌雄大鼠体重未见明显差异(P>0.05),见表1。

表1 第12 周大鼠体重比较(g)
2.2 膈肌、趾长伸肌腱TNF-ɑ、IL-8 含量比较
各组雌雄大鼠膈肌、趾长伸肌腱TNF-ɑ、IL-8 含量均服从正态分布,采用单因素方差分析。统计结果表明,不能认为空白对照组,低、中、高浓度艾烟各组大鼠膈肌、趾长伸肌腱TNF-ɑ、IL-8 含量不等(P>0.05),见表2。
表2 不同浓度艾烟对大鼠膈肌、趾长伸肌腱TNF-ɑ、IL-8 的影响(pg/mg,±s)

表2 不同浓度艾烟对大鼠膈肌、趾长伸肌腱TNF-ɑ、IL-8 的影响(pg/mg,±s)
注:各组总体均数比较,1aP=0.951,2aP=0.436,1bP=0.706,2bP=0.900,1cP=0.574,2cP=0.528,1dP=0.957,2dP=0.940,P>0.05
性别与组别 n 膈肌TNF-ɑ 含量a 膈肌IL-8 含量b 趾长伸肌腱TNF-ɑ 含量c 趾长伸肌腱IL-8 含量d雌性1空白对照组 5 22.86±5.11 94.76±29.15 24.79±3.45 74.87±24.53低浓度组 5 22.52±4.69 94.26±21.24 18.82±9.21 80.56±12.74中浓度组 5 22.01±7.66 92.06±23.08 21.90±5.48 82.28±29.32高浓度组 5 20.72±6.97 79.63±17.87 21.89±6.82 80.53±20.01雄性2空白对照组 5 23.25±7.51 85.58±18.54 24.39±3.55 90.99±21.66低浓度组 5 21.71±7.46 85.06±15.91 22.55±6.55 85.52±33.00中浓度组 5 18.86±5.91 77.87±17.91 22.87±5.66 81.50±26.45高浓度组 5 17.02±4.03 84.25±20.46 19.55±4.36 88.14±1 4.81
2.3 血清瘦素含量比较
各组雌雄大鼠血清瘦素含量均服从正态分布,采用单因素方差分析。统计结果表明,不能认为空白对照组,低、中、高浓度艾烟各组大鼠血清瘦素含量不等(P>0.05),见表3。
表3 不同浓度艾烟对大鼠血清瘦素的影响(ng/ml,±s)

表3 不同浓度艾烟对大鼠血清瘦素的影响(ng/ml,±s)
注:雌、雄大鼠各组总体均数比较,P>0.05;雌性大鼠各组间比较,P=0.735,P>0.05;雄性大鼠各组间比较,P=0.989,P>0.05
性别与组别 n 血清瘦素含量雌性空白对照组 5 22.38±1.27低浓度组 5 22.67±4.99中浓度组 5 21.72±5.16高浓度组 5 20.16±2.35雄性空白对照组 5 21.35±2.48低浓度组 5 20.70±4.64中浓度组 5 20.81±4.05高浓度组21.41±4.74 5
2.4 大鼠肺、膈肌、趾长伸肌腱病理组织观察
空白对照、低、中、高浓度艾烟各组大鼠肺、膈肌、趾长伸肌腱病理组织均无显著差异。肺组织染色均匀,组织结构清楚,无变性、无坏死,无纤维组织增生;膈肌、趾长伸肌腱为一片状附有筋膜的横纹肌,膈肌细胞排列整齐,无肿胀、溶解、空泡样改变,肌间隙无炎症细胞浸润;趾长伸肌腱肌细胞排列整齐,未见变性、坏死,萎缩、溶解等变化,肌间隙无炎症细胞浸润,表明艾烟暴露未导致肺、膈肌、趾长伸肌腱病理性改变,见图1~3。
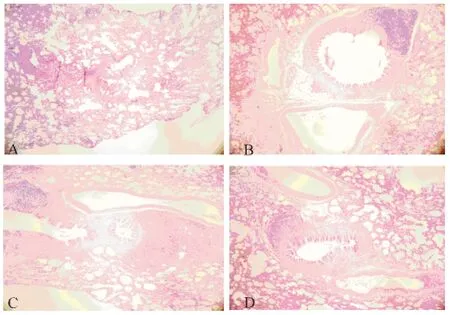
图1 大鼠肺组织病理学检查(HE 染色,×400)

图2 大鼠膈肌病理学检查(HE 染色,×400)

图3 大鼠趾长伸肌腱病理学检查(HE 染色,×400)
3 讨论
前期研究显示,艾烟与香烟烟雾的化学成分不同[7-9],对细胞、各组织器官的影响亦有差异[10-15]。大量流行病学调查表明,香烟造成COPD 并伴随骨骼肌炎症反应和营养不良,采用被动吸烟建立的COPD 动物模型也是目前所有模型中最接近人类的COPD,但未见艾烟造成COPD 并影响骨骼肌的报道。
本实验率先研究艾烟对大鼠骨骼肌的影响,研究结果表明,亚急性毒理实验中艾烟对大鼠肺、膈肌和趾长伸肌腱的病理组织切片、TNF-ɑ、IL-8 以及血清瘦素无明显的影响。因此,艾烟对大鼠肺和骨骼肌无明显毒性作用。
在亚急性毒理实验过程中,观察雌雄大鼠的外观体征和行为活动,粪便性状等均未见明显毒性改变,艾烟干预组雄性大鼠体重于第5 周较空白对照组降低,但第12 周体重恢复提示应激反应,所以雌雄大鼠体重均未见明显影响。此外,本实验选取大鼠体重为指标,观察艾烟对大鼠全身骨骼肌的变化,能够更加客观、整体地反映艾烟对大鼠骨骼肌的影响。
COPD 是一种具有气流受限为特征的疾病,气流受限不完全可逆、呈进行性发展,这种改变与气道炎症密切相关,从而导致气道壁的损害。肺弹性回缩力下降,呼出气流受限,呼吸肌负担加重,并伴随全身性炎症反应的表现[16]。其中骨骼肌是COPD 系统性损伤最主要的受累器官,表现为肌肉功能障碍、萎缩及肌肉中无脂肪组织的减少[17]。严重的COPD 患者其肌肉萎缩程度和疾病程度成正相关,是COPD 死亡的独立危险因素[18-19]。本实验选择膈肌和趾长伸肌腱作为呼吸肌和外周肌的代表,因为膈肌是最主要的呼吸肌,在呼吸过程中所起的作用约占全部呼吸肌的60~80%[20],而趾长伸肌腱是大鼠肢体远心端的肌肉,在大鼠活动中活动频率很高,排除了废用性萎缩的可能,两种肌肉的选择具有良好的代表性。
香烟烟雾导致肺部启动一系列的炎症反应,使组织中TNF-α、IL-8 等炎症介质的释放增加,这些炎症介质又进一步活化了炎症细胞[21-22]。瘦素和COPD 有着密切的关系,它与COPD 患者的营养不良和炎症状态有关。瘦素除了参与COPD 的全身性炎症反应外,还参与了气道局部炎症反应并且影响COPD 的发生、发展和预后,是病情评价的重要指标。进一步的相关分析表明,COPD 患者急性加重期瘦素与TNF-α 的水平有明显正相关性[23]。本实验雌雄大鼠膈肌TNF-ɑ 的P 值有波动,可能与样本量不足有关,有待增加大鼠样本量以做进一步研究。
4 结论
本次亚急性毒理实验率先探讨艾烟是否会造成COPD 导致骨骼肌炎症反应和营养不良,发现低、中、高浓度艾烟干预雌雄大鼠后,血清瘦素、膈肌和趾长伸肌腱TNF-ɑ、IL-8 含量与空白对照组无显著差异,各组肺、膈肌和趾长伸肌腱病理未见显著改变,表明艾烟未对大鼠骨骼肌造成明显炎症和营养不良反应,提示艾烟对大鼠骨骼肌无明显毒性作用。本研究提出新的艾烟毒理实验和安全性分析的方法、指标,进一步说明艾烟与香烟烟雾的差异性,为艾烟安全性评价提供了实验数据,有效加快灸法的科学化、现代化和国际化进程。
[1]Peck G.Moxa smoke and the acupuncturist[J].Journal of Chinese medicne,1993,(41):10-11.
[2]Wheeler J.,Coppock B.,Chen C.Does the burning of moxa(Artemisia vulgaris)in traditional Chinese medicine constitute a health hazard?[J].Acupuncture in Medicine,2009,27(1):16-20.
[3]黄茶熙,赵百孝,刘平,等.京津地区艾灸场所夏季可吸入颗粒物(PM10)的质量浓度及微观形貌分析[J].中华中医药杂志,2012,27(12):3104-3108.
[4]Macnee W,Donaldson K.Exacerbations of COPD:environmental mechanisms[J].Chest,2000,117(suppl):390-397.
[5]Seaton A.,Macnee W.,Donaldson K.,et al.Particulate air pollution and acute health effects[J].Lancet,1995,345:176-178.
[6]Tuder R.M.,Zhen L.,Cho C.Y.,et al.Oxidative stress and apoptosis interact and cause emphysema due to vascular endothelial growth factor receptor blockade[J].American journal of respiratory cell and molecular biology,2003,29(1):88-97.
[7]靳然,赵百孝,于密密,等.艾燃烧生成物组分固相微萃取气相色谱质谱法定性分析[J].北京中医药大学学报,2011,34(9):632-636.
[8]周次利,吴焕淦,窦传字,等.三年陈蕲艾艾烟化学成分的GC-MS 分析[C]//2011 中国针灸学会年会论文集(摘要),北京:北京出版社,2011:223-232.
[9]孙咏梅,戴树桂,袭著革.香烟烟雾成分分析及其对DNA生物氧化能力研究[J].环境与健康杂志,2001,18(4):203-207.
[10]张晓荣,徐佩茹,多力坤,等.香烟烟雾提取物对A549 的活性及TNF-α 的影响[J].新疆医科大学学报,2005,28(12):1138-1140.
[11]Hoshino Y.,Mio T.,Nagai S.,et al.Cytotoxic effects of cigarette smoke extract on an alveolar type II cell derived cell line[J].Am J Physiol Lung C ell Mol Physiology,2001,281:509-516.
[12]吴禹,周向东.香烟烟雾可吸入微粒对大鼠支气管肺组织的氧化损伤研究[J].临床肺科杂志,2006,11(6):703-704.
[13]孟笑男,徐焕芳,崔莹雪,等.艾燃烧生成物对快速老化模型小鼠大脑SOD、MDA 和GSH-Px 的影响[J].环球中医药,2011,4(6):413-415.
[14]聂坤荣.吸烟致癌的自由基机制[J].国外医学肿瘤学分册,1992,19(4):204-208.
[15]罗建军,曾明,尹晓晨,等.香烟烟雾对大鼠血脂和脂质过氧化的影响[J].实用预防医学,2008,15(5):1345-1346.
[16]Agusti A.G.,Noguera A.,Sauleda J.,et al.Systemic effects of chronic obstructive pulmonary disease[J].Eur Respir J,2003,21(2):347-360.
[17]Gosker H.R.,Kubat B.,Schaart G.,et al.Myopathological features in skeletal muscle of patients with chronic obstructive pulmonary disease[J].European Respiratory Journal,2003,22(2):280-285.
[18]Marquis K.,Debigaré R.,Lacasse Y.,et al.Midthigh muscle cross-sectional area is a better predictor of mortality than body mass index in patients with chronic obstructive pulmonary disease[J].American Journal of Respiratory and Critical Care Medicine,2002,166(6):809-813.
[19]Swallow E.B.,Reyes D.,Hopkinson N.S.,et al.Quadriceps strength predicts mortality in patients with moderate to severe chronic obstructive pulmonary disease[J].Thorax,2007,62(2):115-120.
[20]Wilson T.A.,Legrand A.,Gevenois P.A.,et al.Respiratory effects of the external and internal intercostal muscles in humans[J].The Journal of physiology,2001,530(2):319-330.
[21]Rahman I.,Adcock IM.Oxidative stress and redox regulation of lung inflammation in COPD[J].Eur Respir J,2006,28:219-242.
[22]Donnelly L.E.,Barnes P.J.Chemokines receptors as therapeutic targets in chronic obstructive pulmonary disease[J].Trends Pharmacol Sciences,2006,27:546-553.
[23]Krommidas G.,Kostikas K.,Papatheodorou G.,et al.Plasma leptin and adiponectin in COPD exacerbations:associations with inflammatory biomarkers[J].Respiratory medicine,2010,104(1):40-46.
