青蛤(Cyclina sinensis)组织蛋白酶L基因的表达与重组蛋白活性分析*
2014-04-16刘诗萌潘宝平
刘诗萌 赵 婷 张 皞 潘宝平
青蛤()组织蛋白酶L基因的表达与重组蛋白活性分析*
刘诗萌 赵 婷 张 皞 潘宝平①
(天津师范大学生命科学学院 天津市动植物抗性重点实验室 天津 300387)
利用荧光定量PCR方法检测了青蛤()在鳗弧菌()胁迫下组织蛋白酶L基因(CsCPL)在各组织的表达差别及其在血淋巴中的时序表达关系。结果表明, CsCPL基因在青蛤血淋巴、肝脏、外套膜、鳃和闭壳肌等组织中普遍表达, 其中以血淋巴表达水平最高。在鳗弧菌刺激后3—96h青蛤的血淋巴中CsCPL的表达量均出现明显上调, 其中6h达到最大值并且与对照组有极其显著性差异(<0.01), 说明该基因在青蛤免疫反应中具有重要作用。文章还对CsCPL基因进行了原核表达, 其产物蛋白分子量约35kDa, 经纯化及复性后具有明显的抑菌作用。
青蛤; 组织蛋白酶L; 实时定量PCR; 抑菌实验
青蛤()是我国重要的海产经济贝类(顾润润等, 2006)。近年来随着国内青蛤增养殖规模的扩大和养殖密度的增加, 加之养殖环境的不断恶化, 青蛤由病原微生物引起的疾病时有发生(孙国铭等, 2004; 曹华, 2004), 对该项养殖产业威胁很大。因此, 对该物种的免疫抗病机制研究具有重要的理论和实践意义。
贝类的免疫反应系统包括细胞免疫和体液免疫, 其血细胞作为抵御外来微生物侵袭的主要承担者, 其免疫应答功能主要通过血细胞内溶酶体中的多种水解酶进行(张朝霞等, 2006)。组织蛋白酶类是重要的溶酶体型半胱氨酸蛋白酶, 即通常所称的溶酶体型蛋白水解酶类(Kirschke, 1987), 在各种类群生物体中均有发现(Lecaille, 2002), 且种类众多, 从组织蛋白酶A到Z都有报道(Chwieralski, 2006)。根据催化作用机制, 大部分的组织蛋白酶归属于蛋白酶家族中的半胱氨酸蛋白酶, 有少数的组织蛋白酶属于天冬氨酸蛋白酶和丝氨酸蛋白酶(杨东辉等, 2012)。
组织蛋白酶L是半胱氨酸蛋白酶中木瓜蛋白酶C1家族的主要成员, 以酶原的形式贮存于溶酶体中, 广泛存在于各种动植物、微生物有机体中(Zeng, 2005; Liu, 2006), 在很多种类的蛋白质水解过程中起着非常重要的作用。研究表明组织蛋白酶L还参与许多重要的生理、生命活动, 如抗原呈递、组织再生、骨质吸收、肿瘤入侵和转移、炎症发生和细胞凋亡等, 成为近年来备受关注的一类靶标蛋白酶。现已有研究人员从多种鱼体中分离得到组织蛋白酶L, 对其性质研究也比较详细(Yamashita, 1990; Lee, 1993; Aranishi, 1997; Visessanguan, 2003)。根据已见水产动物的组织蛋白酶L基因相关报道, 组织蛋白酶L在众多水产动物免疫系统中均发挥重要作用, 如凡纳滨对虾() (Zhao, 2007)、中国对虾()(Bu, 2008)、中华绒螯蟹()(Li, 2010)、脊尾白虾()(段亚飞等, 2013)、紫贻贝()(Venier, 2006)、合浦珠母贝()(Ma, 2010)、三角帆蚌()(白志毅等, 2011)、海湾扇贝()(李娟等, 2011)。目前尚未见到青蛤该基因的研究报道。
1 材料与方法
1.1 材料
青蛤()样品采于天津大港滩涂, 暂养于通气海水中, 海水密度1.02—1.04g/cm3, 水温21—24°C, 投喂5‰小球藻, 选择没有损伤, 形态上无显著差异的个体[平均壳宽(19.12±0.57)mm, 平均壳长(29.14±1.23)mm, 平均壳高(29.52±1.47)mm], 一周后开始实验。
将实验室保存的鳗弧菌()菌种用2216E培养基于28°C下培养24h, 用无菌海水重悬菌液, 将其浓度调为OD600= 0.4。采用随机分组方法, 每次试验均设10个平行组。实验组青蛤注射50mL/只的鳗弧菌菌液, 对照组注射等量的灭菌生理盐水。注射前提取血淋巴、肝脏、外套膜、闭壳肌和鳃, 准确称取组织质量50mg; 注射后3h、6h、9h、12h、24h、48h、96h时提取血淋巴。以上组织迅速放入液氮冷冻备用。
1.2 方法
1.2.1 cDNA文库的构建 利用TRIZOL法, 提取青蛤各个组织的总RNA, 采用QIAGEN公司的Oligotex mRNA Kits方法进行分离纯化。根据Clontech公司的SMART cDNA Library Construction Kit试剂盒说明书进行cDNA文库的构建, 采用pBluescript II SK*改造体作为连接载体, 感受态细胞为(DH5a)。文库随机测序引物T7-F: 5′ TAATACGACTCACTATAGG 3′, T3-R: 5′ AATTAACCCTCACTAAAGG 3′, 将所得序列去除载体序列后拼接得到contig及无法与其它序列拼接的singlest数据, 将测得的序列用BLAST进行同源性分析。
1.2.2 生物信息学分析 将获得的青蛤mytimacin基因类似序列的全长cDNA序列与GenBank中的核酸数据库作BLASTX分析, 利用开放阅读框(Open Reading Frame, ORF)在线分析其蛋白质序列, 使用SignalP 3.0和SMART分别分析该基因的信号肽序列并查找结构域, ProtParam工具在线预测序列的分子式、分子量和等电点, 通过CLUSTALw进行氨基酸序列同源性分析。
1.2.3 CsCPL基因在青蛤各组织内的表达 利用TRIZOL法提取血淋巴、肝脏、外套膜、闭壳肌和鳃的总RNA, 反转成cDNA在-20°C保存备用。以b- actin基因为内参基因, 实时定量引物分别为b-actin-F: 5′ CACCACAACTGCCGAGAG 3′,b-actin-R: 5′ CCGATAGTGATGACCTGACC 3′; CPL-F: 5′ GTCACATTCGCCAAGCAA 3′, CPL-R: 5′ TGAAGGACCAGCAAGAGCC 3′; 反应在Rotor-Gene 6000实时定量PCR仪上进行, 扩增体系为20mL, 反应程序为: 95°C预变性30s, 94°C变性5s, 60°C退火30s, 72°C延伸30s, 40个循环。
1.2.4 CsCPL基因在血淋巴内的时序性表达 利用TRIZOL法提取鳗弧菌侵染后各时间点血淋巴总RNA, 并反转成cDNA。荧光定量PCR引物、反应体系及程序等见1.2.3。数据处理采用2-DDCt法(Livak, 2001), 使用SPSS软件进行单因素方差分析。
1.2.5青蛤CsCPL的原核表达 用特异性引物CPL-N: 5′ CATATGCACCATCATCATCATCATTTGCCTGAGGAAATGGACTGGAGGA 3′; CPL-E: 5′ GAATTCTTAAACAAGTGGG TATGATGCCTGG 3′, 扩增得到的CsCPL成熟肽基因, 连接到pMD18-T载体, 得到pMD18-T-CPL并用pMD18-T载体通用引物和CsCPL特异性引物进行阳性克隆筛选, 测序鉴定。用RⅠ和Ⅰ双酶切pMD18-T-CPL, 回收CsCPL基因并与RⅠ和Ⅰ酶切开环的pET30a(+)连接, 转入表达宿主菌大肠杆菌BL21(DE3)pLysS感受态细胞中, 得到重组质粒pET30a(+)-CPL并用T7引物和CsCPL特异性引物进行阳性克隆筛选及测序鉴定。
1.2.6 重组蛋白的纯化复性与功能验证 将转化菌株接入到LB液体培养基中(含100mg/mL硫酸卡那霉素), 220r/min, 37°C培养至OD600左右, 取样1mL作为诱导前对照, 向剩下的菌液中加入IPTG(终浓度1mg/mL)37°C诱导培养, 每隔1h取样1次, 每次取1mL。取500mL诱导的菌液, 4°C, 6000r/min离心收集菌体, 以菌体裂解液重悬并超声破碎。4°C, 6000r/min再次离心, 将沉淀重悬并过滤膜后得到重组蛋白粗提液。
将得到的重组蛋白粗提液过Ni柱纯化, 使用康为世纪公司的Ni-Agarose His标签蛋白纯化试剂盒(包涵体蛋白), 将收集到的蛋白进行SDS-PAGE凝胶电泳检测。采用透析法进行复性, 将纯化后的蛋白放在透析袋中, 再把透析袋放置在含有50mmol/L的Tris-HCl和8、6、5、4、2、1、0mol/L尿素缓冲液中(pH 5.5), 复性后的蛋白冻干, 称重,-80°C保存备用。
将实验室冻存的藤黄微球菌菌株37°C, 220r/min培养过夜, 6000r/min, 5min离心收集菌体, 用灭菌TBS溶液清洗三次, 用LB培养基重悬。将等浓度的重组蛋白CsCPL、牛血清白蛋白BSA、溶菌酶Lysozyme及灭菌TBS分别与菌体混合, 加入96孔板中培养, 编辑程序, 37°C震荡培养, 每0.5h记录一次OD600数据, 共计4.5h。将输出数据于Excel中进行分析整理, 绘制菌生长曲线。
2 结果
2.1 青蛤CsCPL基因的结构
构建的SMART·cDNA文库容量为1.12×106cfu/mL, 重组率约为96.4%。经随机挑取克隆大规模测序后, 利用BLASTX在线比对后分析发现组织蛋白酶Cathepsin家族基因类似序列。该序列与缢蛏()Cathepsin家族cathepsin L3基因相似性最高, 一致性达到68%。将该序列其命名为青蛤CsCPL, 在Gen Bank的注册号为KJ000064。
所获得的青蛤CsCPL基因的cDNA序列全长1632bp, 5’UTR为74bp, 3’UTR为508bp, 开放阅读框长度为1050bp, 编码349个氨基酸(图1), 理论分子量为38.84kDa, 理论等电点为5.48, 分子式为C1704H2625N465O540S18。氨基酸组成中甘氨酸(Gly)与丝氨酸(Ser)含量最高, 分别占8.9%和8.6%。其N端具有由15个氨基酸组成的信号肽序列MRVLVCLVALVACSV,前体酶原的前体肽含有ERF/WNIN模体(motif)和GNFD模体, 可形成1个α螺旋结构。其酶活性催化域含有4个催化位点(Gln149, Cys155, His294和Asn316), 两条组织蛋白酶L签名序列(E58X3RX3F/WX2NX3IX3N77和G90X1NX1FX1D96)。CsCPL的成熟肽定位于131—349, 预测等电点为4.41, 较前体肽略有下降, 含有7个半胱氨酸残基。
2.2 青蛤CsCPL基因在不同组织内的表达
在鳗弧菌侵染青蛤条件下, 以b-actin在各组织中的表达量为内参对照, 利用实时荧光定量PCR分析了CsCPL基因在青蛤血淋巴、肝脏、外套膜、闭壳肌和鳃等五个组织的表达情况, 结果显示CsCPL基因在青蛤的以上五个组织中普遍性表达(图2), 但表达量存在明显差异, 其中血淋巴中表达含量最高, 显著高于其它组织(<0.05), 外套膜表达次之, 肝脏中含量最低, 表明CsCPL基因主要在血淋巴中表达。
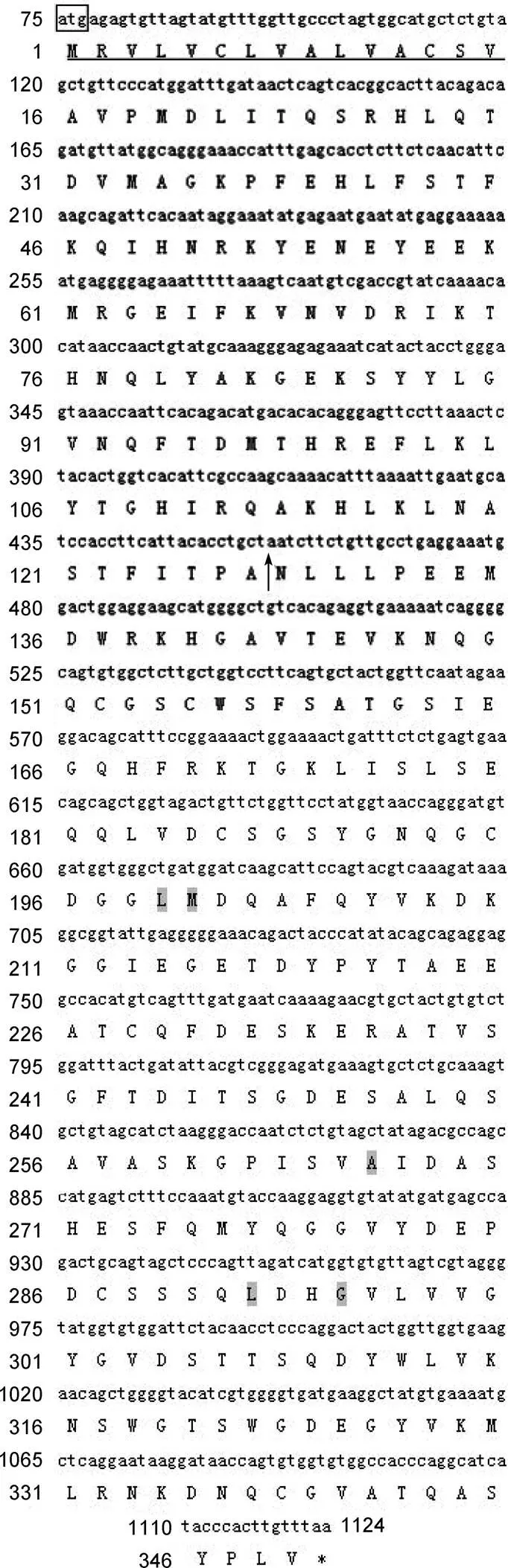
图1 CsCPL基因全长cDNA序列的开放阅读框及结构域分析
方框为起始密码子, * 表示终止密码子, 下划线表示CsCPL信号肽, 箭头表示前体域切点, 阴影部分表示底物结合位点
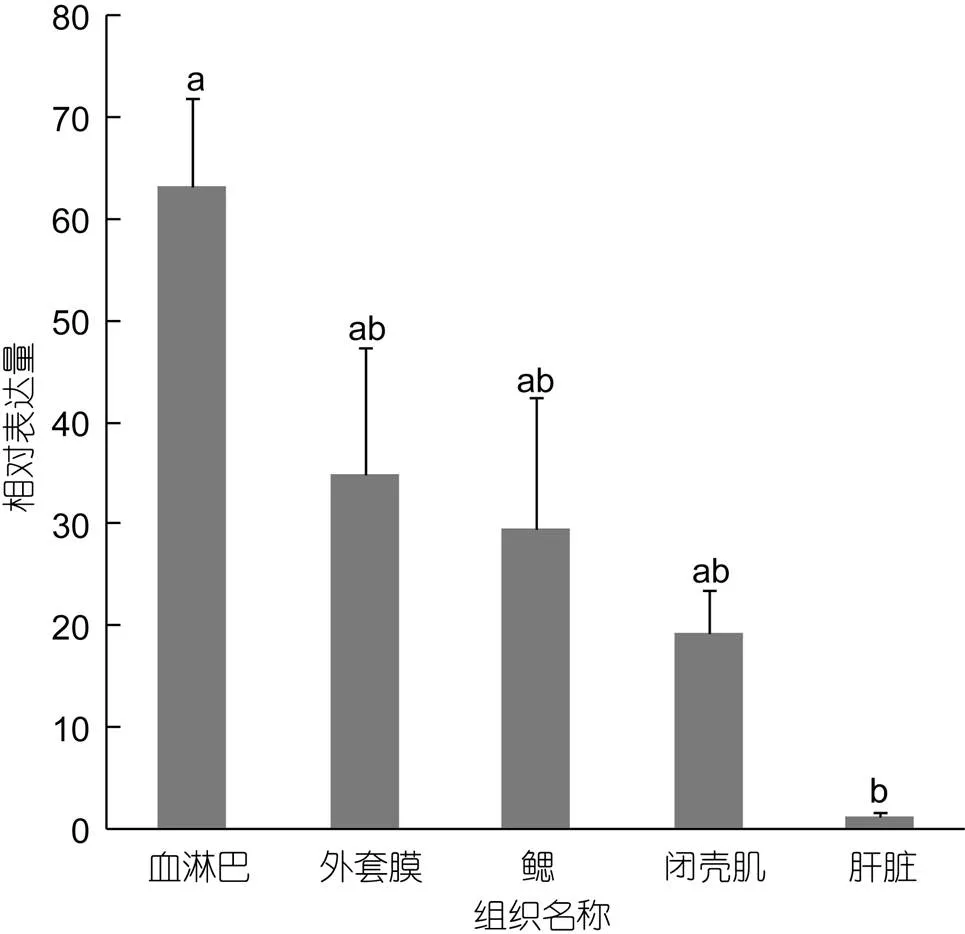
图2 CsCPL基因在青蛤不同组织中的表达情况
2.3 青蛤CsCPL基因在血淋巴中的时序性表达
在鳗弧菌侵染青蛤后, 以b-actin为内参基因, 利用实时荧光定量PCR分析了CsCPL基因在外套膜组织中的表达时序变化(图3)。发现实验组在感染后3h表达量显著升高(<0.05); 并在6h表达量达到最大值, 并且与对照组差异极显著(<0.01), 约为对照组的2.7倍左右; 24h后其表达量有所下降, 但仍显著高于对照组(<0.01); 48—96h基因表达量逐渐降低并恢复至正常水平。而对照组除在6h有显著升高外, 其余时间点均无明显变化。
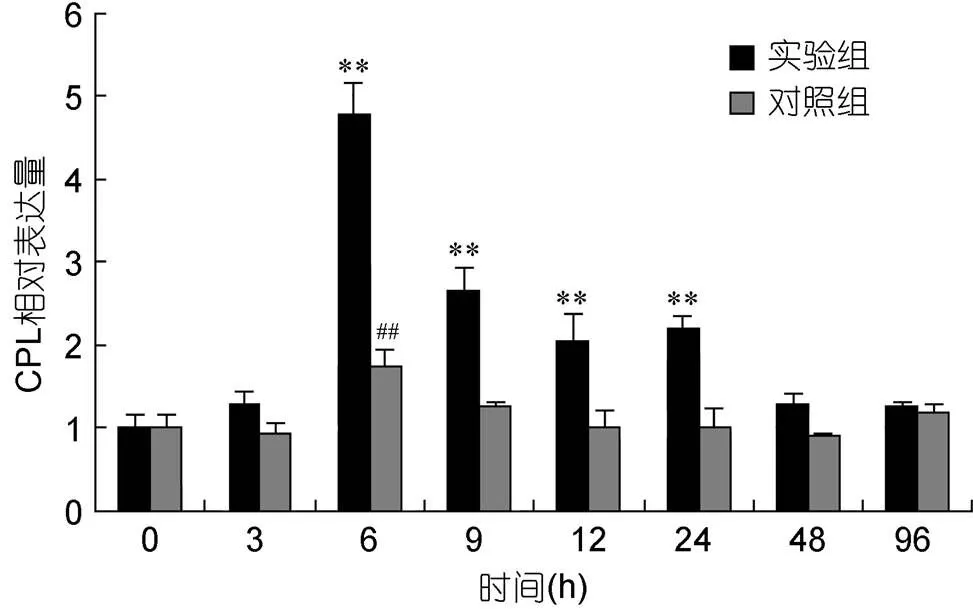
图3 青蛤血淋巴CsCPL基因在鳗弧菌刺激不同时间相对表达量的变化
**表示相同时间点实验组与对照组基因的转录表达水平差异极显著(<0.01); ##表示该时间点对照组基因的转录表达水平与同组注射前(0h)相比差异极显著(<0.01)
2.4 青蛤CsCPL基因的原核表达
CsCPL成熟肽基因PCR扩增, 产物长度约660bp的DNA片段, 与预期大小基本一致。PMD18T-CPL和pET-30a双酶切后, 将目的片段和线性表达质粒经琼脂糖凝胶检测, 切胶回收, 目的片段大小约660bp(图4), 符合预期。将CsCPL目的片段连接至pET-30a线性质粒, 转化培养后, 进行阳性单克隆PCR检测并送测序, 测序结果正确, 重组表达载体构建成功。
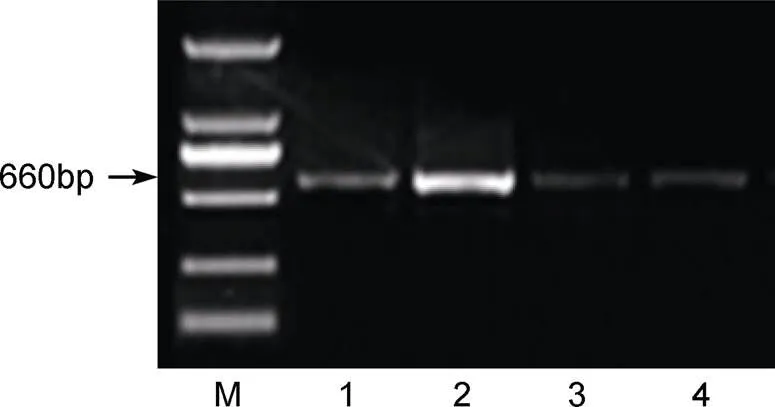
图4 CsCPL重组序列PCR产物凝胶电泳结果
经IPTG诱导表达后, SDS-PAGE电泳检测显示: 诱导后的宿主菌蛋白表达图谱发生了变化, 与未经诱导的对照样品比较, 该工程菌株诱导后的样品在约35kDa处产生了1条明显的特异性电泳带(图5), 其分子量和理论计算值基本吻合。在诱导3h后, 表达量不再增加, 确定最佳诱导时间为3h。
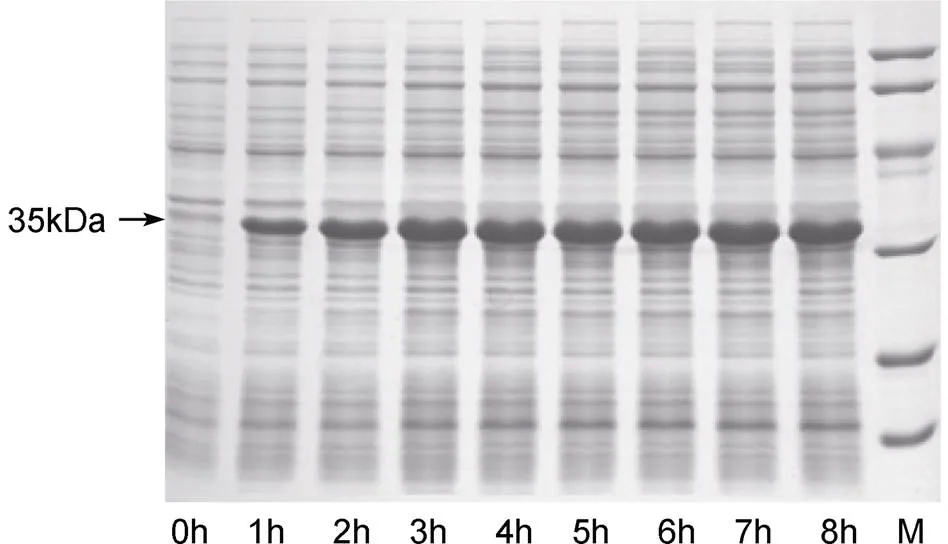
图5 考马斯亮蓝染色检测融合蛋白的诱导表达
2.5 重组蛋白的纯化复性与功能验证
经亲和层析分离纯化后, 将得到的蛋白进行SDS-PAGE凝胶电泳检测, 结果显示(图6), 纯化后的蛋白电泳条带单一, 且分子量在35kDa处, 诱导后宿主菌蛋白图谱中的特异性条带位置一致, 可确定该纯化后的蛋白就是青蛤CsCPL重组蛋白。
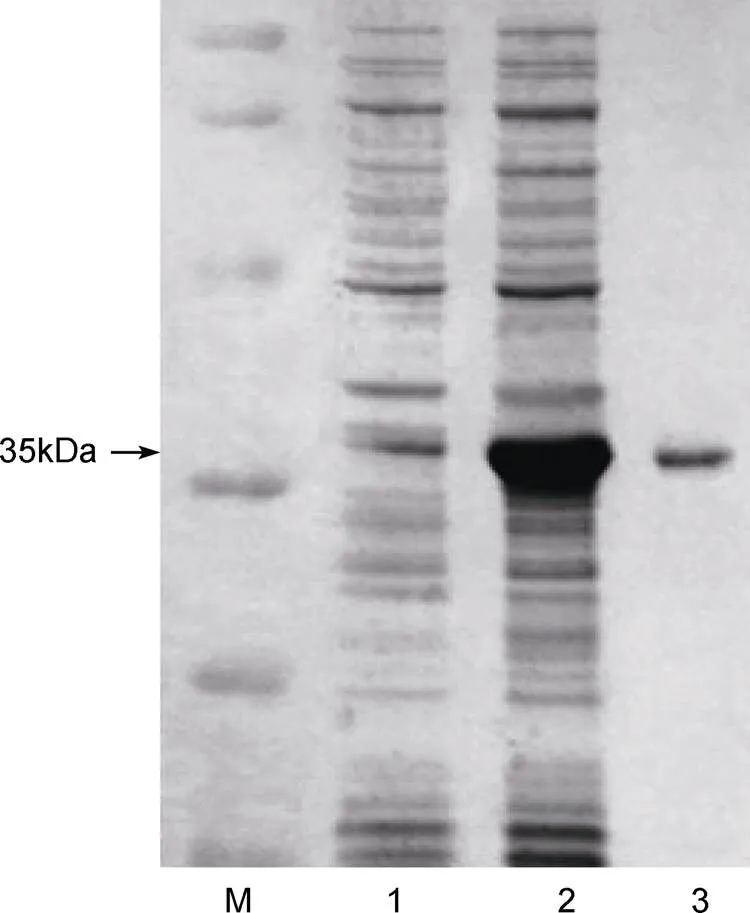
图6 蛋白纯化结果
注: 从左至右M泳道为蛋白Marker, 1泳道为未加IPTG诱导的空白对照, 2泳道为诱导4h在35kDa处出现目的带, 3泳道为纯化后的蛋白
重组蛋白抑菌实验结果显示(图7), 重组蛋白CsCPL组菌生长曲线与阴性对照组(BSA)、空白(TBS)对照组相比趋势明显偏低, 菌群值明显偏低, 说明与两对照组相比, 重组蛋白CsCPL具有明显的抑菌效果。但与阳性对照组(Lysozyme)相比其作用强度较低一些。
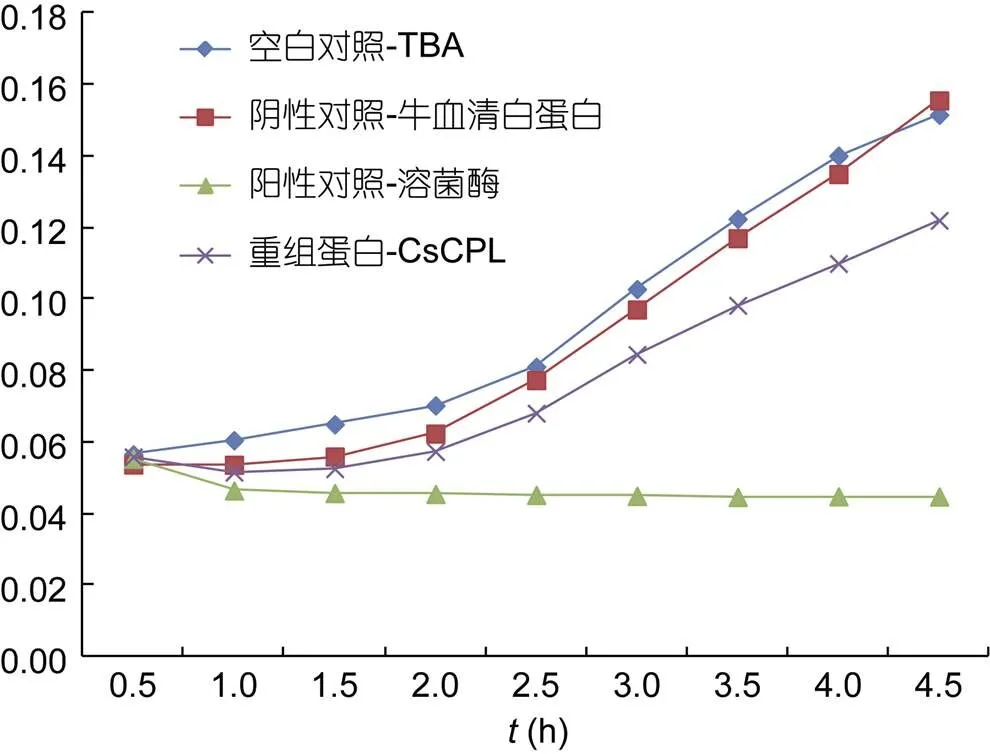
图7 藤黄微球菌在重组蛋白及不同对照环境下的生长曲线
3 讨论
本研究得到了青蛤组织蛋白酶L基因编码区的全长, 经序列比对与分析发现, 该基因序列与许多水生动物的同源序列十分相似, 其结构在进化上相当保守。SDS-PAGE电泳检测结果表明, 青蛤组织蛋白酶L的分子量约为35kDa, 与理论预期值基本吻合, 接近于三角帆蚌(白志毅等, 2011)血细胞组织蛋白酶L(37.7kDa)、海湾扇贝(李娟等, 2011)组织蛋白酶L(41.2kDa)、红鳍东方鲀(梁静真等, 2012)组织蛋白酶L(37.9kDa)、脊尾白虾(段亚飞等, 2013)血细胞组织蛋白酶L(35.3kDa)等近缘物种中的分子量。通过对其蛋白序列的分析, 发现其氨基酸组成中, 甘氨酸与丝氨酸的含量最高。丝氨酸在新陈代谢与免疫因子的产生中发挥着作用, 而甘氨酸可作为水解蛋白的增效剂, 且可在人体中合成丝氨酸。组织蛋白酶(cathepsin)作为一类主要存在于溶酶体的蛋白水解酶, 近年来在无脊椎动物先天免疫调控方面的研究取得了较大进展。它与核糖核酸酶、b-葡萄糖醛酸酶、乙酰基转移酶以及其它的蛋白酶一起参与溶酶体介导的蛋白质的消化及转化过程(Mellman, 1996), 且具有水解多种肌肉相关蛋白的能力, 并参与非caspase介导的细胞凋亡过程(Chwieralski, 2006)。细胞凋亡是免疫调节的中心环节, 各种免疫细胞的代谢过程大多通过细胞凋亡实现(Krammer, 2000)。因此推测, 组织蛋白酶L在对内源与外源抗原的免疫反应中起着重要作用(Söderhäll, 1998)。
本研究结果显示, CsCPL作为一种免疫相关蛋白基因, 在青蛤各组织中的表达差异极其显著, 基本表现为血淋巴>外套膜>鳃>闭壳肌>肝脏。分析其原因可能与CsCPL基因在生物体内的作用有关; 在正常情况下, 约90%的组织蛋白酶以酶原的形式贮存于溶酶体中, 随时准备处理内源与外源性的抗原物质。鉴于双壳类动物属开管式血循环, 血淋巴中存在大量的酶源性物质, 并且作为其非特异性免疫防御的重要组织区域, 相比其它组织能够更为迅速地上调CsCPL基因的表达水平。另外, 双壳类在其滤食和呼吸时, 外套膜与鳃首先与海水接触, 是其非特异性免疫的第一道防线, 具有重要的组织免疫防御作用(刘欣欣等, 2013)。
本研究中还发现, 在鳗弧菌侵染的青蛤血淋巴中的CsCPL基因表达量在6h达到最大值, 约为对照组的2.7倍, 与其它文献如中华绒螯蟹(Li, 2010)和脊尾白虾(段亚飞等, 2013)等报道的结果非常近似, 说明鳗弧菌侵染对CsCPL基因具有强烈的诱导作用。当青蛤受到该病原物侵袭时, 其免疫因子的相关基因启动, 机体合成大量抗菌物质。在刺激后的12—24h, CsCPL表达量下降, 可能意味着机体处于感染后的恢复期(Sun, 2010), 类似情况也见于上述文献中的研究结果。
本研究采用pET-30a作为表达载体系统, 构建了pET30α(+)-CPL重组质粒, 通过一个6×His标签和T7启动子来控制表达的严谨性。His标签可与金属螯合层析介质特异性吸附, 从而实现融合蛋白的分离与纯化。由于His标签较小, 一般不会影响目的蛋白的理化特征和生物学活性。本实验获得的融合蛋白大小在35kDa处左右, 与CsCPL分子量理论值38.84kDa基本吻合。另外, 本研究中的重组蛋白CsCPL组菌生长曲线与BSA、TBS对照组相比有明显的抑菌作用, 但其作用效力不如溶菌酶Lysozyme显著。推测原因可能是Lysozyme可溶解细菌细胞壁中的黏多糖而使使菌体直接降解, 而组织蛋白酶则通过参与细胞内酶原激活完成间接抗菌作用, 故其对菌体生长的抑制不如Lysozyme作用强烈。
白志毅, 汪桂玲, 李家乐, 2011. 三角帆蚌组织蛋白酶L基因的克隆和序列特征与进化分析. 生物技术通报, (6): 104—111
孙国铭, 万夕和, 刘培庭等, 2004. 通州海区滩涂青蛤死亡原因的初步分析. 水产养殖, 25(2): 26—27
李 娟, 李 莉, 张国范, 2011. 海湾扇贝组织蛋白酶L基因编码区的克隆和分析. 海洋通报, 30(3): 338—343
杨东辉, 刘 宇, 肖 蓉等, 2012. 组织蛋白酶L的结构与功能. 中国生物化学与分子生物学报, 28(12): 1093—1099
张朝霞, 王 军, 丁少雄等, 2006. 贝类免疫学研究新进展. 厦门大学学报(自然科学版), 45(2): 90—96
段亚飞, 刘 萍, 李吉涛等, 2013. 脊尾白虾组织蛋白酶L基因的克隆及其表达分析. 动物学研究, 34(1): 39—46
顾润润, 于业绍, 蔡友琼, 2006. 青蛤的营养成分分析与评价. 动物学杂志, 41(3): 70—74
曹 华, 2004. 沿海滩涂青蛤死亡原因初探及对策. 科学养鱼, (4): 47—48
梁静真, 饶颖竹, 陈 蓉等, 2012. 红鳍东方鲀组织蛋白酶L基因的电子克隆及序列分析. 南方农业学报, 43(10): 1569—1574
Aranishi F, Ogata H, Hara K, 1997. Purification and characterization of Cathepsin L from hepatopancreas of carp. Comp Biochem Physiol, 118B(3): 532—537
Bu X J, Zhang X W, Sun Y D, 2008. Recombinant expression and tissue distribution of cathepsin L from Chinese shrimp. Fish Sci Chin, 15(6): 910—916
Chwieralski C E, Welte T, Buhling F, 2006. Cathepsin-regulated apoptosis. Apoptosis, 11(2): 143—149
Kirschke H, Barrett A J, 1987. Chemistry of Lysosomal Proteases. Lysosomes: Their Role in Protein Breakdown. Academic Press, 193—238
Krammer P H, 2000. CD95's deadly mission in the immune system. Nature, 407(6805): 789—795
Lecaille F, Kaleta J, Brömme D, 2002. Human and parasitic papain-like cysteine proteases: their role in physiology and pathology and recent developments in inhibitor design. Chemical Reviews, 102(12): 4459—4488
Lee J J, Chen H C, Jiang S T, 1993. Purification and characterization of proteinases identified as Cathepsins L and L-like (58kDa) proteinase from mackerel. Biosci Biotech Biochem, 57(9): 1470—1476
Li W W, Jin X K, He L, 2010. Molecular cloning, characterization, expression and activity analysis of cathepsin L in Chinese mitten crab,. Fish Shellfish Immunol, 29(6): 1010—1018
Liu L Q, Warner A H, 2006. Further characterization of the cathepsin L-associated protein and its gene in two species of the brine shrimp, Artemia. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 145(4): 458—467
Ma J, Zhang D, Jiang J, 2010. Molecular characterization and expression analysis of cathepsin L1 cysteine protease from pearl oyster. Fish & Shellfish Immunology, 29(3): 501—507
Mellman I, 1996. Endocytosis and molecular sorting. Annual Review of Cell and Developmental Biology, 12: 575—625
Söderhäll K, Cerenius L, 1998. Role of the prophenoloxidase- activating system in invertebrate immunity. Current Opinion in Immunology, 10(1): 23—28
Sun J, Wang B J, Li X H, 2010. The full length cDNA cloning and expression profile of prophenoloxidase of. J Fisher Chn, 34(1): 56—66
Venier P, De Pittà C, Pallavicini A, 2006. Development of mussel mRNA profiling: can gene expression trends reveal coastal water pollution. Mutat Res, 602(1—2): 121—134
Visessanguan W, Benjakul S, An H, 2003. Purification and characterization of Cathepsin L in arrowtooth flounder () muscle. Comp Biochem Physiol, 134B: 477—487
Yamashita M, Konagaya S, 1990. Purification and characterization of Cathepsin L from the white muscle of chum salmon,. Comp Biochem Physiol, 96B(2): 247—252
Zeng G Z, Tan N H, Jia R R, 2005. Cathepsins: structures, functions and inhibitors. Acta Bot Yunnanica, 27(4): 337—354
Zhao Z Y, Yin Z X, Wang S P, 2007. Profiling of differentially expressed genes in hepatopancreas of white spot syndrome virus-resistant shrimp () by suppression subtractive hybridisation. Fish Shellfish Immunol, 22(5): 520—534
ANALYSIS OF EXPRESSION AND RECOMBINANT PROTEINS ACTIVITIES OF CATHEPSIN L GENE FROM
LIU Shi-Meng, ZHAO Ting, ZHANG Hao, PAN Bao-Ping
(College of Life Sciences, Tianjin Key Laboratory of Animal and Plant Resistance, Tianjin Normal University, Tianjin 300387, China)
Measure the expression of Cathepsin L gene (CsCPL) between organizations instimulated byand time-dependent expression in hemolymph with RT-PCR method. The results showed that, CsCPL gene expresses abundantly in hemolymph, liver, mantle, gills and adductor muscle and other tissues in, with the highest expression level in hemolymph. The expression of CsCPL in hemolymph appeared a large number of increasement in 3—96 hours afterstimulation, and at 6 hours reach to maximum which was very significant different (<0.01) with the control group, indicating that CsCPL gene plays an important role in the immune response in. Experiments also carried on the CsCPL genetic prokaryotic expression, and got recombinant protein about 35 kDa molecular weight, which has an obvious bacteriostatic action after purification and renaturation.
; cathepsin L; Realtime PCR; bacteriostatic test
10.11693/hyhz20140100009
* 天津市科委应用基础与前沿技术重点项目资助, 12JCZDJC22800号, 09JCZDJC19300号; 刘诗萌, E-mail: 934402617@qq.com
潘宝平, 博士, 教授, E-mail: p.baoping@gmail.com
2012-04-25,
2012-07-19
Q789
