一种印度产紫菜(Pyropia radi)的生物学特性与部分生活史*
2014-04-16张岩岩严兴洪
张岩岩 严兴洪
一种印度产紫菜()的生物学特性与部分生活史*
张岩岩 严兴洪①
(上海海洋大学水产与生命学院 上海 201306)
为积累紫菜的新种质, 本文对一种印度产紫菜—的生活史进行了研究, 结果发现: 该紫菜的叶状体多为披针形, 基部为楔形、呈褐绿色, 梢部呈红紫褐色; 藻体由单层细胞构成, 极少含两层细胞; 一个营养细胞中含1—2个星状色素体, 多数只含一个; 藻体的中部边缘具有稀疏的锯齿状突起, 基部的齿状突起较密, 一般的突起含有一至十多个细胞; 成熟前的藻体厚度: 基部为(51.5±4.23)µm, 梢部为(29.4±2.31)µm, 平均厚度41.2µm, 成熟后的藻体逐渐加厚; 成熟前的藻体长度5—10cm、宽度0.5—1cm, 成熟后, 藻体长度可达(45±8.7)cm、宽度为(5±1.21)cm; 藻体的表观性别多数为雌雄异体, 少数为雌雄同体, 雌雄同体的个体其雌雄生殖细胞分别呈块状直线型分布于藻体; 果孢子囊具有16或32个果孢子, 分裂式为♀A2B2C4或♀A4B2C4, 成熟的精子囊器具有64个精子囊, 分裂式为♂A4B4C4; 叶状体营养细胞和精子囊的核型为单倍, 染色体数目为5个(=5), 丝状体的营养细胞和膨大细胞的核型为双倍, 染色体数目为10个(2=10)。检测该紫菜的5.8S rDNA-ITS区序列发现, 其5.8S保守区的160个碱基序列与坛紫菜相似度为100%。该紫菜的形态结构、染色体数目、性别以及5.8S rDNA的保守序列等结果与坛紫菜极为相似, 暗示它与坛紫菜的亲缘关系很近, 但它们是否为同一个紫菜物种还有待深入研究。
紫菜(), 生活史, 丝状体, 叶状体, 染色体
紫菜属()(Sutherland, 2011)在系统分类学上隶属红藻门(Rhodophyta), 原红藻纲(Protoflorideae), 红毛菜目(Bangiales), 红毛菜科(Bangiaceae), 广泛分布在寒温带的潮间带和潮下带水域(Yoshida, 1997)。紫菜富含蛋白质、维生素、矿物质和食用纤维, 其中, 蛋白质的含量为14.9%—56.1%, 维生素C含量高于橙子(Noda, 1975), 因此被人类食用的历史很长。此外, 紫菜还含有大约17种游离氨基酸, 其中的牛磺酸具有调控人体血液中胆固醇含量的作用, 具有较高的营养和药用价值(Sahoo, 2006), 年产值超过18亿美元(Yarish, 1999)。紫菜属重要的商业价值依赖于不断将新品种和新的培养技术用于栽培生产(Pereira, 2010)。
至今, 全球发现的紫菜种已超过133种(Yoshida, 1997), 但自二十世纪中叶开始, 紫菜生活史的研究主要集中于温带种的生活史, 很少涉及亚热带和热带的紫菜种(López-Vivas, 2011)。1881年, Murray首次报道了生长在印度半岛海域的紫菜种, 随后, 在印度海域陆续发现了其它8个紫菜种, 对印度紫菜的分类学作了初步研究, 但对它们的生活史和相关应用性研究涉及较少(Kumar, 1997, 2005)。
紫菜传统分类的主要鉴定依据是藻体的形态结构, 包括外形、长度、宽度、厚度、颜色、生殖方式、生殖细胞的分布和分裂式等(张德瑞等, 1960; 曾呈奎等, 1978; 王素娟等, 1980; 郑宝福, 1981, 1988; 潘国瑛等, 1982; 章景荣等, 1993)。但是, 单凭藻体的形态与结构特征, 许多紫菜物种往往难以被正确鉴定, 于是, 藻类学家对紫菜的染色体数目等细胞学特征进行了研究(戴继勋, 1999)。近年来, 随着分子生物学的快速发展, DNA分子标记也逐渐被用于紫菜的系统分类、亲缘关系的鉴定以及分子辅助育种(汤晓荣等, 2006)。赵玲敏等(2009)认为5.8S rDNA-ITS区的高度保守区和高变区交替排列的形式可以作为坛紫菜种质鉴定以及系统进化分析。
本文从藻体大小、形态、繁殖类型、边缘刺特征、生殖结构等方面对产自印度的一种紫菜—的生活史进行了详细研究, 旨在积累新的紫菜种质。
1 材料与方法
1.1 紫菜来源与保存
采自印度半岛, 其自由丝状体由印度藻类学家(Reddy博士)赠送, 并以自由丝状体的形式被保存于实验室内, 保存条件: 温度为18°C, 光密度为5µmol photons/(m2·s), 光周期为14L:10D。
1.2 丝状体和叶状体的培养与观察
取适量的自由丝状体, 加入一定量的MES培养液(王素娟等, 1986), 用粉碎机切碎后, 制成丝状体接种液, 将其均匀喷洒于平铺的贝壳表面, 暗光培养4d后, 在温度24±1°C、光密度20µmol photons/(m2·s)、光周期10L : 14D的条件下培养10d, 清洗一次贝壳以除去表面多余的自由丝状体, 换入培养液并继续培养。当整个贝壳内表面长满丝状体, 使颜色变红后, 把培养温度提高到28±1°C, 光密度降到10µmol photons/(m2·s), 光周期缩短至8L : 16D, 培养液改用含N : P=1 : 10的灭菌海水。待贝壳表面长出大量膨大藻丝时, 取3个贝壳, 分别放入含100mL培养液和3—5根棉线(长约5cm)的烧杯(250mL)中充气刺激。当棉线上附着一定量的壳孢子后, 将它们转移至培养瓶(250mL)中进行充气培养, 培养温度为24±1°C、光密度60—80µmol photons/(m2·s)、光周期为10L : 14D。每5天更换一次培养液, 当壳孢子萌发体的长度达3—5cm, 将它们从棉线上摘下, 继续充气培养直至成熟。
丝状体的形态和膨大细胞、叶状体的边缘刺等显微结构用显微镜(Nikon Eclipse 90i)观察与拍照。
藻体厚度的测定: 随机取培养30d的叶状体, 用冰冻切片机(Frigocut 2700, Reichert Jung, LEICA公司)分别对梢、中、基部进行横切, 取完整切片在显微镜下用NIS-Elements软件分别测量各部位的厚度。每个部位测量30个样品, 取其平均值。
1.3 染色体观察
1.3.1 材料固定 取一定量生长旺盛的丝状体在暗周期开始后3h内, 每隔30min用卡诺固定液(无水乙醇 : 冰乙酸=3 : 1)固定一次材料, 在光亮处放置数日, 使藻体的颜色褪至无色, 以备观察。
1.3.2 材料的染色与观察 用镊子取少量褪色为无色的丝状体, 在蒸馏水中软化数秒钟后, 置于载玻片上, 滴加醋酸铁苏木精染色液(Wittmann, 1965), 染色约5min后, 在酒精灯火焰上稍微加热以软化材料, 然后轻轻压片, 用吸水纸吸去多余的染色液, 在显微镜下观察。
叶状体营养细胞、成熟精子囊以及膨大藻丝的固定方法同丝状体, 其中用于观察叶状体营养细胞和精子囊染色体的藻体在固定前需要先切成小块, 便于后期压片、观察和拍照。
1.4 5.8S rDNA-ITS区片段的序列检测
随机选择日龄30d的叶状体, 提取DNA(用新型植物基因组提取试剂盒, TIANGEN, 北京), 操作步骤同说明书, 根据NCBI上已报道的坛紫菜5.8S rDNA-ITS区的保守序列设计引物, 扩增包含160bp的5.8S保守区域。上、下游引物分别为: 5′-TTTGTCTTATCCGCTTTGT-3′、5′-TTCATCTGGTATGCCTCCTA-3′。20µL的PCR反应体系中含10× buffer 2µL, DNA模板50ng, 0.2mmol/L dNTP, 0.5µmol/L引物, 1UDNA聚合酶。PCR扩增程序为: 94°C变性5min, 94°C变性45s, 54°C退火30s, 72°C延伸60s, 共进行30个循环, 最后72°C延伸10min。扩增产物由上海美吉生物公司测序, 所得序列通过DNAMAN软件与NCBI服务器上已发表的(FJ490524)、(JQ416151)、var(AY766366)和(AY766365)的5.8S保守区进行多重序列比对, 检测它们的序列同源性。
2 结果
2.1 丝状体和叶状体的生物学特征
2.1.1 丝状体的形态学特征 自由丝状体的颜色为红紫色(图版Ⅰ1), 当贝壳表面长满丝状体时, 其颜色呈红紫褐色(图版Ⅰ2), 在24—30°C范围内均可发育成膨大藻丝(图版Ⅰ3)。在此发育过程中, 丝状体的营养细胞逐渐由细长型变短变粗, 发育成为不定型细胞, 继续发育成为体积较大的细胞, 形成了膨大藻丝, 当它们成熟时就发育成壳孢子囊枝。在适宜的光照和温度条件下, 壳孢子囊枝经流水刺激后放散出大量的壳孢子, 并迅速萌发(图版Ⅰ4), 逐渐长成叶状体(图版Ⅰ5)。
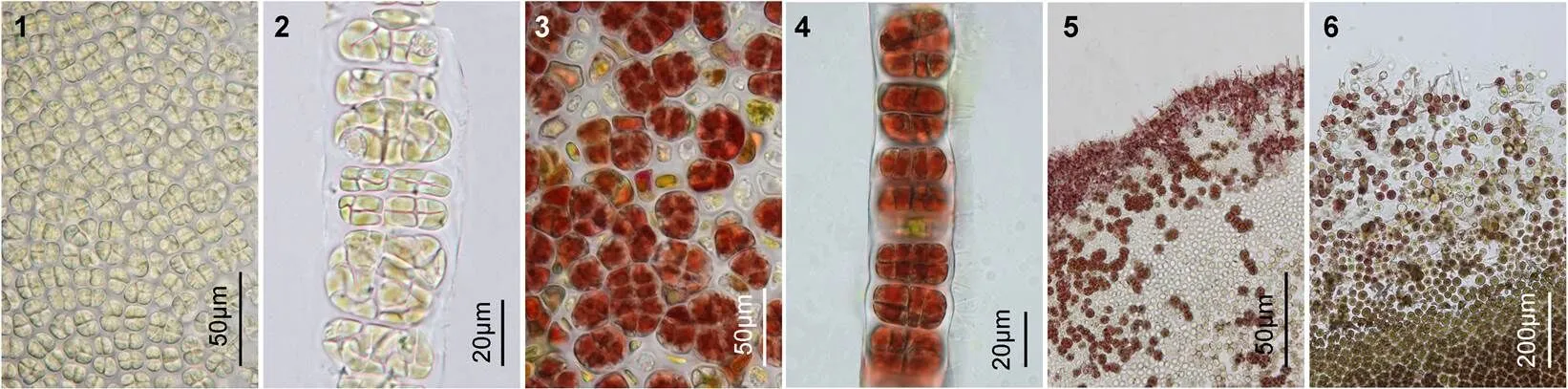
2.1.2 叶状体的形态学特征 藻体呈披针形, 基部为楔形, 基部的根丝细胞圆头状, 每个细胞有一个向下延伸的假根丝(图版Ⅲ9), 构成假根, 叶状体的梢部较尖(图版Ⅰ5)。叶状体的梢部边缘一般较为平滑, 但中部边缘存在稀疏的锯齿状突起, 基部边缘的齿状突起更密(图版Ⅲ1—3), 齿状突起的细胞数为一至十多个, 在日龄较大的叶状体基部边缘还可见到齿状突起上又长出细密的次级刺状突起。藻体一般含单层细胞, 局部含两层细胞(图版Ⅲ7)。营养细胞内具有一个明显的星状色素体, 少数细胞含有两个色素体(图版Ⅲ8)。从梢部到基部, 藻体的厚度逐渐增加, 梢部厚度为(29.4±2.31)µm, 基部为(51.5±4.23)µm, 藻体的梢部、中部和基部三处的厚度平均值为41.2µm。成熟后, 藻体变得更厚。
成熟前的叶状体体长为5—10cm, 体宽为0.5—1cm。培养至35—40d, 叶状体开始成熟, 在成熟的早期, 大多数个体的性别为雌雄异体(图版Ⅰ6a), 极少数为雌雄同体, 雌雄生殖细胞分别呈块状直线型分布于藻体(图版Ⅰ6b)。雄性个体成熟时形成的精子囊区, 其颜色变成淡黄绿色(图版Ⅱ1), 成熟的单个精子囊器含64个精子囊, 分裂式为♂A4B4C4(图版Ⅱ2), 成熟后过几天就可观察到成熟部位的边缘放散出大量的精子。雌性个体成熟时, 原来的体细胞颜色变淡, 星状色素体变得不明显, 细胞由多角形逐渐变圆, 发育成果胞, 未受精的果胞颜色逐渐变浅甚至变白死亡, 受精后的果胞发育成红紫色的果孢子囊, 果孢子囊内含有16或32个果孢子, 分裂式为♀A2B2C4或♀A4B2C4(图版Ⅱ3—4)。部分果孢子在藻体边缘直接发育成丝状体, 但大部分脱离后再萌发成丝状体(图版Ⅱ5)。雌雄个体充分成熟的梢部和边缘便开始脱落, 其他未成熟的藻体继续生长, 当培养至90d, 藻体长度可达(45±8.7)cm, 宽度达(5±1.21)cm。
2.1.3 繁殖方式 大多数叶状体通过有性生殖即精子与果胞受精后, 发育成果孢子囊, 后者产生的果孢子再萌发成丝状体, 丝状体成熟后再释放壳孢子萌发成叶状体, 完成生活史。但在单株培养雌性叶状体时发现, 雌性叶状体未经受精, 梢部的正常营养细胞逐渐退色, 由褐红色变成褐绿色, 随后细胞间隙增大, 藻胶层和细胞壁融化, 细胞以原生质体形式流出, 流出后的细胞迅速变圆并逐渐再生出细胞壁, 细胞中色素体颜色也逐渐变红, 数小时后, 这些游离出来的细胞陆续萌发成丝状体(图版Ⅱ6), 后者产生的壳孢子也可以萌发成叶状体, 而且叶状体全部为雌性的, 该种生殖方式被认为是紫菜的单性生殖(严兴洪等, 2007)。
2.2 染色体数目的观察结果
熄灯后约2—3h所固定的材料, 其染色体的观察效果较好, 可看到较清晰的中期染色体。丝状体的营养细胞和膨大细胞的染色体数为10个, 是双倍的(2=10)(图版Ⅳ1—2), 而叶状体的营养细胞和精子囊细胞的染色体数目均为5个, 是单倍的(=5)(图版Ⅳ3—4)。在显微镜下对1308个精子囊细胞的染色体数目进行了统计, 其中含5条染色体的细胞数占58.9%, 部分处于分裂后期, 未完全分裂成两个细胞时可以看到10条染色体, 所占比例为28.3%。出现其他条数的原因可能是在压片过程中的挤压导致染色体丢失、堆叠, 或计数的误差。
2.3 叶状体的5.8S rDNA-ITS区片段的序列分析结果
经PCR扩增, 在4个和3个坛紫菜的叶状体中均扩增出一条大小均一的DNA 片段, 约500bp(图1), 与引物设计的目标片段大小一致。
测序结果表明, 扩增片段总长度为477bp, 包含三个部分: ITS1区和ITS2区的部分序列及5.8S区的完整序列。5.8S区片段长度为160bp, 两端分别有一段polyA和polyT序列。将其与NCBI上已公布的采自不同地区的坛紫菜5.8S保守区序列比对, 发现序列完全一致(图2), 相似度达到100%, 与、var的5.8S区序列比对, 结果显示同相似度为95%, 与var和相似度均仅为91%(图3)。
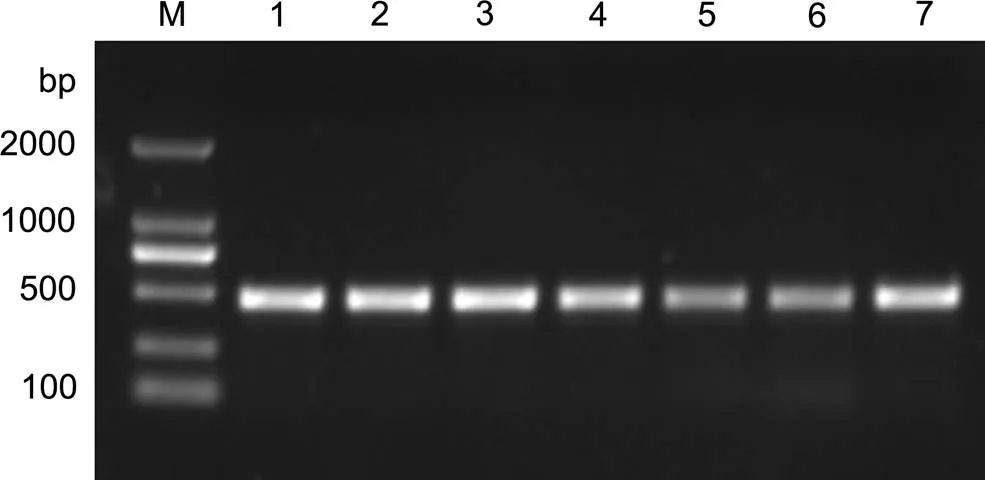
图1 Pyropia radi和坛紫菜的ITS1-5.8S-ITS2区的PCR扩增产物电泳图
M: Marker; 泳道1—4:; 泳道5—7: 坛紫菜

图2 Pyropia radi叶状体的5.8S rDNA-ITS区测序结果
下划线部分为上下游引物序列, 阴影部分为5.8S区保守序列
3 讨论
紫菜的生活史如图4所示, 该种紫菜可以通过有性生殖完成生活史过程, 也可以通过单性生殖完成生活史, 但是在整个培养过程中, 叶状体阶段未观察到叶状体直接释放单孢子发育成叶状体的过程, 即该种紫菜不具有无性生殖行为。

图3 几种紫菜5.8S 区的序列比对结果
与坛紫菜之间存在许多相似之处: 藻体的颜色呈暗绿略带褐红色, 基部较绿, 梢部较红; 藻体的外形多呈披针形, 大部分由单层细胞构成, 部分为两层; 细胞内含星状色素体一个或两个; 藻体边缘从基部到头部, 齿状突起由密集逐渐变得稀疏, 突起的细胞数由十几个逐渐减少至1—2个; 营养细胞和精子囊细胞的染色体数目均为5条(=5), 而丝状体细胞的染色体均为10条(2=10), 这与坛紫菜(严兴洪等, 2008)相同; 两种紫菜的叶状体性别也基本一致, 即表观性别在叶状体的成熟早期以雌雄异体为主, 少数为雌雄同体, 随着叶状体进入成熟后期, 雌雄同体的比例增加; 两种紫菜均可以通过有性生殖产生丝状体, 也可由叶状体的单性生殖产生可育的丝状体(严兴洪等, 2007)。果孢子囊内的果孢子数目和坛紫菜一样, 均为16或32个。此外,与坛紫菜相比, 无论是叶状体还是丝状体, 其生长发育的适宜生态条件如温度, 光周期等均非常相似。
与坛紫菜之间也存在不同之处:在成熟前的藻体较小, 成熟后藻体大于坛紫菜。一般藻体成熟前的的体长为5—10cm, 而坛紫菜的体长为12—18cm; 成熟后的藻体会继续生长, 虽然两者都存在成熟部分的掉落, 但的未成熟的中基部生长速度快于坛紫菜, 藻体的体长大于坛紫菜, 培养90d,的体长为45cm左右, 而坛紫菜为28cm左右;的藻体比坛紫菜更薄,叶状体中部厚度一般为27—37μm, 坛紫菜则为65—95μm(张德瑞等, 1960);藻体的成熟结构也存在一些差异,的精子囊数目少于坛紫菜,成熟的精子囊器只含有64个精子囊, 分裂式为♂A4B4C4, 而成熟的坛紫菜精子囊器含有128或256个精子囊, 分裂式为♂A4B4C8或♂A4B4C16。上述差异是实验观察误差还是两者真实存在的差异还有待进一步验证。
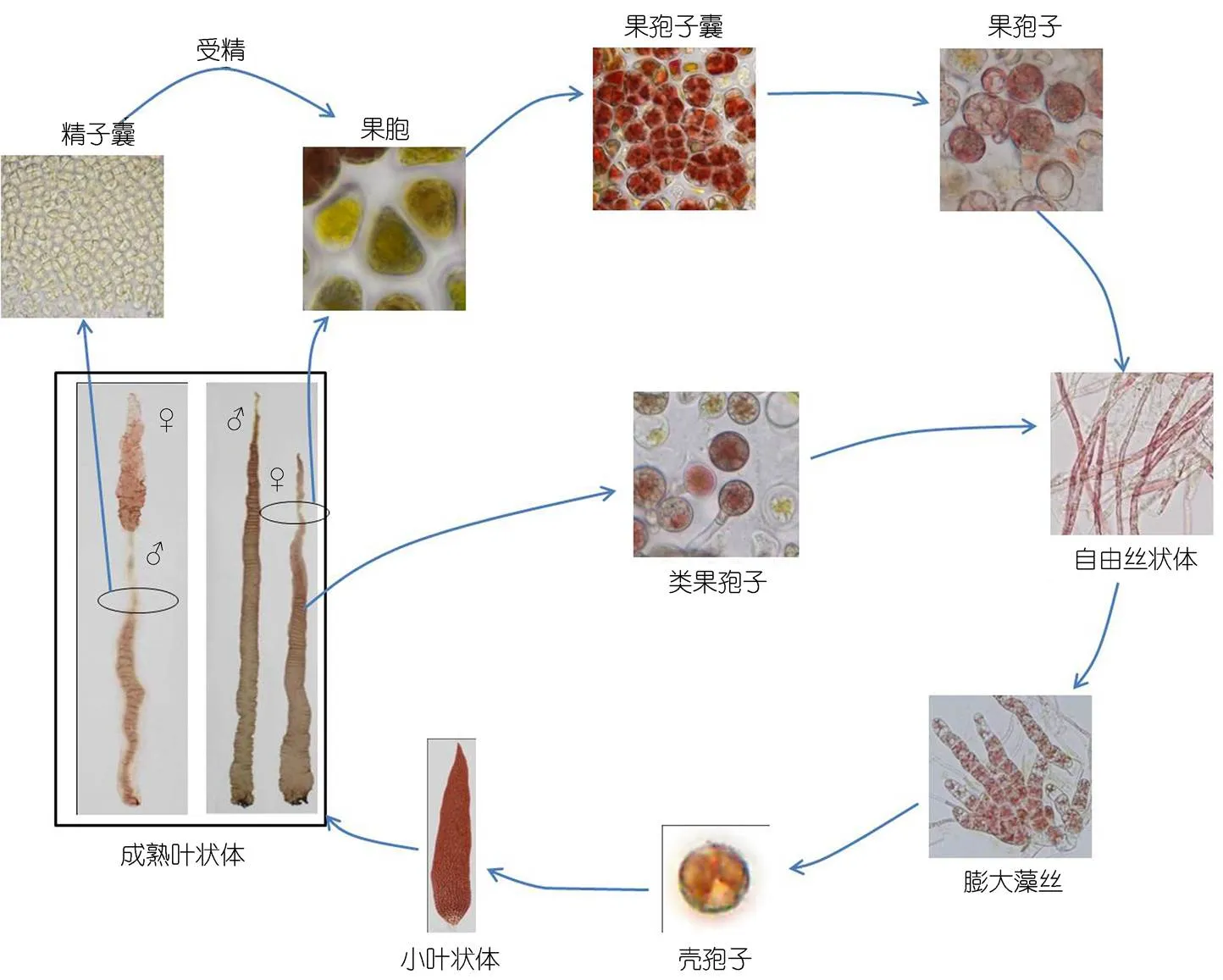
图4 Pyropia radi的部分生活史示意图
赵玲敏等(2009)对10个种质材料的野生坛紫菜5.8S rDNA-ITS区进行PCR扩增和测序, 结果表明它们的5.8S区序列完全一致, 但与其他紫菜种的5.8S区序列有很大差异, 序列同源性在79.7%—95%之间。因此5.8S rDNA-ITS区的高度保守区和高变区交替排列的形式可以作为坛紫菜种质鉴定及系统进化分析的强有力工具。从扩增出的5.8S区序列与NCBI上已公布的采自不同地区的20个坛紫菜5.8S区序列相似度达到100%, 这表明在进化上与坛紫菜的亲缘关系很近。但在本研究中, 比对的序列有限, 不能全面反应出与坛紫菜是否属于同一个种。
从地理位置来讲,与坛紫菜相隔很远, 但两者的生物学、细胞学和分子生物学的诸多特征极为一致, 搞清楚两者到底是否属于同一个紫菜物种具有一定的学术价值。
王素娟, 张小平, 徐志东等, 1986. 坛紫菜营养细胞和原生质体培养的研究Ⅰ. 海洋与湖沼, 17(3): 217—221
王素娟, 章景荣, 1980. 紫菜一新种——单孢紫菜的研究. 海洋与湖沼, 11(2): 141—152
汤晓荣, 潘光华, 许东海, 2006. 紫菜分子遗传学研究进展. 中国海洋大学学报, 36(5): 687—692
严兴洪, 李琳, 陈俊华等, 2007. 坛紫菜的单性生殖与遗传纯系分离. 高技术通讯, 17(2): 205—210
严兴洪, 何亮华, 黄健等, 2008. 坛紫菜的细胞学观察. 水产学报, 32(1): 131—137
张德瑞, 郑宝福, 1960. 福建紫菜一新种: 坛紫菜. 植物学报, 9(1): 32—36
郑宝福, 1981. 紫菜一新种——少精紫菜. 海洋与湖沼, 12(5): 447—453
郑宝福, 1988. 新种紫菜——青岛紫菜的描述. 海洋与湖沼, 19(5): 419—424
赵玲敏, 谢潮添, 陈昌生等, 2009. 5.8S rDNA-ITS区片段的序列分析在坛紫菜种质鉴定中的应用. 水产学报, 33(6): 940—948
章景荣, 王素娟, 1993. 紫菜一新种——福建紫菜的研究. 海洋与湖沼, 24(4): 356—359
曾呈奎, 张德瑞, 1978. 中国两种新紫菜. 海洋与湖沼, 9(1): 76—83
潘国瑛, 王永川, 1982. 我国紫菜属一新种——多枝紫菜. 海洋与湖沼, 13(6): 543—548
戴继勋, 沈颂东, 1999. 紫菜的细胞遗传学研究现状及展望. 青岛海洋大学学报, 29(4): 637—642
Kumar C A, Rao P S N, 2005. A new species of(Rhodophyta, Bangiales) from the Malvan coast of Maharashtra (India). Feddes Repertorium, 116(3—4): 222— 225
Kumar C A, Panikkar M V N, 1997. Indian species of(Rhodophyceae, Bangiales). Feddes Repertorium, 108(5—6): 419—423
López-Vivas J M, Pacheco-Ruiz I, Riosmena-Rodríguez R, 2011. Life history ofDawson (Bangiales, Rhodophyta) from the Gulf of California, México., 50(5): 520—529
Murray J A, 1881. Plants and Drugs Sind. Cambridge University Press, London, UK: 219
Noda H, Horiguchi Y, 1975. Studies on the flavor substances of “Nori”, the dried laver, 1. Dimethyl sulfide and dimethyl-β-propiothetin. Bulletin of the Japanese Society of Scientific Fisheries, 41(4): 481—486
Pereira R, Yarish C, 2010. The role ofin sustainable culture systems: physiology and applications. In:. Celluar Origin, Life in Extreme Habits and Astrobiology, 15: 339—354
Sahoo D, Baweja P, Kushwah N, 2006. Developmental studies in: A high-temperature resistant species from the Indian Coast. Journal of Applied Phycology, 18(3—5): 279—286
Sutherland J E, Lindstrom S C, Nelson WA, 2011. A new look at an ancient order: Generic revision of the Bangiales (Rhodophyta). Journal of Phycology,47(5): 1131—1151
Wittmann W, 1965. Acto-iron-heamatoxylin-chloral hydrate for chromosome staining. Stain Technology, 40: 161—164
Yarish C, Chopin T, Wilkes R, 1999. Domestication of nori for Northeast America: the Asian experience. Bulletin of the Aquaculture Association of Canada, (1): 11—17
Yoshida T, Notoya M, Kikuchi N, 1997. Catalogue of species ofin the world, with special reference to the type locality and bibliography. National History Research Special Issue, 3: 5—18
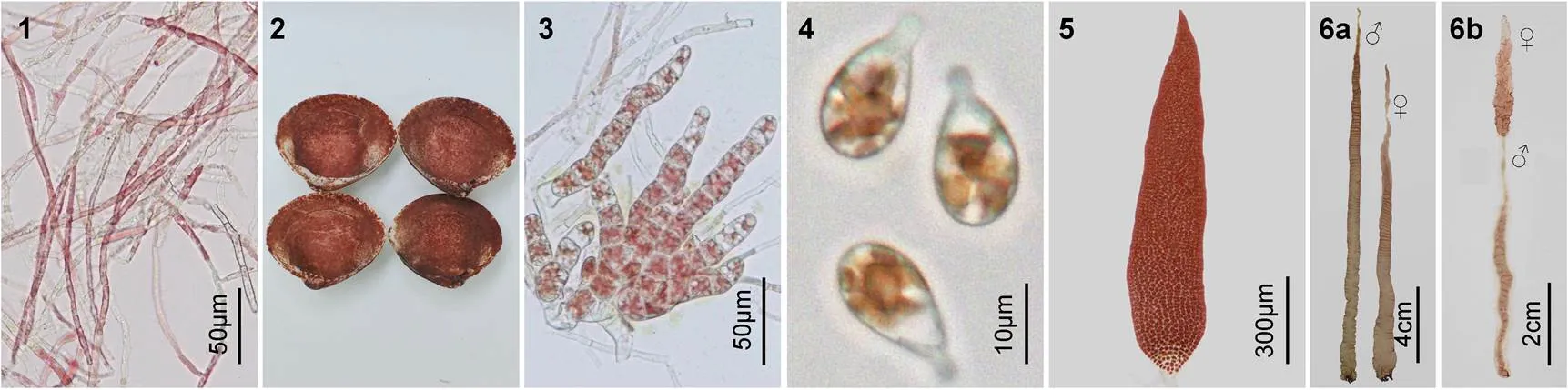
图版Ⅰ生活史的不同阶段
PlateⅠ Photomicrographs of different phases of life-cycle in
1. 自由丝状体; 2. 贝壳丝状体; 3. 膨大藻丝; 4. 壳孢子萌发体; 5. 小叶状体; 6. 成熟叶状体: 6a. 雌雄异体, 6b. 雌雄同体。
图版Ⅱ的生殖细胞和繁殖方式
PlateⅡ Photomicrographs of spermatangiopore, carposporangium, and reproduction of
1, 2. 精子囊的表面观和切面观, 含精子囊64个, 分列式为♂A4B4C4; 3, 4. 果孢子囊表面观及切面观, 果孢子囊为16个或32个, 分列式为♀A2B2C4或♀A4B2C4; 5. 果孢子发育成丝状体; 6. 雌性叶状体边缘的细胞游离出来进行单性生殖, 产生丝状体。
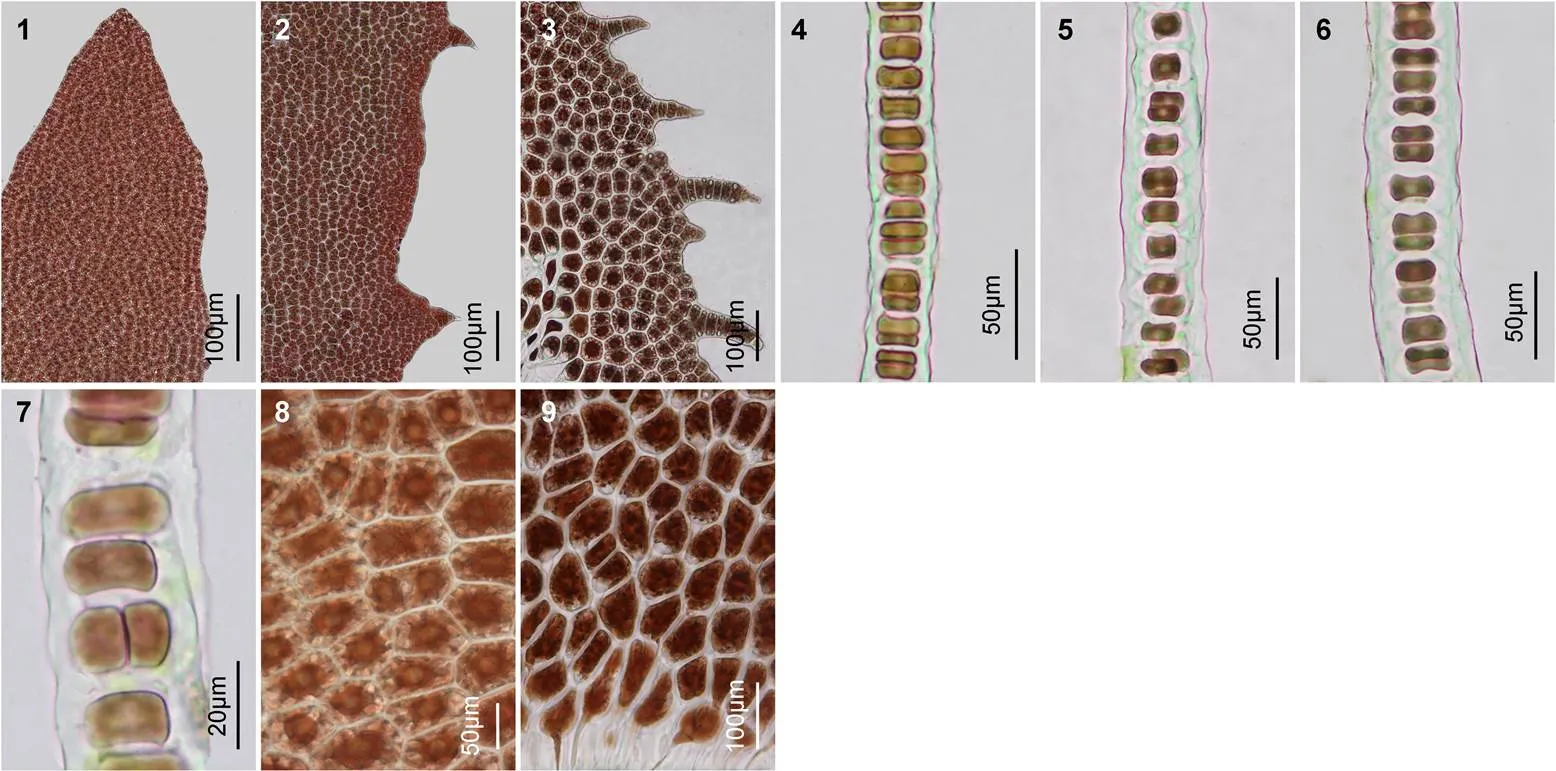
图版Ⅲ叶状体的边缘刺、切面观和细胞形态结构
PlateⅢ Photomicrographs of margin and spines, section and surface views of the tip, middle and base of blades in
1—3. 叶状体的梢、中、基部的边缘和刺状突起; 4—6. 叶状体梢、中、基部的横切面观; 7. 局部叶状体含两层细胞; 8. 部分细胞内含有两个星状色素体; 9. 叶状体基部的假根丝细胞, 具有圆头状向下延伸的假根丝。
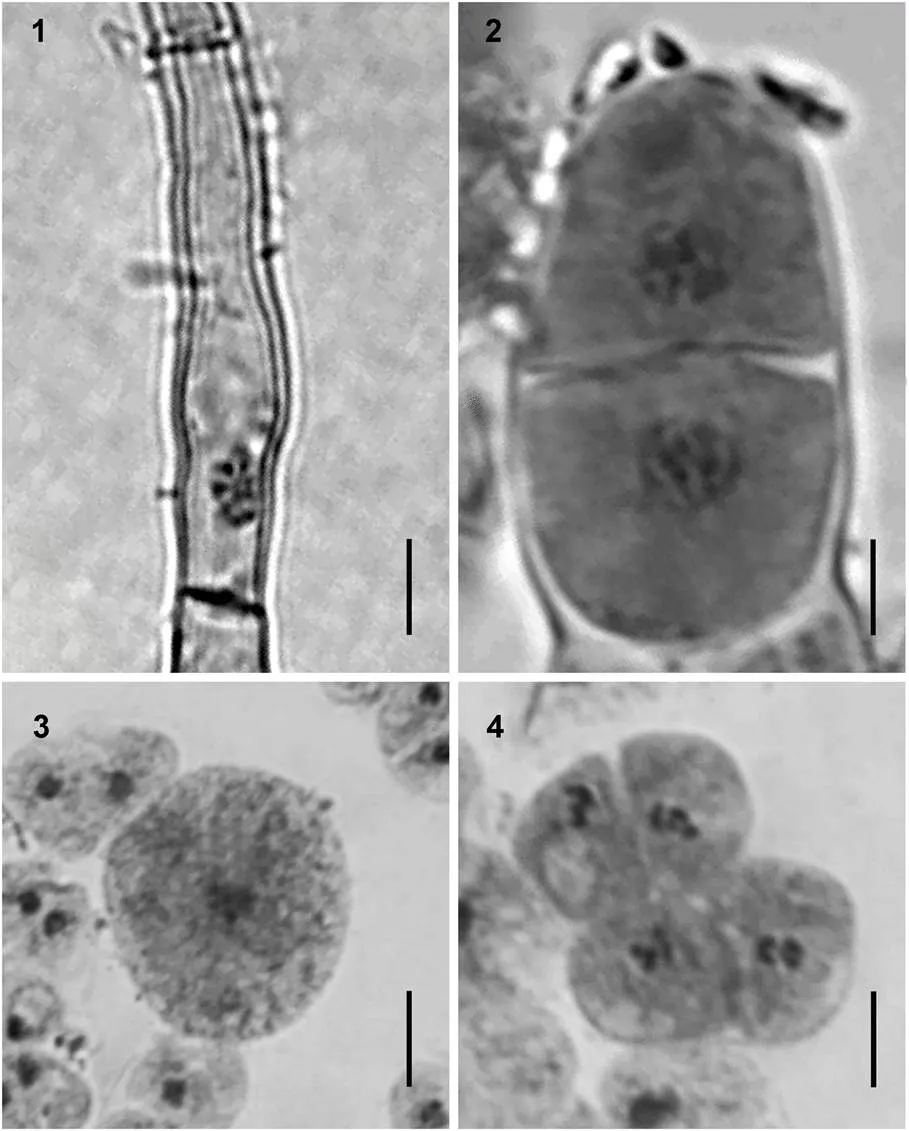
图版Ⅳ不同生活史阶段的染色体微观照片
PlateⅣ Chromosome microphotographs in different phases of life-cycle of
1.丝状体营养细胞含10条染色体, 2=10; 2. 膨大藻丝细胞含10条染色体, 2=10; 3. 叶状体的体细胞含5条染色体,=5; 4. 精子囊细胞含5条染色体,=5。标尺均为5μm
INDIA-ENDEMIC(BANGIALES, RHODOPHYTA): BIOLOGY AND LIFE HISTRY
ZHANG Yan-Yan1, YAN Xing-Hong1
(College of Fisheries and Life science, Shanghai Ocean University, Shanghai 201306, China)
To sustain the germplasm resources of, biological characteristics and life history offrom India were studied. We found that the gametophytic blades of this species are membranous, lanceolate, showing wedge-shape and dark green in the base, but slightly reddish brown in the tip. The blades are most monostromatic, except for a little part consisting of two layers of cells. There are mostly one or sometimes two stellate chloroplasts in the vegetative cell of the blade. The spines in the margins of the middle are sparse but rich at the base of the blades, consisting of one or more than 10 cells in a spine, which become bigger and increases in the number when aged. Before maturation, the base thickness of the blade is (51.5±4.23), the tip (29.4±2.31) and the mean 41.2µm; the blades are 5-10cm in length and 0.5-1cm in width. However, they could grow up to (45±8.7) cm long at maturation. Most blades are dioecious and few monoecious. The sectors of male and female sexual cells usually distribute linearly in the monoecious blades after matured. A mature carposporangium contains 16 or 32 carpospores, showing cell division as ♀A2B2C4or ♀A4B2C4. A mature spermatangiophore contains 64 spermatangia, showing cell division as ♂A4B4C4. The chromosome counts of vegetative cells and spermatangiain the blades are 5 (=5), and the chromosome number in both vegetative cells and conchosporangial branch of conchocelis are 10 (2=10). One-hundred and sixty base-sequences in the 5.8S rDNA-ITS region of this species are the same to those of. These results indicate that the genetic relationship between this species andis very close. However, whether they are the same species needs more works in the future.
; life-cycle; conchocelis; gametophytic blade; chromosome
Q94
10.11693/hyhz20130400030
* 国家高科技研究发展计划(863计划)资助项目, 2012AA100811号; 国家自然科学基金资助项目, 31072208号; 农业部公益性专项, 200903030号; 国家海洋局公益专项, 201105008号, 201105023号。张岩岩, 硕士生, E-mail: zhangyy870227@126.com
严兴洪, 教授, 博士生导师, E-mail: xhyan@shou.edu.cn
2013-04-19,
2013-05-19
