海洋微藻β-葡聚糖的生物活性分析*
2014-04-16周成旭陈海敏严小军骆其君
周成旭 田 甜 陈海敏 严小军 骆其君
海洋微藻β-葡聚糖的生物活性分析*
周成旭①田 甜 陈海敏 严小军 骆其君
(宁波大学海洋学院 宁波 315211)
为研究微藻来源的β-葡聚糖生物活性以及是否存在种间差异, 从6种海洋硅藻和定鞭藻(Haptophyte)中制备了β-葡聚糖, 进行了抗肿瘤、抗氧化、抑菌活性的分析和比较。6种微藻分别为: 中肋骨条藻()、三角褐指藻()、假微型海链藻()、柔弱角刺藻()、球等鞭金藻()、颗石藻(sp.)。研究结果显示: 1. 微藻β-葡聚糖对Hela肿瘤细胞有细胞毒性: 浓度为50—100μg/mL时, 假微型海链藻β-葡聚糖的活性最高; 200μg/mL时, 颗石藻的最高, 但活性均未超过50%。2. 以DPPH和DCFH-DA两种方法检测抗氧化活性发现, 6种微藻β-葡聚糖均有浓度相关的抗氧化活性, 并且对氧自由基的清除率相对较高; 当β-葡聚糖浓度为400μg/mL时, 其清除率可达72%—74%。3. 对不同菌的作用有差异: 有浓度相关的抑制大肠杆菌的作用, 浓度为400μg/mL时, 抑菌率可达60%; 有促进金黄色葡萄球菌生长的作用, 其中, 仅中肋骨条藻的β-葡聚糖有浓度相关的作用。结果表明, 几种硅藻和定鞭藻的β-葡聚糖生物活性功能相同, 都具有抗肿瘤、抗氧化以及抑菌或促菌作用, 活性大小与浓度有明显的相关性。相同浓度或作用时间下, 其活性大小及活性饱和性具有微藻种间差异。这为研究和利用微藻及其天然产物提供了参考。
海洋微藻; β-葡聚糖; 抗肿瘤; 抗氧化; 抑菌活性
β-葡聚糖是葡萄糖单糖经β-糖苷键连接形成的聚合体, 分布在高等植物、细菌、真菌和海藻中, 可以显著提高动物免疫力(Dalmo, 1995; 杨福刚等, 2005), 具有抗肿瘤、抗辐射、降血脂血糖(Braaten, 1994; Battilana2001; Chan, 2009)等功效, 常被称作生物活性调节剂(Miura, 1996)。但是, 由于其活性功能或大小与不同生物来源相关(Vetvicka, 2007), 并且受聚合分子的空间结构差异影响大(诸葛健等,2002), 因而其基础研究与应用方面尚存在争议。
作为海洋生态系统中的初级生产者, 海洋微藻生物量巨大, 生长潜能高, 因适应海洋复杂生境而产生的生物多样性高, 是天然产物的重要生物来源(Borowitzka, 1995)。海洋微藻中, 仅硅藻和定鞭藻(Haptophyte)两类微藻产生具有活性的β型葡聚糖(Hirokawa, 2008; Kusaikin, 2010)。硅藻是海洋中生物量最大的一个微藻类群, 生长繁殖迅速。水产养殖上, 硅藻和定鞭藻的一些种类也是优质生物活饵料, 得到广泛应用。其大量培养的技术成熟, 环境友好, 可作为天然产物生产的生物来源。
目前, 对海洋微藻β-葡聚糖提取方法、分子量测定、结构鉴定等方面有较多的研究 (Vårum, 1986; Kiss, 1988; Janse, 1996), 但是对不同微藻β-葡聚糖生物活性及生成机理研究较为缺乏(Størseth, 2005; Hirokawa, 2008)。本研究从6种人工培养条件下生长快、生物量高、β-葡聚糖产量高的海产硅藻和定鞭藻中, 提取制备了β-葡聚糖, 分别进行了几种生物活性的检测和比较分析, 为微藻β-葡聚糖的基础研究与开发利用提供参考。
1 材料与方法
1.1 实验材料
藻种:藻种均为宁波大学海洋学院微藻种质库存种, 主要是水产养殖饵料微藻, 均可大量培养。
硅藻:中肋骨条藻(, 编号1)、三角褐指藻(, 编号2)、假微型海链藻(, 编号3)、柔弱角刺藻(, 编号4)
定鞭藻:球等鞭金藻(, 编号5)和颗石藻sp.(非饵料藻, 编号6)
1.2 实验方法
1.2.1 藻种培养及β-葡聚糖的提取制备和检测
以f/2培养基(Guillard, 1975)分别进行微藻的大量培养。在种群生长平台期离心收集微藻, 制备冻干藻粉, 储备足量后提取制备β-葡聚糖。
β-葡聚糖的提取及纯化方法参考Hirokawa等(2008)以及Granum等(2002)专门针对β-葡聚糖的制备方法, 得到粉末状葡聚糖。
β-葡聚糖的纯度检测: 刚果红用来指示葡聚糖的3级结构, 仅与三螺旋β-1,3-1,6葡聚糖特异性结合产生光谱特征变化(Ogawa, 1972; Nitschke, 2011), 与其他类型的多糖不发生变化(Chihara, 1969), 是检测具生物活性的β型葡聚糖含量相对快速简易的方法。因此, 本研究以刚果红法检测产品中β型葡聚糖的含量(张娟等, 2007)。结果显示, 产品纯度分别为: 中肋骨条藻92%, 三角褐指藻93%, 柔弱角刺藻92%, 假微型海链藻94%, 球等鞭金藻91%, 颗石藻94%。本研究还以同样的过程和方法提取、制备和检测了其他类群的微藻, 包括小球藻和扁藻(绿藻)、东海原甲藻(甲藻)、赤潮异弯藻(针胞藻)等, 制备的糖均不与刚果红产生显色反应。
1.2.2 生物活性检测方法
抗Hela肿瘤细胞毒活性检测
采用MTT法检测微藻β-葡聚糖对HeLa细胞的体外增殖抑制效应, 参照Boehm等(1997)的方法略有改动。将培养的宫颈癌Hela细胞(购于中国典型培养物保藏中心)用胰酶消化, 加于96孔板中, 使每孔细胞密度为(2—3)×104细胞/孔, 于37°C, 5%CO2培养箱中培养24h。将β-葡聚糖水溶液以5微升/孔的剂量加入上述96孔板中, 终浓度为0、50、100、200μg/mL, 各3平行, 置于原培养箱中继续培养48h后, 各孔加入20µL 5mg/mLMTT (甲基噻唑蓝, 购自德国Serva公司), 培养4h。弃培养液, 各孔加入150µL二甲基亚砜(DMSO), 振荡至MTT完全溶解, 测定492nm处吸光值。
抑制率(blank-test)/blank×100% (1)
其中,blank为0μg/mL β-葡聚糖对照组的吸光值,test为实验组的吸光值。
抗氧化活性检测
(1) 对DPPH清除能力的检测: 分别制备6种海洋微藻β-葡聚糖的50%乙醇溶液储备液; 制备DPPH 90%乙醇溶液(0.15mmol/L)作为检测试剂。将2μL各β-葡聚糖溶液加入200μLDPPH检测试剂, 各β-葡聚糖实验终浓度为0、50、100、200、400μg/mL。于25°C下避光反应30min, 以酶标仪测定492nm吸光值。各3平行。
DPPH清除能力1= (Blank–Test)/Blank×100% (2)
其中Blank是空白管的吸光值(=0min),Test是测试管的吸光值(=30min)。
(2) 以DCFH-DA检测β-葡聚糖的抗氧化能力: 取0.5mL DCFH-DA甲醇溶液(1mmol/L), 加入2mL NaOH溶液(0.01mol/L)中, 室温(25°C)下放置30min, 以10mL磷酸缓冲液(pH7.4)中和, 荧光剂终浓度为40μmol/L。于96孔板中依次加入100μL DCFH-DA荧光试剂、20μL β-葡聚糖溶液、40μL 5μmol/L的H2O2以及40μL 200mmol/L的FeSO4, 各3孔平行。β-葡聚糖实验终浓度为: 0、50、100、200、400μg/mL。于25°C下暗处放置1h。以荧光分光光度计分析荧光强度(Ex/Em=488nm/525nm)。样品清除自由基的能力按照公式(3)计算:
DCFH-DA清除能力2=
(Test–Blank)/(Control–Blank)×100% (3)
其中Blank是未加样品和H2O2的空白孔荧光值,Test是测试孔的荧光值,Control是未加样品的对照孔荧光值。
抗菌活性检测
参考骆健美等(2011)的方法, 以100mLLysogeny Broth(LB)液体培养基接种大肠杆菌()和金黄色葡萄菌(), 37°C培养12h。于96孔板上进行检查: 空白对照组为200μL无菌培养基; 菌液对照组为100μL菌液加100μL无菌培养基, 细菌数107—108ind./mL; 实验组加入100μL菌液和100μL无菌培养基, 依次加入10μL各海洋微藻β-葡聚糖, 终浓度为50、100、200、400μg/mL。37°C静置培养12h。期间, 每3h以酶标仪测定600nm下的吸光值。
抑菌率以培养12h结果按照公式(4)计算:
抑菌率= (R–)/(R–B) × 100% (4)
其中R是菌液对照组吸光值;B是空白对照组吸光值;是实验组吸光值。
对出现抑菌现象的实验组, 分析了作用时间(0、3、6、9、12h)对抑菌效果的影响。
1.3 数据处理
采用单因素方差分析进行差异显著性检验(杜荣骞, 2003)
2 结果
2.1 抗肿瘤细胞毒活性
以MTT法检测不同微藻β-葡聚糖对Hela细胞的作用发现, 6种微藻β-葡聚糖对宫颈癌Hela细胞均有细胞毒性, 且受葡聚糖浓度大小影响(图1): 浓度为50—100μg/mL时, 假微型海链藻的β-葡聚糖细胞毒最高; 浓度为200μg/mL时, 颗石藻的β-葡聚糖细胞毒最高。各检测浓度下, 最高致死率均不超过50%。球等鞭金藻和颗石藻的β-葡聚糖活性与浓度呈线性相关(2=0.99), 中肋骨条藻的β-葡聚糖活性最低, 但是与浓度正相关。
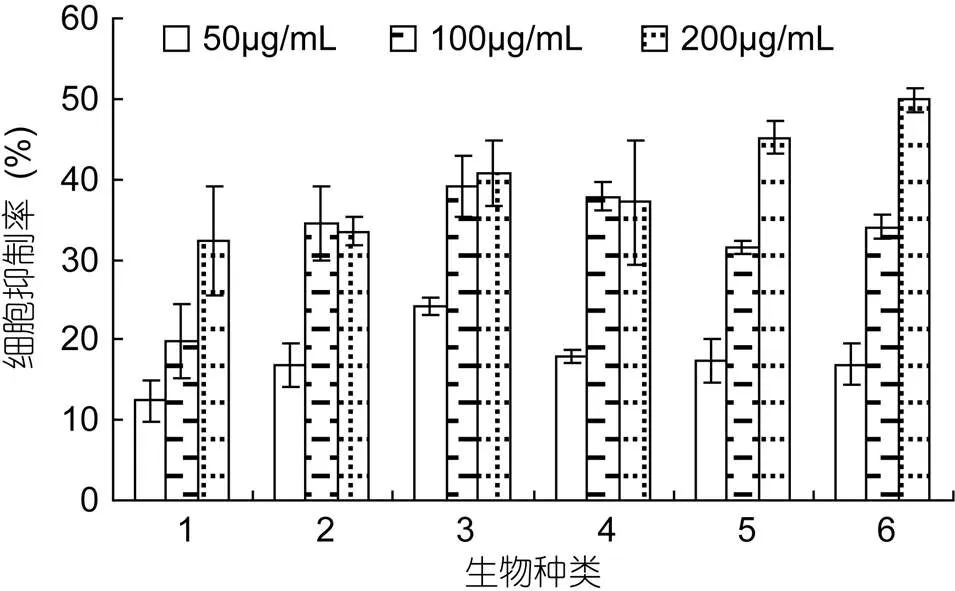
图1 各微藻β-葡聚糖对Hela细胞的抑制率
1. 中肋骨条藻(); 2. 三角褐指藻(); 3. 假微型海链藻(); 4. 柔弱角刺藻(); 5. 球等鞭金藻(); 6. 颗石藻(sp.)
2.2 抗氧化活性
6种微藻β-葡聚糖对DPPH和氧自由基的清除率如图2所示, 浓度在0—400μg/mL时, 微藻β-葡聚糖对DPPH和氧自由基的清除率随β-葡聚糖浓度增加而增加, 对氧自由基的清除率在各浓度下均明显大于对DPPH的清除率。
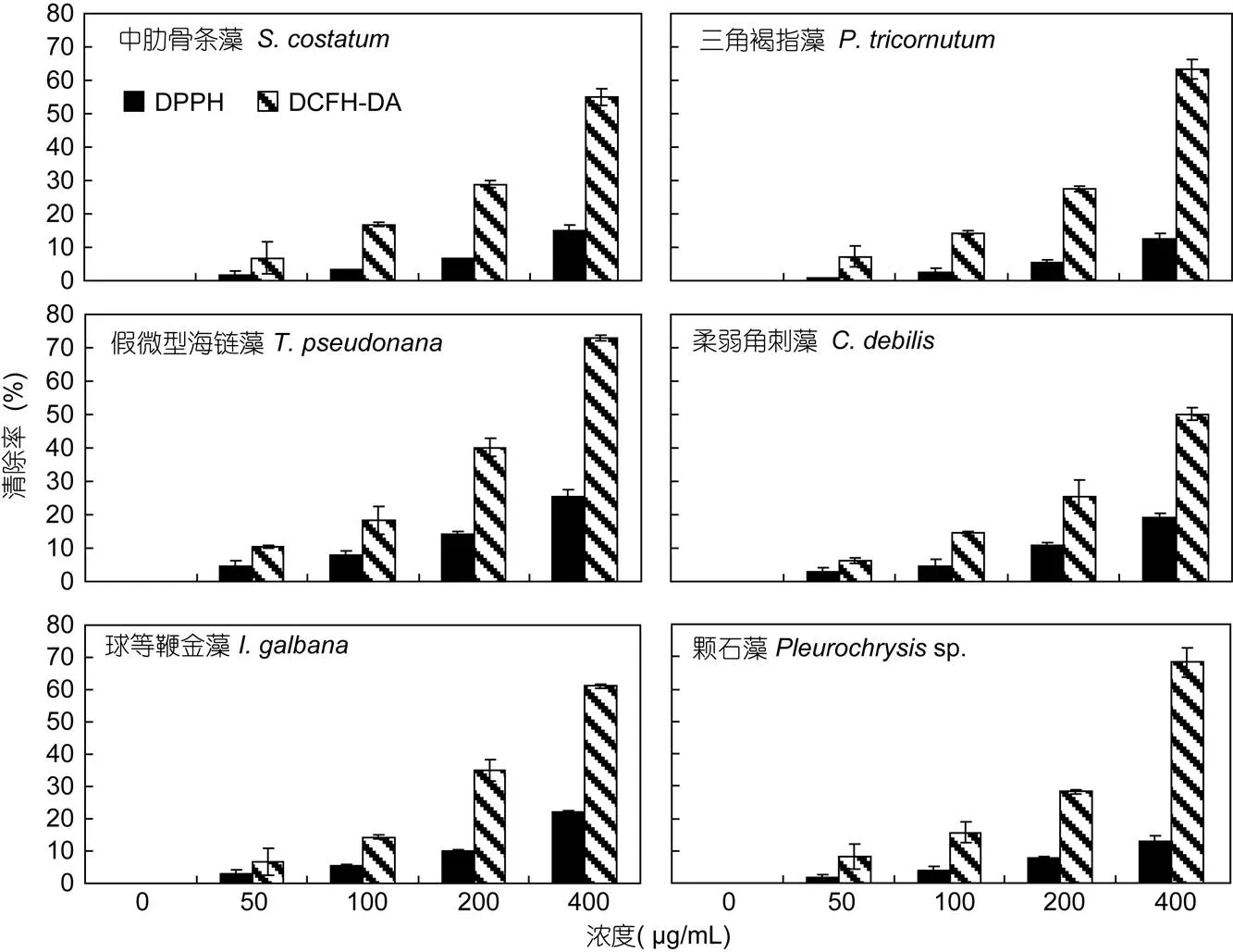
图2 各微藻β-葡聚糖对DPPH和氧自由基(基于DCFH-DA)清除率
分析相同浓度(400μg/mL)对DPPH和氧自由基清除率发现(图3), 6种微藻β-葡聚糖对DPPH的清除率介于12%—26%, 其中, 假微型海链藻β-葡聚糖对DPPH的清除率略高, 但仅为25.12%。对氧自由基的清除率达50%—72.9%, 其中假微型海链藻β-葡聚糖的清除率最大。相同浓度下, 不同微藻葡聚糖对同一种自由基的清除率有显著差别(<0.01)。
2.3 抗菌活性
2.3.1 抑菌率 微藻β-葡聚糖对大肠杆菌12h抑菌率如图4所示。抑菌率随β-葡聚糖浓度增加而增加。其中, 三角褐脂藻和柔弱角刺藻β-葡聚糖在浓度为0—200μg/mL时, 与抑菌率呈正相关, 浓度达400μg/mL后, 不再明显上升。其他4种微藻β-葡聚糖在0—400μg/mL范围, 抑菌率与浓度正相关。其中假微型海链藻、球等边金藻和颗石藻的最高浓度下抑菌活性显著高于其他3种(<0.01)。
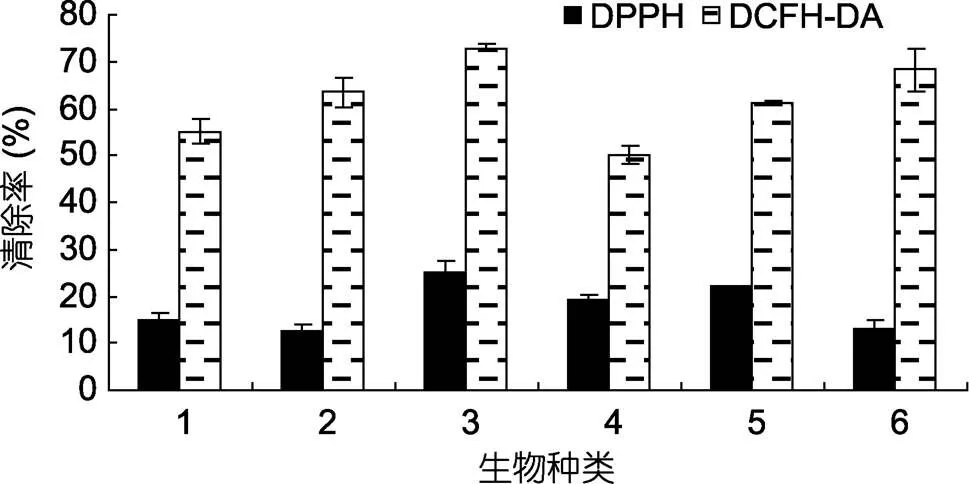
图3 各微藻β-葡聚糖在相同浓度(400μg/mL)下对DPPH和氧自由基(基于DCFH-DA)清除率
1. 中肋骨条藻(); 2. 三角褐指藻(); 3. 假微型海链藻(); 4. 柔弱角刺藻(); 5. 球等鞭金藻(); 6. 颗石藻(sp.)
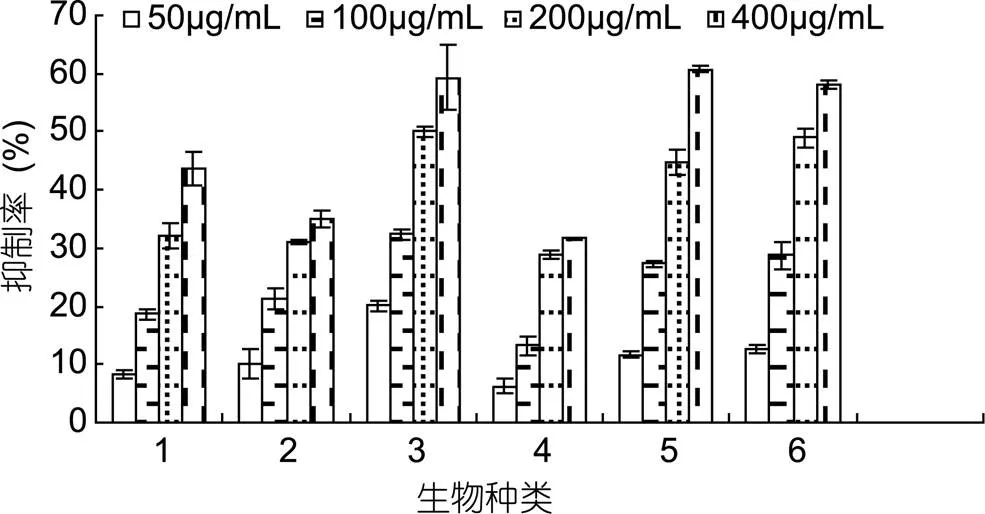
图4 各微藻β-葡聚糖对大肠杆菌抑制率
1. 中肋骨条藻(); 2. 三角褐指藻(); 3. 假微型海链藻(); 4. 柔弱角刺藻(); 5. 球等鞭金藻(); 6. 颗石藻(sp.)
微藻β-葡聚糖作用于金黄色葡萄球菌的结果(12h)如图5所示, 对金黄色葡萄球菌有一定的促生长作用。其中, 中肋骨条藻的葡聚糖促进作用与浓度明显相关, 且促生长能力高。其他的不表现浓度相关性, 且最大促进力低。
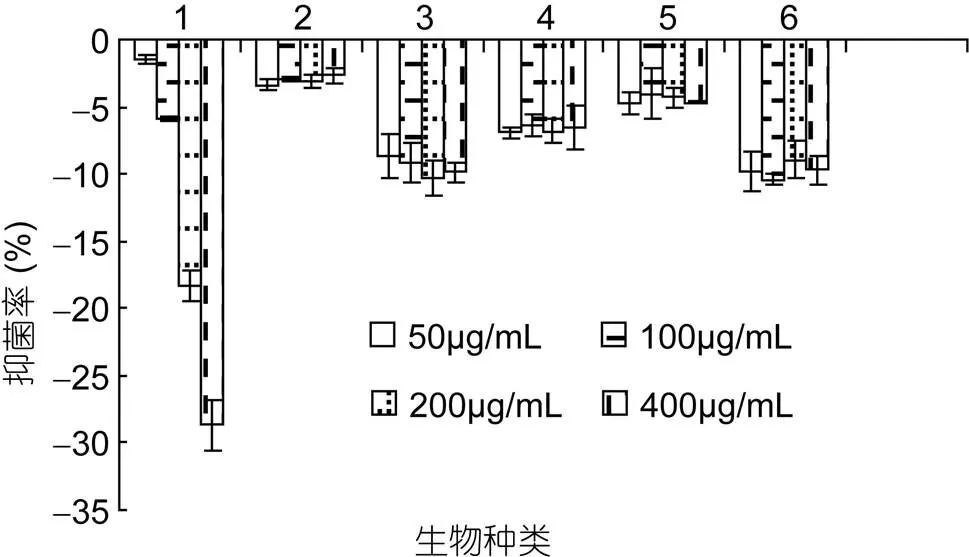
图5 各微藻β-葡聚糖对金黄色葡萄球菌的影响
1. 中肋骨条藻(); 2. 三角褐指藻(); 3. 假微型海链藻(); 4. 柔弱角刺藻(); 5. 球等鞭金藻(); 6. 颗石藻(sp.)
2.3.2 抑菌与时间的关系 微藻β-葡聚糖对大肠杆菌的抑制作用与时间相关性如图6所示。当葡聚糖浓度较低(50μg/mL和100μg/mL), 抑菌率与时间均呈线性相关。当β-葡聚糖浓度较高(200μg/mL和400μg/mL), 除中肋骨条藻和颗石藻, 其他微藻β-葡聚糖抑菌曲线均呈“S”型, 说明高浓度下, 抑菌作用随时间增加易饱和的特点。
3 讨论
不同微藻代谢产生多种形态的多糖聚合物, 但是, 仅β-D-(1,3)(1,6)葡聚糖具有生物活性, 且该类葡聚糖只存在于硅藻、定鞭藻, 如硅藻和定鞭藻的金藻昆布糖()(Kusaikin, 2010)。本研究同期分析的结果也显示, 其他类微藻不能产生具有生物活性的b-葡聚糖。
多糖活性检测研究大多是针对酵母、真菌、细菌或大型藻(如海带)等生物体来源的葡聚糖进行分析, 对微藻来源的β-葡聚糖活性检测的研究很少, 不同微藻β-葡聚糖的活性差异比较研究尚未见报道。本研究从4种硅藻和2种定鞭藻中提取了β-葡聚糖, 检测了抗肿瘤、抗氧化及抗菌活性。结果显示, 各藻来源的葡聚糖都具有Hela肿瘤细胞毒活性、抗氧化活性、抑菌或促菌活性, 具有的活性功能基本一致。
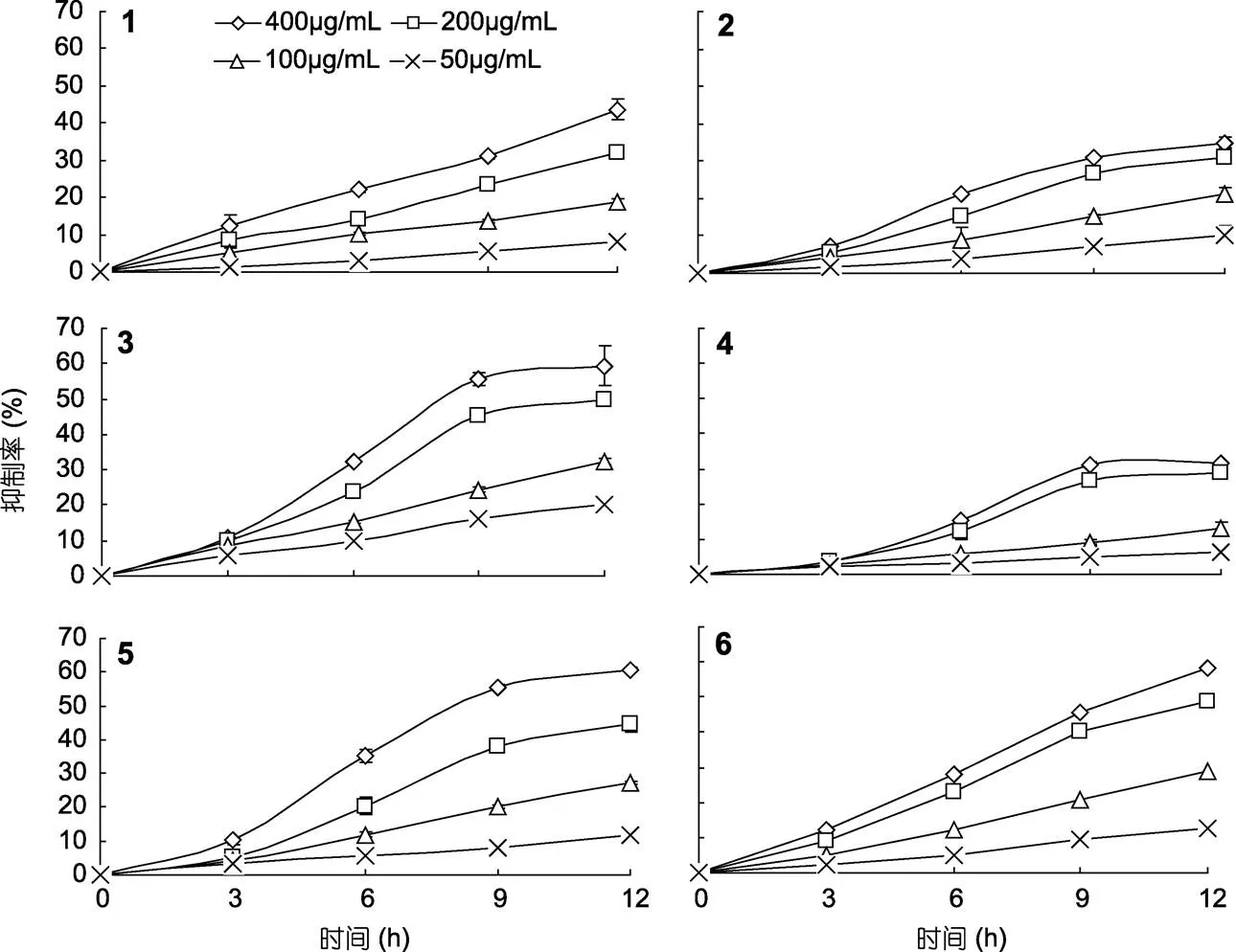
图6 微藻β-葡聚糖对大肠杆菌抑制率随时间的变化特征
1. 中肋骨条藻(); 2. 三角褐指藻(); 3. 假微型海链藻(); 4. 柔弱角刺藻(); 5. 球等鞭金藻(); 6. 颗石藻(sp.)
葡聚糖的生物活性与其分子量、空间结构等关系密切(Vetvicka, 2007)。对微藻来源的β-葡聚糖研究显示, 微藻葡聚糖分子量小(Oyama, 2006), 可溶性高, 多是β-(1,3)糖苷键连接成主链, 在葡萄糖单位C2和C6连接带有β-(1,6)糖苷键的支链, 其聚合度在16—60, 分子量在(2.5—10)×104Da(McConville, 1986; Paulsen, 1978), 没有显著差异。可能造成了几种微藻来源的葡聚糖活性功能相同的特点。
虽然结构、功能相近, 但是微藻β-葡聚糖的生物活性在作用浓度、活性大小以及时间效应上有显著的种间差异。本研究的抗肿瘤细胞毒活性中, 柔弱角刺藻、假微型海链藻和三角褐指藻葡聚糖增加至最高实验浓度时, 其活性增速会降低; 球等鞭金藻和颗石藻的活性与作用浓度在实验范围内则始终呈线性相关, 可能在浓度更高时才会出现活性饱和。微藻葡聚糖抗氧化活性则均与实验浓度呈线性相关。相同浓度下, 颗石藻和假微型海链藻葡聚糖的抗氧化活性相对较高, 且对大肠杆菌的抑菌率也相对较高。研究较多的真菌来源的葡聚糖活性分析也显示, 各种真菌来源的葡聚糖结构和功能基本相近, 但是对不同肿瘤细胞的抗肿瘤效应、以及在不同细胞中产生反应, 特别是不同细胞因子的表达和产物有所不同(Borchers, 1999)。
葡聚糖的活性由其空间结构及分子量大小决定, 其作用机理与受体的空间结构相关, 其饱和过程或许是相互作用部位的空间占位(Ariizumi, 2000; Brown, 2001)。葡聚糖的生物活性还受宿主自身的代谢调节, Takeyama等(1987)发现, 真菌灰树花()多糖抗肿瘤活性受宿主巨噬细胞和T细胞作用明显, 宿主的代谢活动显著影响多糖的活性。其活性还跟注射途径和作用时间有关系(Suzuki, 1987)。葡聚糖的纯度、与蛋白的结合度等也可能对活性功能与大小产生影响(Kidd, 2000; Ebina, 2001), 因此不只是生物来源的差异, 跟生产过程、提取过程均有相关性。
微藻葡聚糖与其他生物来源的葡聚糖比较时, 活性功能的差异更明显。抑菌检测中, 我们同时还对燕麦葡聚糖标准品抑菌活性进行了分析, 发现燕麦葡聚糖对大肠杆菌和金黄色葡萄球菌不产生作用。牛宏彦等(2010)用酵母β-葡聚糖在体外对大肠杆菌实验也没有抑制作用。海洋微藻提取物抑菌活性的物质本质多为多糖、蛋白质、脂肪酸等(Størseth, 2005), 其抑菌性尚有很多问题未解决, 如抑、促菌特征及机制、作用方式以及对细菌和真菌的抑制比较等方面的问题。本研究中, 骨条藻葡聚糖具有浓度相关的显著促进金黄色葡萄球菌生长的特征, 与其他各藻葡聚糖活性大小差别较大。其作用机理尚待从几种微藻葡聚糖的结构特征、细菌对葡聚糖的利用代谢特征等方面进行研究。关于不同生物来源的葡聚糖活性机理及功能差异机制的研究都还很缺乏。
对不同微藻β-葡聚糖活性进行分析, 主要有两个方面的研究与应用价值。一是在基于微藻大量培养的产业链上开发活性物质生产目标; 另一方面, 由于微藻处于水生生物圈的食物链基础位置, 在自然生态系统或人工养殖活动中, 作为食物来源的微藻其营养价值或生物活性价值与捕食者的摄食选择和营养优化密切相关。硅藻与定鞭藻的很多种类是浮游动物的重要食物来源, 也是水产养殖中的优良活饵料。本研究的微藻, 除颗石藻外, 均为水产养殖饵料微藻。作为饵料微藻, 假微型海链藻的推广应用相对其他几种饵料藻稍显少一些。假微型海链藻的饵料效果优良(作者交流), 从本文结果来看, 其生物活性高, 不失为一种好的饵料选择。虽然颗石藻种群生长迅速, 但由于颗石藻的环境生态效应复杂(周成旭等, 2008; 蒋莹等, 2009), 需谨慎选择。
牛宏彦, 杜丽萍, 张学况等, 2010. 硫酸化酵母葡聚糖体内和体外对大肠杆菌抑制作用的比较. 酿酒科技, 189(3): 37—39
杜荣骞, 2003. 生物统计学(第二版). 北京: 高等教育出版社, 105—114
杨福刚, 周洪琪, 黄旭雄, 2005. 不同β-葡聚糖对凡纳滨对虾稚虾生长及非特异免疫功能的影响. 上海水产大学学报, 14(3): 263—269
张娟, 杜先锋, 饶砚琴, 2007. 刚果红法测定燕麦中β-葡聚糖含量的研究. 安徽农业大学学报, 34(1): 23—26
周成旭, 严小军, 孙雪等, 2008. 一种颗石藻水华种的特征界定. 水生生物学报, 32 (6): 947—951
骆健美, 成永新, 李培君等, 2011. 基于抑菌活性的ε-聚赖氨酸的微孔板生物检测法. 微生物学通报, 38(7): 976—981
诸葛健, 赵振锋, 方慧英, 2002. 功能性多糖的构效关系. 无锡轻工大学学报, 21(2): 209— 212
蒋莹, 周成旭, 骆其君等, 2009. 颗石藻不同细胞状态对卤虫的致死效应研究. 生态毒理学报, 4(4): 561—568
Ariizumi K, Shen G L, Shikano S, 2000. Identification of a novel, dendritic cell-associated molecule, dectin-1, by subtractive cDNA cloning. J Biol Chem, 275(26): 20157— 20167
Battilana P, Ornbtein K, Minehira K, 2001. Mechanisms of action of beta-glucan in postprandial glucose metabolism in healthy men. European J Clin Nutri, 55(5): 327—333
Boehm T, Folkman J, Browder T, 1997. Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance. Nature, 390(6658): 404—407
Borchers A T, Stern J S, Hackman R M, 1999. Mushrooms, tumors, and immunity. Proc Soc Exp Biol Med, 221(4): 281—93
Borowitzka A, 1995. Microalgae as sources of pharmacuticals and other biologically active compounds. Appli Phycol, 7: 3—15
Braaten T, Wood J, Scott W, 1994.Oat β-glucans reduces blood cholesterol concentration in hyper cholesterolemic subject. Eur J Clin Nutr, 48: 465—474
Brown G D, Gordon S, 2001. Immune recognition. A new receptor for beta-glucans.Nature, 413(6851): 36—37
Chan G C, Chan W K, Sze D M Y, 2009. The effects of β-glucan on human immune and cancer cells. J Hematol Oncol, 2(25): 1—11
Chihara G, Maeda Y, Hamuro J, 1969. Inhibition of mouse sarcoma 180 by polysaccharides from. Nature, 222: 687—688
Dalmo R A, Seljelid R, 1995. The immunomodulatory effect of LPS, laminaran and sulphated laminaran [β(l,3)-D-glucan] on Atlantic salmon.L., macrophages in vitro. J Fish Disea, 18(2): 175—185
Ebina T, 2001. Intratumoral administration of biological preparations recommendation for integrative medicine. Gan To Kagaku Ryoho, 28(11): 1515—1518 (In Japanese)
Granum E, Myklestad S M, 2002. A simple combined method for determination of β-1,3-glucanand cell wall polysaccharides in diatoms.Hydrobiologia,477: 155—161
Guillard R R L, 1975. Culture of phytoplankton for feeding marine invertebrates. In Smith W L, Chanley M H eds. Culture of Marine Invertebrate. Animals Plenum Press, New York, USA: 26—60
Hirokawa Y, Fujiwara S, Suzuki M, 2008. Structural and physiological studies on the storage β-polyglucan of haptophyte. Planta, 227: 589—599
Janse I, van Rijssel M, van Hall P J, 1996. The storage glucan of(Prymnesiophyceae) cells. J Phycol, 32: 382—387
Kidd P M, 2000. The use of mushroom glucans and proteoglycans in cancer treatment. Alternative Medicine Review, 5(1): 4—27
Kiss J Z, Triemer R E, 1988. A comparative study of the storage carbohydrate granules from(Euglenida) and(Prymnesida). J Protozool, 35: 237—241
Kusaikin M I, Ermakova S P, Shevchenko N M, 2010. Structural characteristics and antitumor activity of a new chrysolaminaran from the diatom alga. Chem Natur Comp, 46(1): 1—4
McConville M J, Bacic A, Clark A E, 1986. Structural studies of chrysolaminaran from the ice diatom(Gregory).Carbohydr Res, 153: 330—333
Miura N N, Ohno N, Aketagawa J, 1996. Blood clearance of 1,3-beta-D-glucan in MRL lpr/lpr mice.FEMS immunology and medical microbiology, 13(1): 51—57
Nitschke J, Modick H, Busch E, 2011. A new colorimetric method to quantify β-1,3-1,6-glucans in comparison with total β-1,3-glucans in edible mushrooms. Food Chem, 127: 791—796
Ogawa K, Tsurugi J, Watanabe T, 1972. Complex of Gel-gorming β-1,3-d-Glucan with Congo-red in Alkaline Solutions. Chem Lett, 1: 689—692
Oyama Y, Izumo A, Fujiwara S, 2006. Granule-bound starch synthase cDNA in11 h: cloning and regulation of expression by CO2concentration. Planta, 224: 646—654
Paulsen B S, Myklestad S, 1978. Structural studies of the reserve glucan produced by the marine diatom(Grev.) Cleve. Carbohydr Res, 62: 368—388
Størseth T R, Hansen K, Reitana K I, 2005. Structural characterization of b-D-(1-3)-glucans from different growth phases of the marine diatomsand. Carbohydr Res, 340: 1159—1164
Suzuki I, Takeyama T, Ohno N, 1987. Antitumor effect of polysaccharide grifolan NMF-5N on syngeneic tumor in mice. J Pharmacobiodyn, 10(2): 72—77
Takeyama T, Suzuki I, Ohno N, 1987. Host-mediated antitumor effect of grifolan NMF-5N, a polysaccharide obtained from Grifola frondosa. J Pharmacobiodyn, 10(11): 644—651
Vårum K M, Kvam B J, Myklestad S, 1986. Structure of a food-reserve-D-glucan produced by the Haptophyta alga(Lohmann) Hay and Mohler. Carbohydr Res, 152: 243—248
Vetvicka V, Vetvickova J, 2007. Physiological effects of different types of β-glucan. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 151(2): 225—231
BIOACTIVITIES OF Β-GLUCAN IN SIX MARINE MICROALGAE
ZHOU Cheng-Xu, TIAN Tian, CHEN Hai-Min, YAN Xiao-Jun, LUO Qi-Jun
(School of Marine Science, Ningbo University, Ningbo 315211, China)
The biological activity of β-glucan in different organisms varies significantly. We studied the bioacitivity, in terms of cytotoxicity, antioxidation, and antimicrobe, of β-glucans extracted from mass cultures of six strains of marine diatom and haptophyte, namely,,,,,, andsp. The results show that β-glucan from each microalgal strain showed moderate cytotoxicity on Hela cells. The most potent β-glucan was fromin concentration ranged 50-100 μg/ml, andsp. at 200 μg/ml. β-glucan fromandsp. show good positive concentration-cytotoxcitiy correlation. Moreover, β-glucan from all the strain was concentration-relevant in antioxidation against reactive oxygen and DPPH; for example, at 400μg/ml, β-glucan could remove 72% to 74% reactive oxygen. However, the effects on microorganism by β-glucan differed among the strains. For instances, β-glucan from marine microalga could inhibit the growth ofup to 60% at the concentration of 400 μg/ml, but promote the growth of(best for β-glucan from). The activities were concentration- and time- dependent. Significant difference may exist among the microalga at the same glucan concentration, calling for more works in the future.
microalgae; β-glucan; anticancer; antioxidation; antimicrobial
10.11693/hyhz20121120001
* 国家科技支撑计划课题, 2011BAD13B08号; 浙江省重点科技创新团队: 海洋生物技术产业科技创新项目, 2010R50029号; 浙江省自然科学基金项目, Y506131号, LY12D06001号; 海洋可再生能源专项资金项目, GHME2001SW02号
周成旭, 副研究员, Email: zhouchengxu@nbu.edu.cn
2012-11-20,
2013-02-27
Q17
