两种酵母对奶牛瘤胃体外发酵特性的影响
2014-04-16周传社汤少勋谭支良
王 祚,周传社,汤少勋,谭支良
(1.中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,湖南长沙410125;2.中国科学院大学,北京100049)
由于畜禽生产中抗生素的滥用及其残留对动物和人类健康构成了严重隐患,欧盟已经立法全面禁止抗生素在畜禽生产中的使用,我国及其他国家也已陆续出台相关法律法规限制在畜禽生产中使用抗生素。因此,作为抗生素的替代产品,饲用微生物(Direct-fed Microorganism,DFM),又称益生素(Probiotics),正日益成为一种新型的饲料添加剂得到了较为充分的研究与应用,酵母菌更是作为热点之一激发了动物营养学家们的广泛研究兴趣。然而,大部分关于酵母菌的研究都集中在酵母培养物方面,而关于活性酵母的研究则相对较少。已有的关于活性酵母的研究结果证明,添加活性酵母对反刍动物的瘤胃发酵、生产性能、产品质量及其安全性等方面都有积极的影响[1-2]。然而不同的试验所得的结果却不尽相同,这是由于酵母菌的益生作用与试验动物的种类、日粮类型、饲喂管理方式等密切相关,如在育肥期内肉牛日粮中添加酿酒酵母可使其体重增加7.5%[3]。另有研究发现,添加酿酒酵母时,饲喂青贮料比饲喂高纤维的农副产品和高比例的大麦效果更好[4]。另外酵母的添加作用也会因酵母菌菌种的结构及生物活性的不同而产生差异。Newbold等[5]的体外发酵试验结果显示,添加NCYC240与NCYC1026两种酿酒酵母菌株能够增加瘤胃中细菌总数及纤维降解菌的数量。
已经证实,在奶牛日粮中添加酵母产品能起到如下作用:提高营养物质消化率、调整瘤胃中挥发性脂肪酸(VFA)的浓度与比例、减少瘤胃中氨的浓度、增加瘤胃内微生物种群数量等[6],但是其作用机制尚未得到完整的研究和解释。活性酵母被证实可以通过稳定瘤胃pH以改善瘤胃发酵条件[7],也有研究表明高温条件下在日粮中添加活性酵母可以改善瘤胃环境,提高干物质采食量、饲料报酬和生产性能[8]。由于活性酵母菌通常需要利用氧气以代谢糖类或其它营养物质,有研究者推测活性酵母菌可以通过消耗氧气而平衡瘤胃中的氧化还原反应,从而为瘤胃内的微生物群落创造严格厌氧的最佳发酵环境[9-10]。
本试验的目的即运用瘤胃体外发酵技术,初步探究并比较两种酵母对奶牛瘤胃体外发酵特性的影响,从而预测活性酵母对奶牛生产性能可能的影响,以期为研究酵母在反刍动物生产中的实际应用与营养生理调控提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1发酵底物 2种待发酵粗饲料底物分别为玉米秸秆(湖南长沙科湘甜玉1号)与水稻秸秆(湖南浏阳湘125s)。底物经65℃烘干24h,经1mm孔径筛粉碎后备用。按照杨胜等[11]确定的常规方法测定其干物质(DM)、有机物(OM)、粗蛋白(CP)以及粗脂肪(EE)等含量;依照Hall等[12]的方法进行调整,使用Fibretherm FT12全自动纤维仪(GerhardtAnalytical Systems,Germany)测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量。具体成分含量见表1。
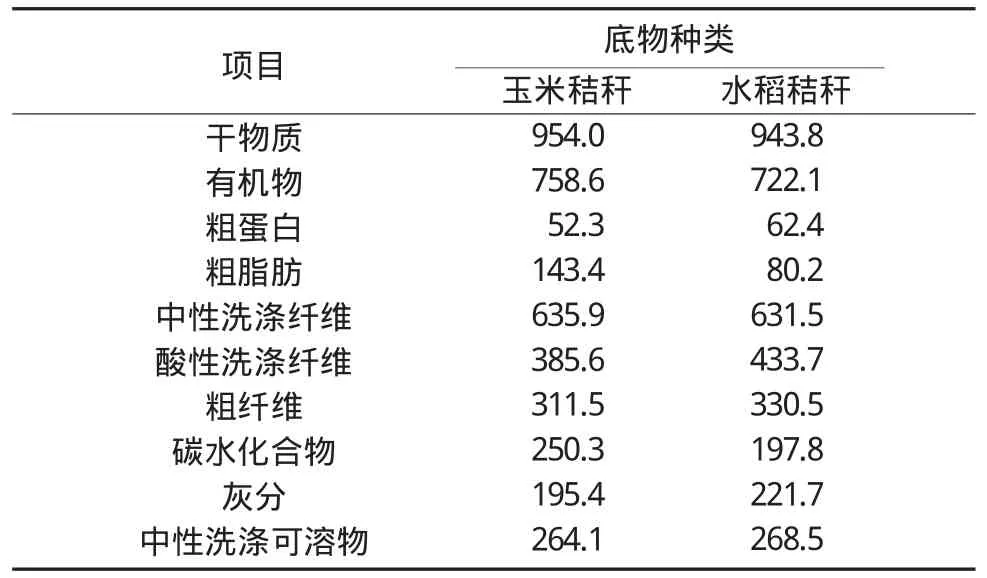
表1 两种粗饲料底物的主要营养成分表 (单位:g/kg DM)
1.1.2酵母来源 本试验所用的两种酵母分别为法国乐斯福集团(Lesaffre Feed Additives,France)及中国安琪公司(Angel YeastCo.,Ltd,P.R.China)所生产的商业活性酵母产品,菌种均为酿酒酵母(Saccharomyces cerevisiae),活菌数浓度分别为1.5×1010cfu/g和 2.0×1010cfu/g。
1.2 试验动物、日粮及饲养管理
1.2.1瘤胃液供给动物 选择3头体况良好、年龄相同(3胎次)、体重相近(500±50kg)的荷斯坦奶牛,安装永久瘤胃瘘管后,护理20d,瘤胃瘘管安装适应期为1个月。
1.2.2试验动物日粮及饲养管理 试验日粮参照NRC泌乳奶牛饲养标准配制[13]。基础日粮由水稻秸秆和精料补充料组成,日粮精粗比为40∶60。日粮组成及营养成分如表2所示。
1.3 体外发酵试验设计及方法
两种活性酵母产品均设置4个添加水平,采取单因子区组试验设计,在39℃恒温培养箱中培养48h。两种酵母的不同添加水平作为一个处理,每个处理设置12h、24h、48h三个采样时间点重复,每个采样时间点再设置3个样品重复。表3为本试验活性酵母的添加方案。

表2 试验动物日粮组成及营养成分
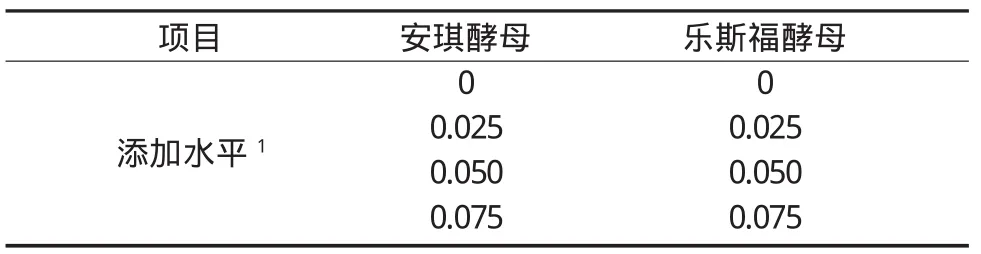
表3 活性酵母添加方案 (单位:%)
1.3.1体外发酵培养液的配制及预处理 按照Menke与Steingass[14]的方法于体外发酵前一天配制瘤胃体外发酵厌氧缓冲液。在晨饲前通过瘘管采集奶牛瘤胃液,用四层纱布过滤后与厌氧缓冲液以1∶9的比例充分混合成发酵培养液。混合好的培养液在发酵前迅速通入CO22-3min后,置于39℃的水浴摇床上等待培养[15]。
1.3.2发酵准备及培养 于体外发酵前24h预先在各厌氧发酵瓶中称取0.5±0.0003 g底物,在39℃恒温培养箱中放置过夜。并于体外发酵前24h预先将活性干酵母粉用蒸馏水配制成溶液。次日向发酵瓶中持续通入CO22min,随即先后加入已配制好的不同梯度的酵母溶液和50ml体外发酵培养液,并再次持续通入CO23min,加上瓶塞后迅速使用针头放气将气压调节成0,此即0 h点的气压值。随后立即放置于39℃恒温培养箱中开始体外发酵48h。
1.3.3实验数据计算及样品采集分析
(1)体外发酵总产气量。分别于体外发酵中的0 h、1 h、2 h、4 h、6 h、12 h、24 h、48 h使用压力传感器(CYG130-12,昆山双桥传感器测控技术有限公司)测定发酵瓶内的气压,并将气压换算成为室温标准气压下的气体体积,换算公式为:
y=1.506x
其中1.506为实测压强与体积之间的换算系数,x为压强,y为产气量。
将各时间点测得总产气量运用LE体外发酵产气模型[16]进行拟合,计算动态发酵产气参数。模型公式如下:
y=vf*[1-exp(d-t*k)]/[1+exp(b-k*t)]
上式中y表示t时间点底物的产气量(m l);vf表示理论最大产气量(m l);k表示产气分率;b和d是曲线的形状指标,b>0表示曲线为s形,b<0则表示曲线非s形。
另有计算公式:
FRD0=k/[1+exp(b)]
t0.5={ln[2+exp(b)]}/k
FRD0表示发酵初期气体产生速率;t0.5表示达到最大产气量一半所需的发酵时间[17]。
(2)体外发酵干物质消失率(DMD)。分别于体外发酵中的12 h、24 h、48 h取出发酵瓶,发酵液过400目尼龙布后将残渣全部转移至石英坩埚中用热蒸馏水反复冲洗,随后置于105℃烘箱中烘干8 h以测定干物质消失率。测定过干物质消失率后的残渣回收用样品袋密封保存,以备DM消失率的测定。
DMD=[1-(m/M)]×100%
式中m表示发酵后底物干物质质量;M表示发酵前底物干物质质量。
(3)体外发酵中性洗涤纤维消失率(NDFD)。NDF的测定方法参照Hall等的方法[12],使用Fibretherm FT12全自动纤维仪(GerhardtAnalyticalSystems,Germany)进行测定。
NDFD=[1-(m2/m1)]×100%
式中m1表示发酵前底物中含有的NDF质量,m2表示发酵后底物中剩余的NDF质量。
(4)体外发酵液pH值。分别于体外发酵中的12 h、24 h、48 h取出发酵瓶,每瓶取出2ml发酵液立即用pH计(REX PHS-3C,上海仪器设备厂)测定其pH值。
(5)体外发酵液NH3-N浓度。分别于体外发酵中的12 h、24 h、48 h取出发酵瓶,每瓶取出2m l发酵液用于NH3-N浓度的测定。按照冯宗慈等改进的比色法[18],使用UV2450紫外可见分光光度计(Shimadzu Corporation,Japan)进行测定。
1.4 试验数据统计及分析
试验数据采用SAS(8.2版)的MIXED过程统计,不同活性酵母间的差异与相同活性酵母不同添加水平间的差异采用CONTRAST语句进行比较。统计差异显著性定义为P<0.05。
2 结果与分析
2.1 两种酵母不同添加水平对粗饲料体外发酵产气量和相关参数的影响
2.1.1两种酵母不同添加水平对玉米秸秆体外发酵产气量和相关参数的影响 图1与图2分别为以玉米秸秆为发酵底物时,安琪和乐斯福两种酵母不同添加水平对体外发酵产气曲线的影响。

图1 安琪酵母不同添加水平对玉米秸秆体外发酵产气量的影响
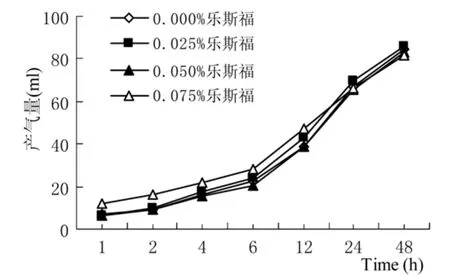
图2 乐斯福酵母不同添加水平对玉米秸秆体外发酵产气量的影响
表4为以玉米秸秆为发酵底物时,安琪和乐斯福两种酵母不同添加水平对体外发酵产气相关参数的影响。

表4 安琪酵母与乐斯福酵母不同添加水平对玉米秸秆体外发酵相关产气参数的影响
通过图1、图2和表4可以看出,以玉米秸秆作为发酵底物时,添加安琪和乐斯福两种酵母对体外发酵参数Vf值、d值、k值、FRD0值和 t0.5值均无显著影响(P>0.05),而添加乐斯福酵母的发酵参数b值显著低于安琪酵母(P<0.05)。安琪酵母不同添加水平对Vf值、b值、d值和k值均无显著影响(P>0.05);而对FRD0值和t0.5值均存在显著的一次效应(P<0.05)。乐斯福酵母不同添加水平对Vf值没有显著影响(P>0.05);而对b值、FRD0值和t0.5值均存在显著的三次效应(P<0.05),对d值和k值均存在显著的二次效应(P<0.05)。酵母类型与添加水平对Vf值、d值和k值均没有表现出显著的互作效应(P>0.05);而对b值、FRD0值和t0.5值表现出显著的互作效应(P<0.05)。随着安琪酵母添加水平的增加,FRD0值呈显著的增加趋势,当添加水平为0.075%时达到最大;而t0.5值则呈显著的下降趋势,当添加水平为0.075%时达到最小。
2.1.2两种酵母不同添加水平对水稻秸秆体外发酵产气量和相关参数的影响 安琪和乐斯福两种酵母不同添加水平对水稻秸秆体外发酵产气曲线的影响如图3、图4所示。
以水稻秸秆为发酵底物时,安琪和乐斯福两种酵母不同添加水平对体外发酵产气相关参数的影响如表5所示。
通过图3、图4和表5可以看出,以水稻秸秆作为发酵底物时,添加安琪和乐斯福两种酵母对各体外发酵参数均无显著影响(P>0.05)。乐斯福酵母不同添加水平对体外发酵各参数均存在显著的三次效应(P<0.05),各参数随添加水平的升高呈先降低、随后升高、又再次降低的趋势。安琪酵母不同添加水平对Vf值、b值和FRD0值均无显著影响(P>0.05);而对d值存在显著的二次效应(P<0.05),对k值和t0.5值存在显著的一次效应(P<0.01)。酵母类型与添加水平对Vf值和t0.5值表现出显著的互作效应(P<0.05),对d值和FRD0值表现出极显著的互作效应(P<0.01);而对b值和k值没有表现出显著的互作效应(P>0.05)。随着乐斯福酵母添加水平的增加,FRD0值呈整体上升趋势,当添加水平为0.075%时FRD0值达到最大。
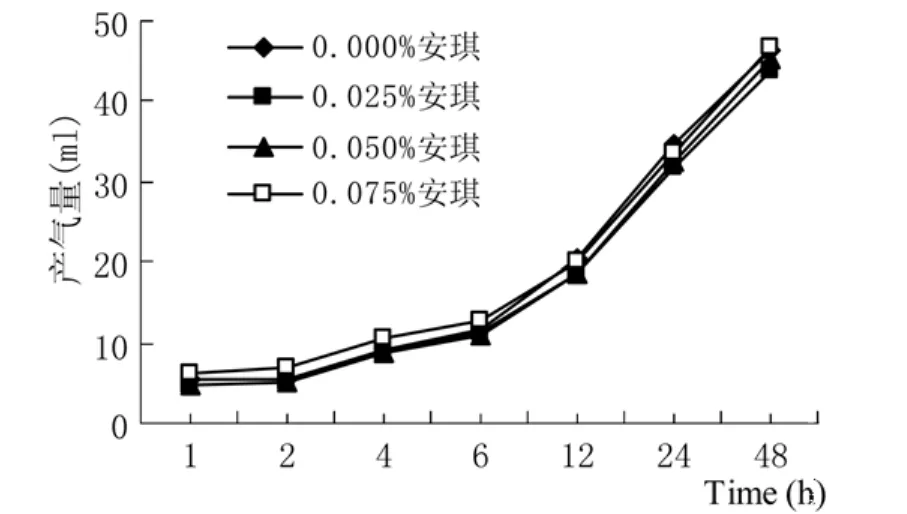
图3 安琪酵母不同添加水平对水稻秸秆体外发酵产气量的影响
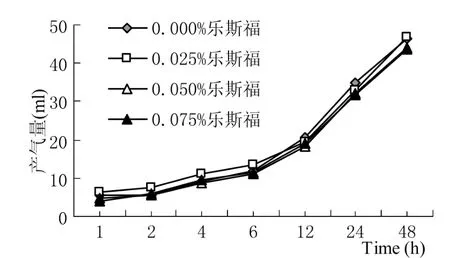
图4 乐斯福酵母不同添加水平对水稻秸秆体外发酵产气量的影响
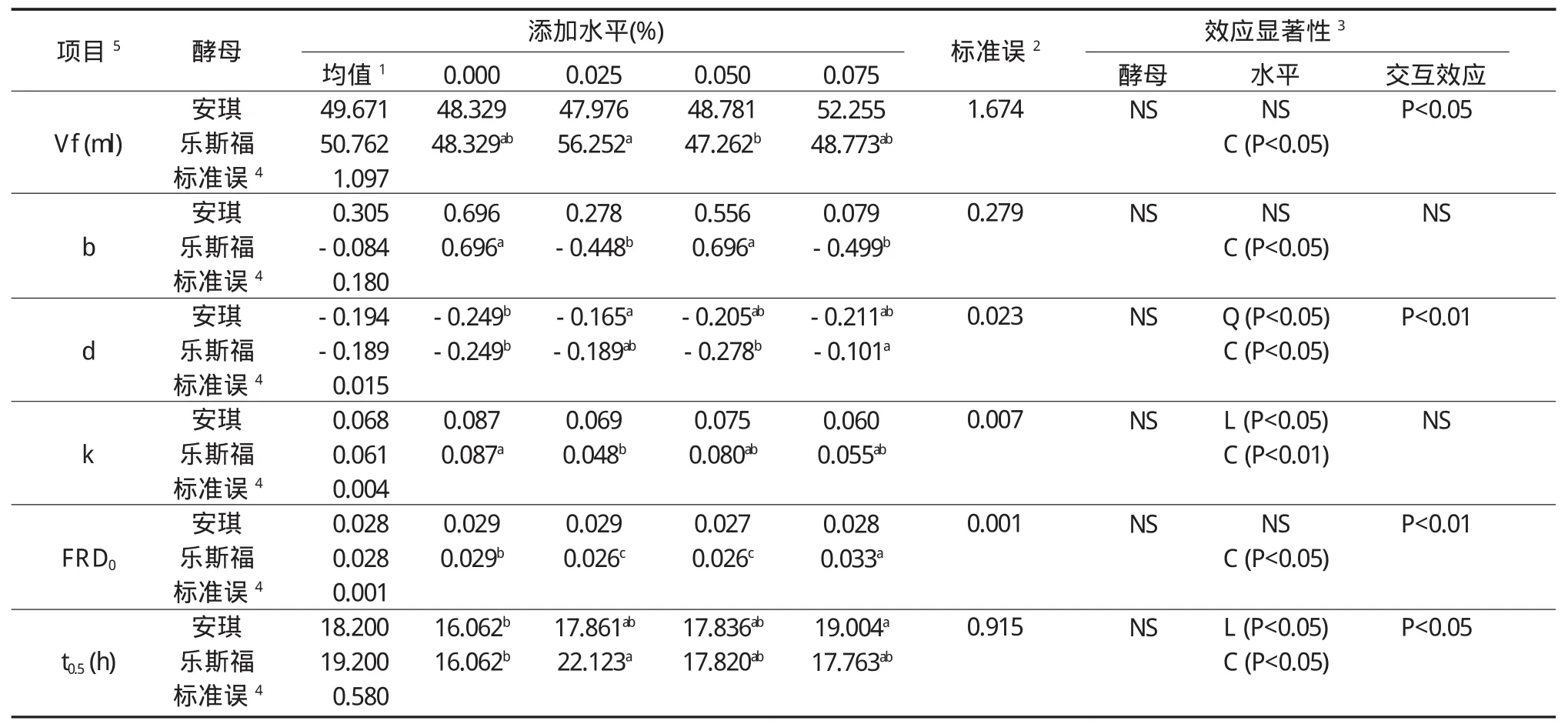
表5 安琪酵母与乐斯福酵母不同添加水平对水稻秸秆体外发酵相关产气参数的影响
2.2 两种酵母不同添加水平对粗饲料体外发酵DMD和NDFD的影响
2.2.1两种酵母不同添加水平对玉米秸秆体外发酵DMD和NDFD数的影响 以玉米秸秆为体外发酵底物时,安琪和乐斯福酵母不同添加水平对DMD和NDFD的影响见表6。
通过表6可以得出,添加乐斯福酵母时玉米秸秆的DMD显著高于添加安琪酵母(P<0.05),但两种活性酵母不同添加水平之间玉米秸秆DMD并不存在显著性差异(P>0.05),同时DMD呈随乐斯福酵母添加水平提高而升高的趋势。酵母与添加水平之间也未表现出显著的交互效应(P>0.05)。酵母类型对NDFD没有显著影响(P>0.05),乐斯福酵母添加水平和酵母与添加水平之间的互作均对NDFD没有显著性影响;但安琪酵母添加水平对NDFD的影响呈极显著的二次效应(P<0.01)。

表6 安琪与乐斯福酵母不同添加水平对玉米秸秆体外发酵DMD和NDFD的影响
2.2.2两种酵母不同添加水平对水稻秸秆体外发酵DMD和NDFD数的影响 添加两种酵母对水稻秸秆体外发酵DMD及NDFD的影响如表7所示。
通过表7可知,两种酵母对水稻秸秆DMD的影响达到了极显著水平(P<0.01),并且酵母和添加水平之间亦存在极显著的交互效应(P<0.01);安琪酵母不同添加水平对水稻秸秆DMD无显著影响(P>0.05),而乐斯福酵母添加水平对DMD的影响呈极显著的一次效应(P<0.01)。对于NDFD而言,两种酵母、酵母添加水平以及酵母和添加水平的交互效应对NDFD均无显著影响(P>0.05)。

表7 安琪酵母与乐斯福酵母不同添加水平对水稻秸秆体外发酵DMD和NDFD的影响
2.3 两种酵母不同添加水平对粗饲料体外发酵pH和NH3-N的影响
2.3.1两种酵母不同添加水平对玉米秸秆体外发酵pH和NH3-N的影响 表8所示为以玉米秸秆为发酵底物时,添加安琪和乐斯福两种酵母对体外发酵液pH和NH3-N的影响。
由表8可以得出,添加两种酵母对以玉米秸秆为底物的体外发酵液pH值无显著性影响(P>0.05),酵母与添加水平之间的互作效应也未达到显著性水平(P>0.05),安琪酵母各添加水平之间对pH值表现出极显著的一次效应(P<0.01),而乐斯福酵母各添加水平之间对pH值则表现出显著的二次效应(P<0.05)。对NDFD而言,两种酵母、酵母添加水平以及酵母和添加水平的交互效应对NDFD均无显著影响(P>0.05)。
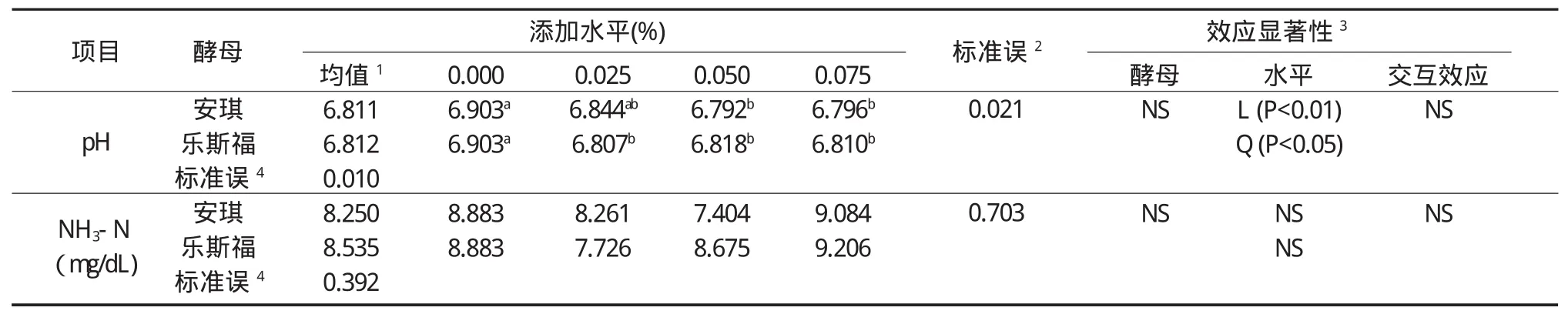
表8 安琪酵母与乐斯福酵母不同添加水平对玉米秸秆体外发酵pH和NH3-N的影响
2.3.2两种酵母不同添加水平对水稻秸秆体外发酵pH和NH3-N的影响 以水稻秸秆作为发酵底物时,添加安琪和乐斯福两种酵母对体外发酵液pH和NH3-N的影响如表9所示。
通过表9可以发现,添加安琪和乐斯福两种酵母对以水稻秸秆为底物的体外发酵液pH值和NH3-N浓度均有显著影响(P<0.05),且两种酵母添加水平、酵母和添加水平的交互作用对pH值和NH3-N浓度呈显著影响(P<0.05)。安琪酵母不同添加水平间的pH值和NH3-N浓度均表现出显著的二次效应(P<0.05),乐斯福酵母各添加水平间的pH值和NH3-N浓度则呈现出极显著的一次效应(P<0.01)。
3 结论与讨论
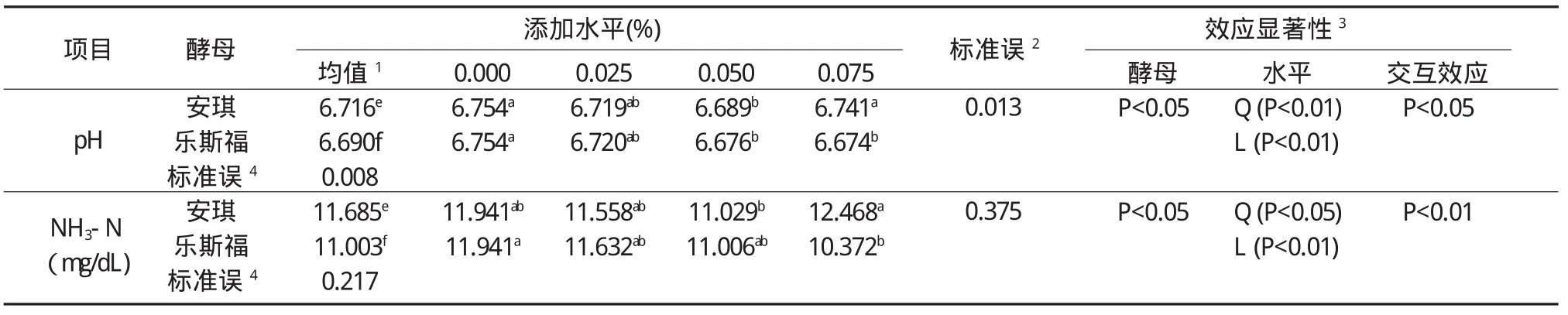
表9 安琪酵母与乐斯福酵母不同添加水平对水稻秸秆体外发酵pH和NH3-N的影响
3.1 结论
本试验通过奶牛瘤胃体外发酵技术,初步探究并比较了安琪酵母与乐斯福酵母对于瘤胃发酵特性的影响。得出以下结论:
(1)添加安琪和乐斯福两种酵母对玉米秸秆和水稻秸秆两种底物体外发酵的产气量和LE产气参数均无显著影响,然而均显著地提高了玉米秸秆和水稻秸秆的DMD。
(2)添加两种酵母对以玉米秸秆为发酵底物的体外发酵液pH值及NH3-N浓度均未表现出显著性效应,但是分别显著地降低了以水稻秸秆为发酵底物的体外发酵液pH值及NH3-N浓度。乐斯福酵母对于以玉米秸秆和水稻秸秆DMD的提高作用均显著高于安琪酵母;对NH3-N浓度的降低作用也显著地高于安琪酵母。
(3)从总体数据结果来看,水稻秸秆的发酵效果要好于玉米秸秆;乐斯福酵母的添加效果要明显优于安琪酵母,并且0.075%为其最佳添加水平。
3.2 讨论
体外发酵产气量一定程度上可以反映出发酵底物为瘤胃微生物所利用的程度[19],因此通过测定两种酵母不同添加水平下体外发酵的产气量,可以粗略地估计其对于DMD的影响。本试验研究结果显示,添加活性酵母并未对以玉米秸秆和水稻秸秆为底物的体外发酵产气量产生显著性影响,且目前也缺乏与之相关的研究报告与本试验的这一结果进行比较。FRD0表示体外发酵12h之前的发酵初期产气速率,t0.5值则表示产气量达到最大理论产气量一半所需要的发酵时间[17]。本试验以玉米秸秆为底物的体外发酵中,FRD0值均表现出随着两种活性酵母添加水平的提高而增大的趋势,且t0.5值也表现出随着酵母添加水平的提高而减小的趋势,这一现象表明随着两种酵母添加水平的提高,在发酵前期均能加快玉米秸秆降解速率、进而加快产气速率、增加产气量的趋势,而这一趋势之所以未能达到显著水平,可能是因为试验中酵母的添加水平还不足以导致显著性影响。在以水稻秸秆为底物的体外发酵中,添加两种酵母却有增大t0.5值的趋势,表明两种酵母有降低发酵前期产气量的趋势。玉米秸秆与水稻秸秆两者之间的这一差别可能与两种底物之间的营养成分差异相关。
DM和NDF降解率是体现瘤胃发酵过程中粗饲料利用率的重要指标。在本试验中,添加酵母显著地提高了玉米秸秆的DMD,并极显著地提高了水稻秸秆的DMD。有研究表明添加酵母菌能够增加瘤胃中纤维分解菌的数量[20],而纤维分解菌所分泌的纤维素酶能够显著的提高粗饲料体外发酵的DMD[21],本试验的这一结果与之相吻合。另外,一般认为发酵产气量与DMD紧密相关[22],但本试验中添加酵母并未对体外发酵产气量产生显著性影响,这可能是因为本试验所选用的两种酵母改变了底物的降解方式,从而使底物更多地通过生成气体(CO2、CH4等)较少的反应途径实现降解。尤其当以玉米秸秆为发酵底物时,添加乐斯福酵母的DMD要显著高于安琪酵母;而以水稻秸秆为发酵底物时,添加乐斯福酵母的DMD更是极显著地高于安琪酵母,这说明乐斯福酵母对于粗饲料降解的效果要明显优于安琪酵母。然而,不管是以玉米秸秆作为发酵底物或是以水稻秸秆作为发酵底物,添加两种酵母对两者的NDFD均无显著性作用。这种结果的出现一方面可能是因为本试验所选用的两种酵母并不能增强NDF相关酶的分泌或活性;另一方面也有可能是本试验酵母的添加水平还不足以导致对NDFD的显著性影响。
瘤胃pH值是评价瘤胃发酵状况的基本指标,决定着瘤胃微生物对底物的发酵利用效率[23]。维持正常的瘤胃pH值是保证瘤胃正常发酵的必要前提,而奶牛瘤胃液pH值的正常范围为5.5-7.5[24]。Van Houtert认为,瘤胃微生物最大生长速度的pH值在5.7以上[25]。本试验以玉米秸秆作为发酵底物时,所有的pH值都处于正常范围内;以水稻秸秆作为发酵底物时,乐斯福酵母处理组的pH值显著的低于安琪酵母处理组,并且随着添加水平的升高而逐渐降低,所有处理的pH值也均处于正常范围内。这说明添加酵母对于维持瘤胃内环境的稳衡具有一定的积极作用。
瘤胃NH3-N浓度在一定程度上反映出特定日粮条件下蛋白质降解与合成间的平衡状态[26],NH3-N是瘤胃微生物合成微生物蛋白和机体蛋白的主要原料,其最佳浓度范围为63-275mg/L[27-29]。本试验中各处理组的NH3-N浓度均落在最佳范围之内,并且以水稻秸秆作为发酵底物时,乐斯福酵母处理组的NH3-N浓度要显著低于安琪处理组,并且随着添加水平的提高而降低;而前面已经提到以水稻秸秆作为底物时,乐斯福酵母处理组的DMD要极显著高于安琪酵母组,而且随着添加水平的提高而升高。这一联系表明NH3-N浓度与DMD之间可能存在有密切的关联,可能是因为添加乐斯福酵母提高了DMD而加快了物质与能量的代谢进程,从而需要更多的微生物蛋白及机体蛋白以维持代谢平衡,因此促进了对NH3-N的利用而降低了NH3-N浓度,但是此推测需要足够的相关试验研究加以论证。
本试验初步探究并比较了两种酵母对奶牛瘤胃两种底物体外发酵的影响,然而酵母作用于瘤胃发酵特性的具体途径及机制还不够明确,这还有待于通过进一步的体外试验以及动物试验而得到更充分更透彻的研究。
[1]李声永,王加启,龚月生,等.酵母培养物在反刍动物日粮中的应用研究进展[J].中国畜牧兽医,2002,29(5):18-22.
[2]Galvão K N,Santos JE,CoscioniA,etal.Effectof feeding live yeast products to calveswith failureofpassive transfer on performance and patterns of antibiotic resistance in fecal Escherichia coli[J].Reproduction Nutrition Development,2005,45(4):427-440.
[3]Estefan A G.Feedyard performance and carcass traits of cattle as influenced by stocker phase implant strategy and yeast culture(Saccharomyces cerevisiae8×109CFU/g;BIOSAF)supplementation during the feedyard phase[D].PhD.Thesis.Texas A&M University.Amarillo.1999.
[4]Edwards I E,Toops J H,El Sheikh M,et al.The response of Limousine×Friesian steers fed silage and concentrates to the addition of supplemental yeast culture(Yea-Sacc)and/or an antibiotic additive(Avotan)[J].Journal of Animal Production,1991,51:588.
[5]Newbold C J,Wallace R J,Chen X B,et al.Different strains of Saccharomyces cerevisiae differ in their effects on ruminal bacterial numbers in vitro and in sheep[J].Journal of Animal Science,1995,73(6):1811-1818.
[6]Chaucheyras-Durand F,Walker N D,Bach A.Effects of active dry yeastson the rumenmicrobial ecosystem:Past,presentand future[J].Animal Feed Scienceand Technology,2008,145(1):5-26.
[7]Bach A,Iglesias C,Devant M.Daily rumen pH pattern of loose-housed dairy cattle as affected by feeding pattern and live yeast supplementation[J].Animal Feed Science and Technology,2007,136(1):146-153.
[8]Moallem U,Lehrer H,Livshitz L,et al.The effects of live yeast supplementation to dairy cows during the hot season on production,feed efficiency,and digestibility[J].Journal of Dairy Science,2009,92(1):343-351.
[9]Jouany JP.A new look atyeastcultureas probiotics for ruminants[J].Feed Mix,2001,9(6):17-19.
[10]Jouany JP.Optimizing rumen functions in the close-up transition period and early lactation to drive dry matter intake and energy balance in cows[J].Animal Reproduction Science,2006,96(3):250-264.
[11]杨胜.饲料分析及饲料质量检测技术[M].北京:北京农业大学出版社,1993.
[12]Hall M B,Pell A N,Chase L E.Characteristics of neutral detergent-soluble fiber fermentation bymixed ruminalmicrobes[J].Animal Feed Scienceand Technology,1998,70(1):23-39.
[13]National Research Council(U.S.).Subcommittee on Dairy Cattle Nutrition.Nutrient requirementsofdairy cattle[M].Washington,D.C.:NationalAcademies Press,2001.
[14]Menke K H,Steingass H.Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J].AnimalResearchand Development,1988,28:7-55.
[15]Menke K H,Raab L,Salewski A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquor i n vitro[J].Journal of Agricultural Science,1979,93(1):217-222.
[16]Wang M,Tang S X,Tan Z L.Modeling in vitro gas production kinetics:Derivation of Logistic-Exponential(LE)equations and comparison of models[J].Animal Feed Science and Technology,2011,165(3):137-150.
[17]Wang M,Sun X Z,Tang S X,et al.Deriving fractional rate of degradation of logistic-exponential(LE)model to evaluate early in vitro fermentation[J].Animal,2013,7(6):1-10.
[18]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,2010,31(6-7):37.
[19]Metzler-Zebeli B U,Scherr C,Sallaku E,et al.Evaluation of associative effectsof totalmixed ration for dairy cattleusing in vitro gasproduction and different rumen inocula[J].Journalof theScience of Food and Agriculture,2012,92(12):2479-2485.
[20]Khampa S,Chaowarat P Singhalert R,et al.Supplementation of malate and yeast in concentrate containing high cassava chip on rumen ecology in dairysteers[J].Pakistan JournalofNutrition,2009,8(5):592-596.
[21]Colombatto D,Morgavi D P,Furtado A F,et al.Screening of exogenous enzymes for ruminant diets:relationship between biochemical characteristics and in vitro ruminal degradation[J].JournalofAnimalScience,2003,81(10):2628-2638.
[22]Hristov A N,Mcallister T A,Cheng K J.Effect of dietary or abomasal supplementation of exogenous polysaccharide-degrading enzymeson rumen fermentation and nutrientdigestibility[J].Journal ofAnimalScience,1998,76(12):3146-3156.
[23]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[24]Marie K K,Oetzel G R.Understanding and preventing subacute ruminal acidosis in dairy herds:a review[J].Animal Feed Science and Technology,2006,126(3):215-236.
[25]Van HoutertM F J.The production andmetabolism of volatile fatty acidsby ruminants fed roughages:a review[J].Animal Feed Science and Technology,1993,43(3):189-255.
[26]McDonald I.A revised model for the estimation of protein degradability in the rumen[J].Journalof Agricultural Science,1981,96(1):251-252.
[27]Ortega M E,Stern M D,Satter L D.The effect of rumen ammonia concentrate on drymatter disappearance in situ[J].Journal of Dairy Science,1979,62(Suppl.1):76-79.
[28]Murphy JJ,Kennelly JJ.Effectofprotein concentration and protein source on the degradability of dry matter and protein in situ[J].JournalofDairy Science,1987,70(9):1841-1849.
[29]Suwanlee S,WanapatM.Effectof ruminalNH3-N levelson ruminal fermentation,purine derivatives,digestibility and rice straw intake inSwamp Buffaloes[J].Asian-Australasian JournalofAnimalSciences,1999,12(6):904-907.
