泡桐属植物遗传多样性的FISH-AFLP分析
2014-04-14李翰书卢妍妍李海英茹广欣杨永红
李翰书,卢妍妍,李海英,2,茹广欣,杨 阳,候 婷,杨永红
(1.河南农业大学林学院,河南郑州450002;2.华北水利水电学院,河南郑州450002)
泡桐属(Paulownia)属于玄参科(Scrophulariaceae)落叶乔木,原产于中国,在全国23个省、市、自治区均有分布,是重要的速生优质用材树种和绿化树种.由于泡桐材质轻软,不翘裂,胀缩性小,是优质的家具用材和装饰用材[1].另外,由于泡桐的叶、花、果、树皮还具有良好的药用价值,因此,泡桐占有重要的国民经济地位.关于泡桐属植物的栽培、育种以及依据外部形态指标进行的种间亲缘关系探讨已做了比较深入研究[2],但由于表型性状经常会受环境因素的影响而发生变化,有些情况下表型变化并不能真实反映遗传变异,要更加准确、细致地理解种群的遗传变异状况,仅仅依赖表型性状是远远不够的,还必须进行更深层次的研究,并加以比较和验证[3].目前对泡桐在分子水平上的分类只有卢龙斗等[4]运用RAPD分析方法将泡桐属7种植物分为白花泡桐、川泡桐、楸叶泡桐、南方泡桐、山明泡桐组和毛泡桐、兰考泡桐组2大类群;马浩等[5]利用RFLP分子标记法对泡桐属15个植物的叶绿体DNA进行分析,最终将研究材料分为南方泡桐组、毛泡桐组和白花泡桐组;莫文娟等[6]则运用ISSR分子标记对泡桐属21份种、变种及变型材料进行亲缘关系分析,最终将供试材料分为3大类群,分别是台湾泡桐和川泡桐;白花泡桐、南方泡桐2、南方泡桐1、南方泡桐3、鄂川泡桐、建始泡桐和成都泡桐;兰考泡桐1、兰考泡桐2、山明泡桐2、山明泡桐1、白花兰考泡桐、楸叶泡桐2、楸叶泡桐l、圆冠泡桐、宜昌泡桐、亮叶毛泡桐、毛泡桐l和毛泡桐2.上述所得结论存在一定差异,种群之间的分类仍存在较多争议.扩增片段长度多态性(amplified fragment length polymorphism AFLP),结合了RFLP和RAPD技术的优点,扩增条带丰富、多态性高、重复性好是目前综合效应较高的分子标记方法.目前广泛应用于种质资源研究[7~11]、系统分类[12,13]、遗传多样性检测[14~16]以及遗传图谱的构建和基因定位等方面,已成为材料间遗传多样性和分类研究的有效手段[17].但有关AFLP技术在泡桐上的应用还未见报道,本研究旨在利用FISHAFLP分子标记技术,研究探讨泡桐属植物种间的亲缘关系,为该属植物的系统分类和遗传育种提供更可靠的理论依据.
1 材料与方法
1.1 材料与试剂
试验所用材料(表1)采自江西九江共青城泡桐种源育种基地,每份材料选取3~5片新鲜嫩叶,置于采样箱中带回实验室,-20℃保存备用.

表1 供试材料Table 1 Materials tested in the experiment
本试验所用试剂:Taq酶(2 U·μL-1)、dNTPs(10 mmol·L-1)、引物(10 mmol·L-1)以及 B002-1 Marker,DGL 2000 Marker均由北京鼎国昌盛生物技术有限责任公司提供,内切酶(10 U·μL-1)、T4连接酶(5 U·μL-1)及ROX 500相对分子质量内标则分别购自NEB公司和ABI公司.试验所用接头和扩增引物序列详见表2.
1.2 总DNA的制备及检测
参照DOYLE等[18]经典的CTAB法略加改动提取DNA总基因组并加以纯化.具体方法:称取泡桐叶片50 mg,液氮研磨成粉状,并将粉末转移到装有800 μL 2×CTAB提取液的2 mL离心管中,加入60 μL巯基乙醇混匀,60℃预热30 min,其间混匀2~3次,取出样品于室温放置,待样品冷却到室温加入800 μL[V(氯仿)∶V(异戊醇)=24∶1],振荡混匀,12 000 r·min-1离心15 min,取上清液到另一新2 mL离心管,加入等体积的氯仿与异戊醇[V(氯仿)∶V(异戊醇)=24∶1],振荡混匀,12 000 r·min-1离心15 min,取上清液到新的2 mL离心管中加入1.5倍体积1×CTAB沉淀液,放置20 ~30 min,12 000 r·min-1离心 15 min 将沉淀晾干溶于 200 μL TE-buffer(溶解),加入 400 μL 95% 乙醇,20 μL 3 mmol·L-1乙酸钠,-20 ℃ 沉淀1 h后4 ℃ ,12 000 r·min-1离心 15 min,加入500 μL 75% 乙醇洗涤,12 000 r·min-1离心10 min后加入 30 ~50 μL TE-buffer稀释,经 0.8%琼脂糖凝胶电泳检测后-20℃保存备用,使用前将其稀释为 50 mg·L-1.

表2 扩增引物序列及名称Table 2 The sequences and name of the amplification primer
1.3 AFLP 分析
1.3.1 限制性酶切及连接反应 采用北京鼎国生物技术公司的试剂盒,按照其操作指南酶切连接一步进行.在20 μL反应体系中含有DNA模板(50 mg·L-1)4 μL,Adapter 1 μL,PstI和 MseI 2 μL,10×Reaction buffer 2.5 μL,10 mM ATP 2.5 uL,T4 Ligase 1 μL,AFLP-Water7 μL.将上述混合液混匀离心数秒,37℃保温5 h,8℃保温4 h,4℃过夜.
1.3.2 预扩增 参照马庆国等[17]的16个早实核桃良种遗传多样性AFLP分析的预扩增体系及预扩增程序,将预扩产物经1∶20稀释后作为选扩模板.
1.3.3 选择性扩增 用筛选出的9对引物组合(表2)经荧光标记后进行选择性扩增(对MseI引物的5’端进行荧光标记).25 μL扩增体系中含有2 μL 预扩稀释样品,2.5 μL 10 × PCR buffer,0.5 μL dNTPs,PstI和 MseI引物各 1 μL,0.5 μL Taq酶,最后用ddH2O补足体系.将上述体系混匀,离心数秒后参照宁德鲁等[19]的云南省核桃品种遗传多样性的FISH-AFLP扩增程序进行选择性扩增.
1.4 电泳与数据分析
将选择扩增后的样品在ABI 377自动测序仪上电泳分离检测[20],然后把14份供试材料9对荧光引物产生的电泳凝胶图通过GeneScan 3.1软件转换为“0/1”矩阵(即根据凝胶上不同材料同一位置条带的有无进行统计,有带记为“l”,无带记为“0”).对原始矩阵用 NT-SYSpc 2.10 软件进行数据分析,通过SimQual程序求相似系数,并获得相似系数矩阵;用SHAN程序中的UPGMA进行聚类分析,并通过Treeplot模块生成聚类图.
2 结果与分析
2.1 泡桐属植物叶片DNA的检测结果
所提取的泡桐属植物基因组DNA通过DG-III双稳数显电泳仪在电压180 V,电泳时间1 h条件下经1.5%的琼脂糖凝胶电泳检测结果如图1所示,所提取的DNA有较清晰的电泳条带,可用于AFLP扩增.
2.2 泡桐属植物叶片DNA的多态性分析
从64对引物组合中筛选出扩增产物稳定、重复性好、多态性高且分辨能力强的引物组合[20],利用所选出的9对引物组合(表3)对14份供试材料进行选择性扩增,获得了较好的扩增结果(图2).共检测到DNA片段1 171条,大小为70~500 bp,其中多态性条带1 158条,平均每个引物组合检测到多态性片段128.7条,平均多态性比率高达98.9%,这表明14份泡桐品种具有较高比例的多态性条带.其中引物组合P-GTG/M-CAG检测到的条带最多,171条均为多态性条带,多态性比例为100%;引物组合P-GAG/M-CAC共获得总条带115条,多态性条带 107条,多态性比例为93.04%,但在所选用的9对引物组合中多态性比例最低.可见,FISH-AFLP检测泡桐品种遗传多样性的效率很高,也充分体现了试验材料具有丰富的遗传多样性.

图1 泡桐属植物基因组DNA电泳Fig.1 Gel electrophoretogram of the genus Paulownia genomic DNA
2.3 泡桐属种间聚类与遗传关系分析
利用NT-SYSpc 2.10软件计算泡桐属植物种间遗传相似系数并基于UPGMA法绘制泡桐属种质间亲缘关系树状图(图3).由图3可知,当阈值为0.675时,可将14份供试材料分成Ⅳ个类群.其中,类群Ⅰ包括白花泡桐、台湾泡桐、南方泡桐、山明泡桐、宜昌泡桐、鄂川泡桐、兰考泡桐、建始泡桐以及白花兰考泡桐;类群Ⅱ包括毛泡桐、亮叶毛泡桐以及川泡桐;类群Ⅲ和Ⅳ均由1个泡桐种群组成,分别为楸叶泡桐和成都泡桐.

表3 不同引物组合在泡桐种群中的多态位点比率Table 3 The polymorphic ratio of different primers combination in Paulownia species
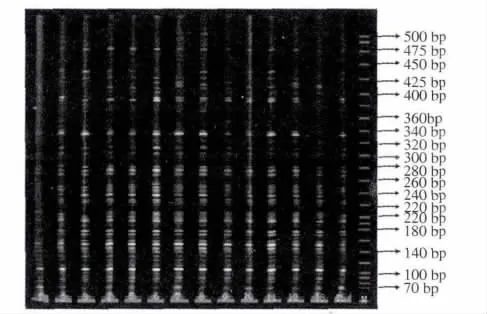
图2 引物组合P-GAT/M-CAG对14个泡桐属植物的AFLP扩增结果Fig.2 Amplification results of primer combination P-GAT/M-CAG to 14 genus Paulownia plants
3 结论与讨论
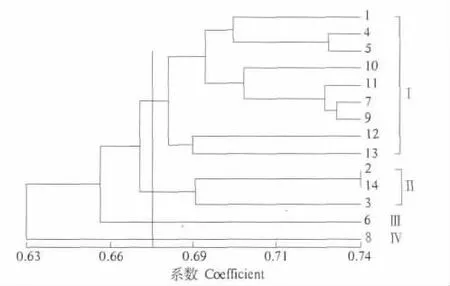
图3 14份泡桐属植物的聚类分析图Fig.3 Clustering analysis diagram of the 14 genus Paulownia plants
卢龙斗等[4]对泡桐属7种植物的RAPD分析中,选用13个引物共扩增出89条谱带,其中多态性谱带有63条,多态性比率为70.79%;莫文娟等[6]运用9条ISSR引物对泡桐属植物进行亲缘关系分析,共扩增出85条片段,多态性条带74条,多态性比率为87.05% .本试验采用 FISH-AFLP技术,运用9对引物组合对14份泡桐属植物进行了基因组DNA分子水平上的检测,共获得多态性条带1 158条,多态性百分率达98.89% ,表现出更高的检测效率,说明FISH-AFLP方法得到的信息量较大,是一种较好的用于分析遗传多态性和指纹图谱分析的标记方法[19].陈志远等[21]认为南方泡桐(Paulownia australis)和台湾泡桐(Paulownia kawakamii)应合为1种并将南方泡桐作为异名,本研究在DNA水平上提供了一定的理论基础,显示南方泡桐和台湾泡桐亲缘关系最近,被聚在1个亚群.同时,鄂川泡桐与兰考泡桐聚为1个亚群,这与陈志远等[21]鄂川泡桐应为南方泡桐与兰考泡桐的杂交种的观点一致.白花兰考泡桐是根据花冠颜色而定的[22],本试验结果也得出白花兰考泡桐与兰考泡桐聚为1组的结论,它们间的遗传相似系数比较大,也说明它们的亲缘关系较近.本研究同样在DNA水平上支持白花兰考泡桐为兰考泡桐的变型这一观点.陈志远等[21,23]的泡桐属植物同工酶分析及泡桐属的地理分布中均认为山明泡桐的谱带一部分与兰考泡桐相同,一部分与毛泡桐相同,因此得出结论,山明泡桐可能是兰考泡桐和毛泡桐的杂交种.本研究结果显示,山明泡桐与兰考泡桐被聚在1个亚群,支持了这一观点.1995年熊金桥等[2]用数量分类的方法对泡桐属植物的38个性状进行分析,并对所分析的种或变种进行了系统聚类,最终把该属植物分成3个组,即白花泡桐组:白花泡桐、兰考泡桐等;毛泡桐组:毛泡桐、川泡桐、南方泡桐等;楸叶泡桐组:楸叶泡桐、山明泡桐等.在本研究结果中,虽然山明泡桐没有归入楸叶泡桐组中,但从遗传相似系数可以看出二者的遗传一致度也比较大,这与熊金桥等[2]的研究结果基本相符.但在本研究中,成都泡桐和楸叶泡桐被单独聚为1组,且成都泡桐被聚在了最外类群,得出了与以往结果不一致的结论,还需要更进一步试验验证.
[1] 茹广欣,何瑞珍,朱秀红,等.泡桐无性系间木材性状的差异[J].河南农业大学学报,2007,41(5):531-535.
[2] 熊金桥.泡桐属的数量分类研究[J].植物研究,1992,12(2):185-188.
[3] 王 念,何 威,王文君,等.AFLP分子标记在泡桐遗传育种中的应用与前景[J].安徽农业科学,2008,36(1):151-153.
[4] 卢龙斗,谢龙旭,杜启艳,等.泡桐属七种植物的RAPD 分析[J].广西植物,2001,21(4):335-338.
[5] 马 浩,张冬梅,李荣幸,等.泡桐属植物种类的RFLP 分析[J].植物研究,2001,21(1):136-139.
[6] 莫文娟,傅建敏,乔 杰,等.泡桐属植物亲缘关系的ISSR 分析[J].林业科学,2013,49(1):61-67.
[7] 吴锦程,杨向晖,林顺权,等.枇杷AFLP分析体系的建立与应用[J].果树学报,2006,23(5):774-778.
[8] 雷新涛,王家保,徐雪荣,等.杧果主要品种遗传多态性的 AFLP标记研究[J].园艺学报,2006,33(4):725-730.
[9] 王同坤,柏素花,董超华,等.燕山板栗种质资源AFLP遗传多样性分析[J].分子植物育种,2007,5(1):121-127.
[10] 王永康,田建保,王永勤,等.枣树品种品系的AFLP分析[J].果树学报,2007,24(2):146-150.
[11] 闫 龙,关建平,宗绪晓,等.木豆种质资源AFLP标记遗传多样性分析[J].作物学报,2007,33(5):790-798.
[12] 易干军,余晓英,霍合强,等.粉蕉、大蕉和龙牙蕉的AFLP分类研究[J].园艺学报,2002,29(5):413-417.
[13] 张德强,张志毅,杨 凯,等.分子标记技术在杨树遗传变异及系统分类中的应用[J].北京林业大学学报,2001,23(1):76-80.
[14] 刘 萍,王子成,尚富德,等.河南部分牡丹品种遗传多样性的 AFLP分析[J].园艺学报,2006,33(6):1369-1372.
[15] 朱根发,李冬梅,郭振飞,等.大花蕙兰遗传多样性及亲缘关系的AFLP分析[J].园艺学报,2007,34(2):417-424.
[16] 程振家,王怀松,张志斌,等.甜瓜遗传多样性的AFLP分析[J].西北植物学报,2007,27(2):244-248.
[17] 马庆国,齐 静,裴 东,等.16个早实核桃良种遗传多样性的 FISH-AFLP分析[J].林业科学研究,2010,23(5):631-636.
[18] DOYLE J J,DOYLE D J.Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[19] 宁德鲁,马庆国,张 雨,等.云南省核桃品种遗传多样性的FISH-AFLP分析[J].林业科学研究,2011,24(2):189-193.
[20] 茹广欣,袁金玲,张 朵,等.运用AFLP技术分析筇竹种群遗传多样性[J].林业科学研究,2010,23(6):850-855.
[21] 陈志远.泡桐属的起源,演化与地理分布[J].武汉植物学研究,2000,18(4):325-328.
[22] 蒋建平.泡桐栽培学[M].北京:中国林业出版社,1990:17-43.
[23] 陈红林,陈志远,梁作侑,等.泡桐属植物同工酶分析[J].湖北林业科技,2003(2):1-4.
