磁珠富集法构建播娘蒿SSR文库及特性分析
2014-04-14王亚平焦振彬裴宋雨叶永忠王红卫
王亚平,焦振彬,裴宋雨,叶永忠,王红卫
(1.河南农业大学生命科学学院,河南 郑州450002;2.河南农业大学植物保护学院,河南郑州450002)
播娘蒿 (Descuminia sophia(L.)Webb.ex Prantl)为十字花科播娘蒿属1年生或2年生植物,俗名米米蒿,分布于北美洲、亚洲、欧洲及南美洲,在中国主要分布于华北、华东、西北和四川.其种子具有止咳平喘、消肿利尿、抗癌的功效[1],在调血脂、抗菌等方面也具有显著的药理活性[2].以播娘蒿种子为原料榨出的油可以作为食用油,含有约37%的α-亚麻酸,对人体的健康有重要作用[3];亦可作为工业用油,以播娘蒿籽油为原料制备出的脂肪酸甲酯,经冷冻处理后表现出和生物柴油相近的性质[4].播娘蒿种子含油 33% ~44%[5],无论是作为工业用油还是食用油,都具有较大的开发利用价值.因此系统开发和利用播娘蒿资源,能够很好的平衡人类对油料的需求.近年来,对播娘蒿的研究多集中在化学成分与生物学特性的分析上[6~9],关于播娘蒿遗传资源的研究鲜有报道.研究播娘蒿的遗传多样性,对今后播娘蒿野生资源的开发和利用十分必要.分子标记是研究植物资源的有效手段,其中SSR标记具有共显性、重复性强、多态性高、多态位点丰富等优点[10],它比其它分子标记如RFLP,RAPD,AFLP和ISSR虽然成本高,但能较好的运用于植物分类、群体遗传多样性研究和基因图谱的构建.传统的SSR文库构建策略不仅复杂,而且效率低,利用磁珠富集法构建SSR文库具有操作简单、效率高等优点.它的原理是用含有生物素标记的探针如(CA)10与基因组DNA酶切片段含SSR片段特异性杂交,而磁珠外边所包被的链霉素亲和素可以和探针上的生物素共价结合,通过磁珠的磁力直接将探针连同与之互补的含有SSR片段吸附[11].这种方法能显著缩短构建SSR文库的时间,并且极大的提高了效率.本研究即是利用Dynal磁珠富集法构建播娘蒿SSR文库,研究播娘蒿的遗传资源,为播娘蒿的资源研究和开发利用提供理论依据.
1 材料与方法
1.1 材料
播娘蒿材料是2012-04-18采自郑州北郊的黄河湿地国家级自然保护区,沿直线每隔50 m取样1次(共20份),采集的叶片加硅胶密封包装,干燥处理1周后用于提取DNA.干燥处理过程中,如发现硅胶变红,立即更换硅胶.
1.2 方法
1.2.1 酶切 本研究采用Dynal磁珠富集法构建播娘蒿SSR文库.首先采用改良的CTAB法[12]提取播娘蒿基因组DNA,纯化后利用内切酶Rsa I于16℃温度下酶切16 h.
1.2.2 连接 获得的酶切产物经琼脂糖凝胶检测后加上接头SuperSNX 24-F(5’-GTTTAAGGCCTAGCTAGCAGAATC)和 SuperSNX24-R(5’-pGATTCTGCAGCTAGGCCTTAAAC AAAA).对加接头产物进行 PCR扩增,反应体系25 μL,为10×PCR 缓冲液 2.5 μL,10 μmol·L-1SuperSNX24-F 1.3 μL,2 mmol·L-1dNTP 1.875 μL,双蒸水 18.3 μL,5 U·μL-1exTaq 0.2 μL,加接头的 DNA 2 μL.PCR程序为95℃预变性2 min,随后为95℃变性20 s,60℃退火20 s,72℃延伸90 s的24次循环,最后15℃保持10 min.PCR反应后进行琼脂糖凝胶检测,检测成功后进行富集工作.
1.2.3 富集 利用含有生物素标记的(AC)8,(AG)8和(ATG)12(由上海生工合成)探针与连接产物充分杂交,杂交后利用Dynal磁珠对杂交产物进行富集.采用PCR对富集DNA片段进行扩增,反应体系为 25 μL,10 × PCR 缓冲液 2.5 μL,1 000 mg·μL BSA 0.625 μL,10 μmol·L-1SuperSNX24-F 1.3 μL,2 mmol·L-1dNTP 1.875 μL,双蒸水 16.5 μL,5 U·μL-1exTaq 0.2 μL,富集 DNA 片段 2 μL.PCR程序为95℃预变性2 min,随后为95℃变性20 s,60℃退火20 s,72℃延伸90 s的24次循环,72℃充分延伸30 min后于15℃保持10 min.PCR反应后进行琼脂糖凝胶检测.
1.2.4 克隆及克隆筛选 将富集产物连接到pMD18-T上,转入DH 5α感受态细胞,在LB培养基上进行克隆培养,挑选阳性克隆转入液体LB培养基进行培养.利用SuperSNX 24-F引物对菌液克隆进行PCR检测,反应体系10 μL,包括2×PCR Taq Mix 5 μL,双蒸水 4 μL,10 μmol·L-1SuperSNX24-F 0.5 μL,菌液 0.5 μL.反应程序为94℃预变性10 min,随后进入30次循环,包括94℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,最后终延伸10 min,15℃保持10 min.选择插入片段长度为400~1 000 bp的克隆.
随后,采用 M13F,M13R 和(AC)8,(AG)8,(ATG)5探针相结合的方法对文库进行2次PCR扩增筛选,PCR 体系10.5 μL,包括2 ×PCR Taq Mix 5 μL ,双蒸水 3 μL,10 μmol·L-1M13R(F)0.5 μL,10 μmol·L-1(AC)80.5μL,10 μmol·L-1(AG)80.5 μL,10 μmol·L-1(ATG)50.5 μL.反应程序为94℃充分变性10 min,随后进入30次循环,包括94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,最后终延伸10 min,15℃保持10 min.对扩增出条带的克隆送样测序(此工作由华大基因完成).
1.3 数据处理
WEBER将SSR分为3种类型[13],完全型为核心序列以不间断的重复方式构成SSR;不完全型是核心序列之间有几个非重复碱基,但其两端的核心序列重复次数大于3;混合型为2种或2种以上的串联核心序列由几个连续的非重复碱基分隔开,但各种连续性的核心序列重复次数不少于5.测序后,统计SSR情况,柳属植物研究中,表现出多态性的二核苷酸基元重复次数在4次以上[14],本研究统计二核苷酸基元重复次数在4次以上的;三核苷酸及其以上基元统计重复次数在3次以上[15],计算完全型SSR,不完全型SSR以及混合型SSR各自所占的比例,以及平均单个克隆含有的SSR位点数等.
2 结果与分析
2.1 酶切结果
对纯化后的播娘蒿总基因组DNA利用内切酶Rsa I进行酶切,酶切产物集中在300~1 000 bp(图1),符合后续试验对DNA片段长度的要求.
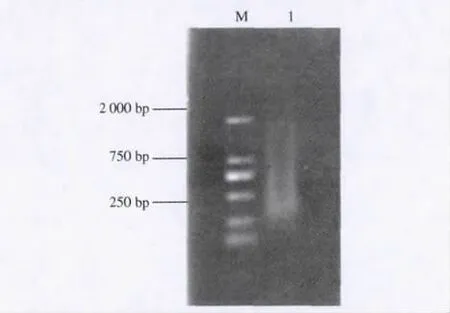
图1 播娘蒿基因组DNA Rsa I酶切产物Fig.1 The result of enzyme digestion of Descuminia sophia genomic DNA with RsaⅠ
2.2 连接结果
以SuperSNX24-F作为引物对连接产物进行PCR扩增,取2 μL产物进行1%琼脂糖凝胶电泳检测(图2).连接结果很成功,可以直接用于下一步富集.
2.3 富集
生物素标记的探针与加接头的DNA片段杂交,磁珠吸附后对富集片段进行PCR扩增,为增加富集产物浓度,做3管PCR,富集结果如图3,富集片段集中于500~800 bp,适用于构建SSR文库.

图2 连接产物检测结果Fig.2 PCR products of ligated DNA
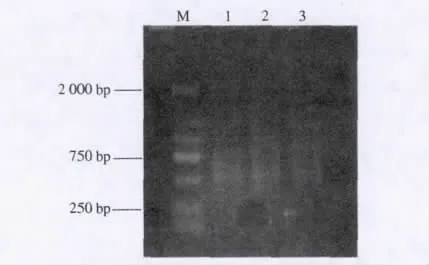
图3 富集产物PCR结果Fig.3 PCR products of microsatellite-enriched DNA
2.4 克隆筛选
将3管PCR合并纯化,与PMD18-T载体连接后转入感受态细胞在LB培养基上培养,共挑选774个阳性克隆至液体LB培养基,培养后进行菌液PCR扩增检测,检测结果如图4.为避免盲目测序,对有条带的菌液用 M13R(F)通用引物和(AC)8,(AG)8,(ATG)5探针相结合进行 2 次筛选,选取含有理想条带的克隆进行测序.
2.5 播娘蒿SSR统计
筛选获得93条插入片段为400~1 000 bp的克隆测序.经测序,82条序列含有SSR位点,占测序总条数的88.17%.共有SSR位点数127个,完全型SSR位点数目102个,不完全型SSR位点数目10个,混合型SSR位点15个.SSR重复单元(表1)中,以二核苷酸(TC/CT),(AC/CA),(TG/GT)和三核苷酸(TGA/GAT/ATG)最为常见,得率分别为 20.47%,26.77%,21.26%和 15.75%.
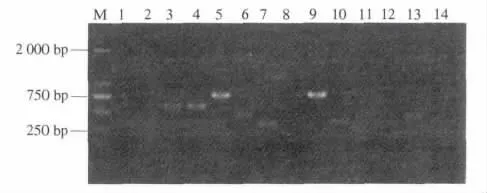
图4 菌液PCR检测结果Fig.4 PCR amplification of clones
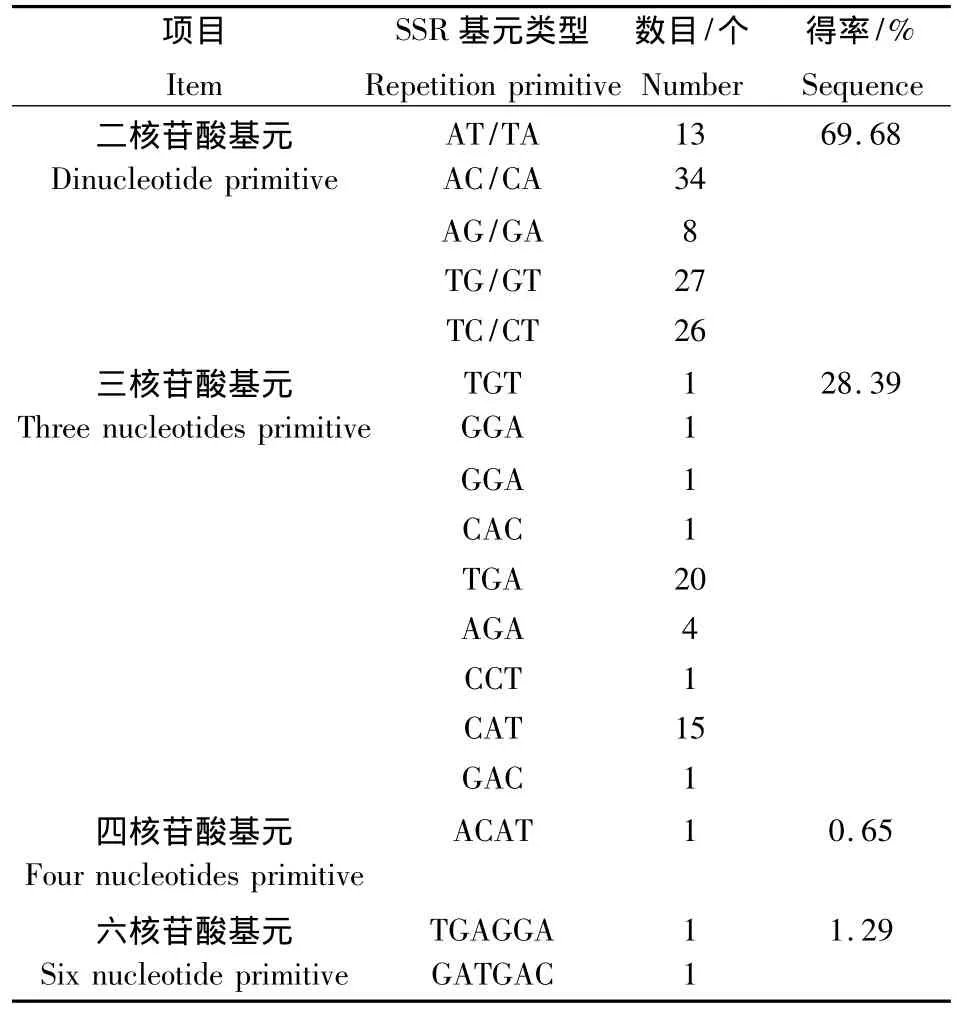
表1 播娘蒿微卫星富集文库基元类型及比例Table 1 Characteristics of the enriched library of Descuminia sophia in terms of the identified microsatellite sequences
本研究采用磁珠富集法构建播娘蒿SSR文库,该方法中探针与不含SSR位点的片段存在一定程度的结合,为减少测序的盲目性,使用M13R载体通用引物和(AC)8,(AG)8,(ATG)5探针相结合进行2次筛选,共测序93条,含有SSR位点的序列就有82条,占测序总条数的88.17%.
播娘蒿SSR文库中出现了16种重复基元,以二核苷酸 AC/CA,TG/GT,TC/CT和三核苷酸TGA/GAT/ATG出现次数最多,分别为34,27,26和20次,占 SSR位点总数的20.47%,26.77%,21.26%和15.75%,其它重复基元出现次数较少.本研究使用的生物素探针为(AC)8,(AG)8和(ATG)12,研究结果中SSR基元多以与这些探针互补配对为主.如果增加更多类型的探针,估计会得到更多类型的SSR基元.文库中,二核苷酸基元最多重复35次,三核苷酸单元最多重复26次,四核苷酸基元最多重复4次,六核苷酸基元最多重复4次.
播娘蒿SSR位点中,重复次数在4~35次(表2),重复次数在4~10次的有80个,占SSR位点总数的62.99%;重复次数在11~20次的有31个,占SSR位点总数的24.41%;重复次数在20次以上的有16个,占SSR位点总数的12.60%.

表2 SSR重复次数分布Table 2 SSR repetition number distribution
播娘蒿SSR位点中,重复长度在8~95 bp(表3),重复长度在8~20 bp的有65个,占SSR位点数的51.18%;重复长度在20~40 bp的有40个,占SSR位点数的31.50%;重复长度大于40 bp的有22个,占SSR位点数的17.32%.

表3 SSR重复长度分布Table 3 SSR repeatitiion length distribution
3 讨论
播娘蒿SSR重复基元以二核苷酸重复基元最多,占SSR位点总数的69%.在莲属植物的研究中,设计的11对SSR引物全部来自于二核苷酸重复的基因序列[16];谷子的研究中,分析多态性的22对引物中有20对引物的SSR为二核苷酸重复[17];用于分析银杏遗传多样性的11对引物其SSR全部为二核苷酸重复[18].这说明用二核苷酸重复基元的DNA片段设计引物,较容易检测多态性.本研究获得的播娘蒿SSR文库中,二核苷酸重复的位点占69.68%,满足开发SSR标记的需要.
杜仲20个能检测到多态性的SSR分子标记中,其二核苷酸SSR重复次数在9~16次,三核苷酸SSR重复次数在7~12次[19];兰属植物遗传多样性研究中,表现出多态性的14对SSR引物中,二核苷酸SSR重复次数在9~32次,三核苷酸SSR重复次数在4~12次[20];中国红枣的研究中,表现出多态性的25对SSR引物,全部为二核苷酸基元重复,重复次数在6~15次[21].而播娘蒿的二核苷酸基元重复次数分布在4~35之间,三核苷酸基元重复次数分布在4~26,大部分克隆含有潜在多态SSR位点,可进行下一步开发 SSR位点引物的工作.
[1] 钱利武,张小平,蒋继宏.播娘蒿研究进展[J].中国野生植物资源,2006,25(3):8-10.
[2] 李红伟,郑晓珂,弓建红,等.独行菜和播娘蒿化学成分及药理作用研究进展[J].药物评价研究,2013,36(3):235-240
[3] 罗 晴,柏正强,张兆清,等.川西草原植物资源播娘蒿亚麻酸含量的研究[J].四川草原,2003(1):45-46.
[4] 张建强.从播娘蒿籽油中富集α-亚麻酸及其制备生物柴油的研究[D].兰州:兰州大学,2007.
[5] 李孟良.沿淮地区播娘蒿种子油脂肪酸成分研究[J].安徽科技学院学报,2013,27(1):21-24.
[6] 王新芳,董 岩,刘洪玲.播娘蒿挥发油化学成分的GCMS研究[J].山东中医杂志,2005,24(2):112-114.
[7] 孙 凯,李 铣.南葶苈子的化学成分[J].沈阳药科大学学报,2003,20(6):419-421.
[8] 李孟良,杨安中,牟筱玲,等.播娘蒿角果生长特性的研究[J].中国油料作物学报,2004,26(2):95-97.
[9] 代旭兰,黄 敏,易秀丽,等.播娘蒿抗寒性生理研究[J].四川大学学报:自然科学版,2007,44(1):199-202.
[10] 王凯华,张文英,王 会,等.国内外甘蓝型油菜种质SSR标记遗传多样性分析[J].中国农学通报,2011,27(19):144-149.
[11] 彭镇华,刘贯水,李潞滨.磁珠富集法开发毛竹SSR标记引物[J].林业科学研究,2011,24(6):743-748.
[12] WANG H W,ZHANG B,WANG Z S,et al.Development and characterization of microsatellite loci in Taihangia rupestris(Rosaceaea),a rarecliff herb[J].Amerian Journal of Botany,2010,97(12):136-138.
[13] WEBER J L.Informativeness of human(dC-dA)n.(dG-dT)n polymorphisms [J].Genomics,1990,7(4):524-529.
[14] 邓玉营,黄花柳.微卫星富集文库构建及标记筛选[D].南京:南京林业大学,2005
[15] 程月琴,王红卫,万慧霞,等.文冠果富集SSR文库的构建及特性分析[J].河南农业大学学报,2013,47(4):440-445.
[16] KUBO N,HIRAI M,KANEKO A,et al.Development and characterization of simple sequence repeat(SSR)markers in the water lotus(Nelumbo nucifera)[J].A-quatic Botany,2009,90(2):191-194.
[17] 李 琳.富集文库法开发谷子的微卫星分子标记[D].石家庄:河北师范大学,2008.
[18] 陈烨烨.银杏微卫星文库的构建和遗传多样性分析[D].杭州:浙江大学,2008.
[19] 黄海燕,杜红岩,乌云塔娜,等.基于杜仲转录组序列的SSR分子标记的开发[J].林业科学,2013,49(5):176-181.
[20] MOE K T,ZHAO W G,SONG H S,et al.Development of SSR markers to study diversity in the genus Cymbidium[J].Biochemical Systematics and Ecology,2010,38(4):585-594.
[21] MA Q H,WANG G X,LIANG L S.Development and characterization of SSR markers in Chinese jujube(Ziziphus jujuba Mill.)and its related species[J].Scientia Horticulturae,2011,129(4):597-602.
