M-CSF对人卵巢颗粒细胞表达FSH与其受体的影响及相互作用研究
2014-04-13许嵩张治芬
许嵩 张治芬
M-CSF对人卵巢颗粒细胞表达FSH与其受体的影响及相互作用研究
许嵩 张治芬
目的 通过研究巨噬细胞集落刺激因子(M-CSF)对卵巢颗粒细胞表达卵泡刺激素(FSH)与其受体(FSHR)的影响及其与FSH之间的相互作用,探讨M-CSF在卵泡发育中的作用。方法体外培养人卵巢肿瘤颗粒细胞系COV434,分别给予不同浓度的M-CSF(0、5、10、25、50、100ng/ml)进行干预,24h后收取细胞和培养上清液,用荧光定量PCR法检测颗粒细胞内FSH受体表达量的变化,并用同法检测FSH对M-CSF及其受体M-CSFR的作用。用ELISA方法对上清液中细胞分泌的雌二醇(E2)进行检测,观察M-CSF对颗粒细胞分泌E2的影响。结果M-CSF可使颗粒细胞FSHR的表达上升,呈剂量依赖性,当M-CSF浓度>10ng/ml时,上升更为明显(P<0.01);FSH可以提升M-CSF及其受体在颗粒细胞内的表达,但当FSH浓度过高时(>50ng/ml),此作用消失;M-CSF和FSH在体外条件下达到一定浓度后可以促进E2的分泌。结论M-CSF能够促进颗粒细胞表达FSH受体和分泌E2,协助FSH发挥促卵泡发育的作用。
卵泡刺激素 巨噬细胞集落刺激因子 雌二醇 颗粒细胞 COV434
细胞因子可以通过自分泌或旁分泌的途径调节卵巢功能。巨噬细胞集落刺激因子(macrophage colonystimulating factor,M-CSF),也称CSF-1,是细胞信号调控网络的主要因子,具有多种生物学功能,近年来受到广泛重视[1]。M-CSF可以由多种细胞产生,除了促进单核巨噬细胞生长、增殖、分化之外,还参与调控胚胎发育和骨代谢。现已证明,M-CSF在肿瘤、心血管疾病及一些自身免疫性疾病的发生过程中起作用。而生殖医学领域中,M-CSF也被发现其可能具有维持卵巢功能和促进性激素分泌的重要调控作用[2]。卵泡刺激素(follicle stimulating hormone,FSH)是一种十分重要的促性腺激素,可以促进卵泡颗粒细胞的生长和成熟。因此,FSH在卵泡的局部浓度及其受体——FSHR(follicle stimulating hormone receptor)在颗粒细胞上的表达情况直接关乎卵泡发育的结果。本研究旨在探索M-CSF在卵泡发育时对FSH及其受体FSHR的影响,同时对两者之间作用机制作初步探讨。
1 材料和方法
1.1 主要材料及试剂 人卵巢颗粒细胞系COV434购自北京北纳创联生物技术研究院;重组人M-CSF为美国R&D公司产品;人重组FSH为美国Sigma公司产品;RNA提取试剂TRziol为美国Invitrogen公司产品;SYBR荧光定量PCR试剂盒(产品编号DRR037、DRR420)为大连宝生物公司(TaKaRa Dalian)产品;人雌激素(雌二醇,E2)ELISA试剂盒为美国Biocheck公司产品;细胞培养所用DMEM/F12培养基、胎牛血清为美国GIbco公司产品。
1.2 细胞培养 COV434细胞以DMEM/F12培养基培养,置37°C、5%CO2环境下培养。培养基内含10%新生牛血清、青霉素100U/ml和链霉素100μg/ml。待细胞生长状态良好时,以3×106密度种植于十二孔细胞培养板,24h后换液,去血清并加入不同浓度的M-CSF(0、5、10、25、50、100ng/ml)或FSH(0、5、10、25、50、100ng/ml),再隔24h后收取上清液和细胞待测。
1.3 引物设计 根据GenBank数据库(http://www.ncbi. nlm.nih.gov/)得到M-CSF、M-CSFR、FSHR基因的cDNA序列及其相关信息,采用Oligo6.0软件设计引物,序列见表1。

表1 实验引物序列
1.4 M-CSF、M-CSFR、FSHR基因表达量鉴定 采用TRizol法从培养的COV434细胞中提取总RNA,Nanopo仪器定量测定后,取1μg总RNA,按照TAKARA逆转录试剂盒DRR037操作说明书,转录成cDNA,再按照TAKARA荧光定量PCR试剂盒DRR420的操作说明配置反应体系;在BioRAD实时荧光定量PCR仪器上进行检测,反应条件:95°C预变性2min,再进行95°C持续10s、60°C持续30s共39个循环。
1.5 E2测定 取细胞培养的上清液,用Biocheck公司生产的E2ELISA试剂盒检测。操作:稀释试剂盒提供的标准品,设空白孔、标准孔、待测样品孔。在酶标包被板上加标准品50μl,待测孔中先加样品稀释液40μl,然后再加待测样品10μl(最终稀释度为5倍)。将样品加于酶标板孔底部,轻轻晃动混匀。用封板膜封板后置37℃温育30min。揭掉封板膜,弃去液体,甩干,加洗涤液,静置30s后弃去,重复5次,拍干。每孔加入酶标试剂50μl,空白除外。温育后显色以空白孔调零,450nm波长酶标仪依序测量各孔的吸光度(OD值)。
1.6 统计学处理 采用SPSS19.0统计软件,测得计量资料以表示,组间比较采用方差分析,均数间两两比较采用t检验。
2 结果
2.1 M-CSF作用对颗粒细胞表达FSHR的影响 经不同浓度M-CSF作用24h后,颗粒细胞FSHR的表达与空白对照相比均有上升,浓度达到10ng/ml以上时,上升更为明显(P<0.01),见图1。
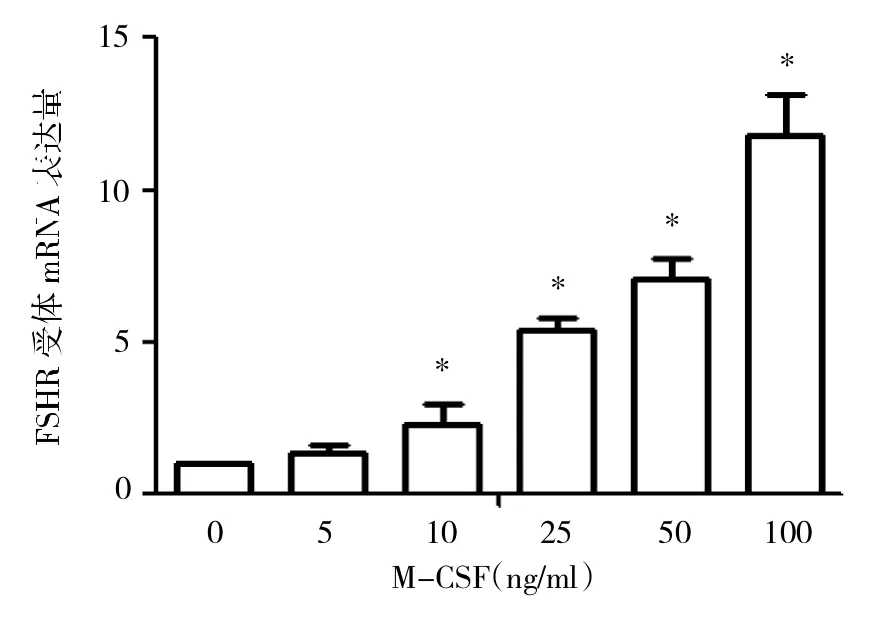
图1 M-CSF作用对颗粒细胞表达FSHR的影响(与空白对照比较,*P<0.01)
2.2 FSH对颗粒细胞表达M-CSF及其受体M-CSFR的影响 经过不同浓度FSH刺激24h后发现:当FSH浓度为10、25ng/ml时,M-CSF及M-CSFR的表达量明显增加(均P<0.01),而当FSH浓度升高至50ng/ml以上时,两者的表达量则迅速下降,见图2-3。
2.3 M-CSF和FSH分别对颗粒细胞分泌E2的影响 M-CSF和FSH作用后人颗粒细胞分泌E2均增加,这一作用在FSH或M-CSF浓度达到25ng/ml后更为明显(均P<0.05),而且随着浓度的增加而逐渐增强,见图4-5。
3 讨论
研究发现,炎症细胞因子具有调节卵巢功能的作用[3]。M-CSF可以由多种细胞产生,发挥多项生物学作用,如肿瘤的发生、发展[4]、自身免疫性疾病(如类风湿性关节炎)[5]、脂代谢疾病[6-7]等。在卵巢颗粒细胞中也发现存在合成M-CSF的mRNA。这提示在卵泡内环境中可能存在自分泌或旁分泌途径积累的M-CSF。卵泡发育时,其周围存在的巨噬细胞可以促进颗粒细胞生长[8]。当M-CSF基因发生无效突变时,不能形成生理性的黄体生成素(luteinizing hormone,LH)峰,小鼠会发生青春期延迟和严重的生育能力降低[9-10]。而给这些小鼠注射人重组M-CSF后,就可以恢复生殖性腺轴的正常反馈[11]。这一现象提示M-CSF基因的功能发挥与生殖性腺轴之间有重要的关系[12]。
M-CSF可以影响包括女性生殖系统的细胞在内的多种细胞类型[13],颗粒细胞内存在合成M-CSF的mRNA,缺乏M-CSF就会造成卵泡发育异常和排卵障碍,这种情况很可能与生殖性腺轴反馈异常相关,而促性腺激素受体FSHR则是卵泡发育所必需的特异性受体。本研究利用COV434细胞系,探讨在非黄素化的颗粒细胞中,M-CSF对于其表达FSHR的影响。实验结果表明,MCSF可以促进颗粒细胞上FSH受体的合成,而且这一效果呈剂量依赖性,M-CSF的浓度越高,其促进FSHR表达的作用就越强。说明在卵泡发育过程中,颗粒细胞可以通过自分泌途径产生M-CSF并不断积累,通过它作用于发育中的卵泡,使其表达的FSHR不断提高,协助应答FSH的促卵泡发育作用,使颗粒细胞对于FSH的刺激作用更加敏感,从而促进卵泡发育成熟和排卵。Nishimura等[14]的动物实验佐证了这一结论:在促性腺激素处理的未成熟小鼠中,M-CSF能诱发排卵。
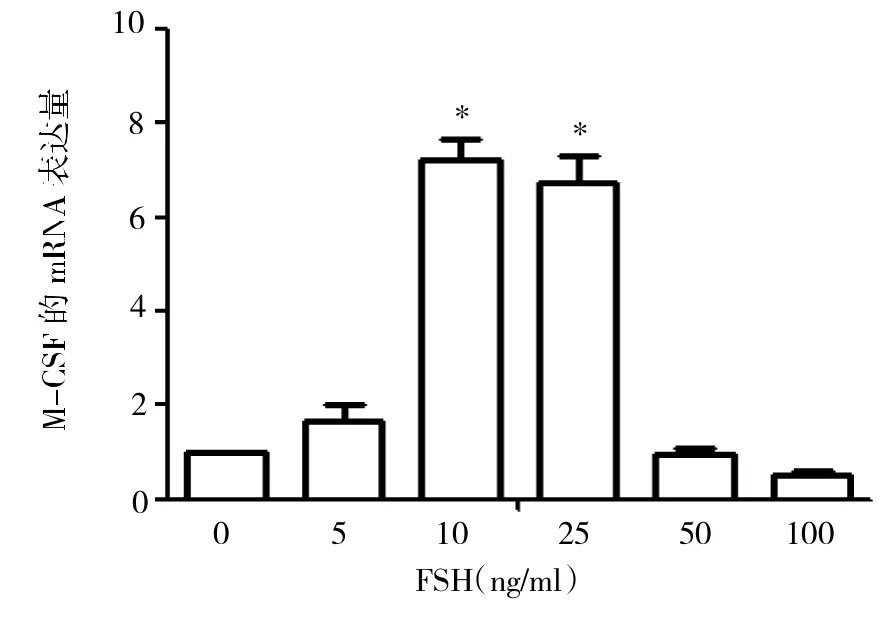
图2 FSH对颗粒细胞表达M-CSF的影响(与空白对照比较,*P<0.01)

图3 FSH对颗粒细胞表达M-CSFR的影响(与空白对照比较,*P<0.01)

图4 FSH对颗粒细胞分泌E2的影响(与空白对照比较,*P<0.05)

图5 M-CSF对颗粒细胞分泌E2的影响(与空白对照比较,*P<0.05)
另一方面,本研究还发现,FSH也会影响颗粒细胞内M-CSF及其受体的表达。当FSH浓度较低时会促进M-CSF及其受体合成,呈正反馈表现,说明FSH亦会通过M-CSF促进其自身的受体——FSHR的生成,在一定程度上具备协助颗粒细胞应答促性腺激素功能,但是若M-CSF的基因表达出现异常时,这一作用就会相应消失。Akihisa等[15]在不孕症的治疗中对卵巢低反应的患者进行了小规模M-CSF的临床应用,结果发现,同时使用M-CSF和hMG能比单用hMG使患者的卵泡发育得更好,尤其是在早卵泡期血清M-CSF水平较低的患者中,这一效果会表现得更加明显,此研究既说明了促性腺激素与M-CSF之间确实存在相互辅助的调节作用,同时更是第一次在临床治疗中验证了M-CSF的可行性。然而,在本实验中亦发现,当FSH浓度升高到一定程度后(>50ng/ml),它对于M-CSF及其受体的促进作用变得减弱甚至消失。分析这一现象的出现,可能是由于在卵泡发育的早期阶段,垂体分泌的FSH作用于卵泡内的颗粒细胞,通过促进M-CSF的作用促进其自身受体FSHR的表达,协助卵泡在促性腺激素的作用下逐步发育成熟至窦状卵泡。但随着时间的推移,卵泡不断增大,卵泡内FSH的水平越来越高,此时为了避免M-CSF在其促进作用下发挥出其他的生物学效应(如诱导巨噬细胞聚集等),FSH则会抑制M-CSF及其受体的表达,从而维持一定的稳态。同时,本实验也同样发现,M-CSF具有促进颗粒细胞合成E2的作用,这一结果提示我们,M-CSF除了影响促性腺激素的受体之外,还可以通过升高E2的水平,辅助卵巢对生殖性腺轴中的下丘脑和垂体发挥正反馈作用。基于M-CSF在卵泡发育和排卵过程中的重要作用,有学者提出,可以把不孕症患者体内M-CSF的水平作为一个判断辅助生殖治疗是否成功的预测指标[16-17]。
结合本研究以及近年的一些研究结果可知,M-CSF在排卵前卵泡发育、排卵时诱发排卵和排卵后黄体功能的维持上都有着重要的生物学功能,甚至有学者发现M-CSF还可以通过支持滋养细胞的生长和分化从而调节胎盘功能,丛而维持正常妊娠[18],甚至有人认为其在胚胎发育上也有重要调节作用[19]。可见M-CSF是生殖生理中不可或缺的重要组成部分,在生殖内分泌学上具有广阔的应用前景,有必要对其继续进行深入探讨,从而为将来在临床上应用M-CSF治疗不孕症和复发性流产等疾病成为可能。
[1]Zhu H,Jiang X X,Guo Z K,et al.Tumor necrosis factor-alpha alters the modulatory effects of mesenchymal stem cells on osteoclast formation and function[J].Stem Cells Dev,2009,18(10):1473-1484.
[2]Zhang Z,Fang Q,Wang J.Involvement of macrophage colonystimulating factor(M-CSF)in the function of follicular granulosa cells[J].Fertil Steril,2008,90(3):749-754.
[3]Nishimura K,Tanaka N,Kawano T,et al.Changes in macrophage colony-stimulating factor concentration in serum and follicular fluid in in-vitro fertilization and embryo transfer cycles[J].Fertil Steril,1998,69(1):53-57.
[4]Abraham D,Zins K,Sioud M,et al.Stromal cell-derived CSF-1 blockade prolongs xenograft survival of CSF-1-negative neuroblastoma[J].Int J Cancer,2010,126(6):1339-1352.
[5]Hamilton J A.Colony-stimulating factors in inflammation and autoimmunity[J].Nat Rev Immunol,2008,8(7):533-544.
[6]Weisberg S P,McCann D,Desai M,et al.Obesity is associated with macrophage accumulation in adipose tissue[J].J Clin Invest, 2003,112(12):1796-1808.
[7]Pang C,Gao Z,Yin J,et al.Macrophage infiltration into adipose tissue may promote angiogenesis for adipose tissue remodeling in obesity[J].Am J Physiol Endocrinol Metab,2008,295(2):E313-322.
[8]Fukumatsu Y,Katabuchi H,Naito M,et al.Effect of macrophages on proliferation of granulosa cells in the ovary in rats[J].J Reprod Fertil,1992,96(1):241-249.
[9]Chitu V,Stanley E R.Colony-stimulating factor-1 in immunity and inflammation[J].Curr Opin Immunol,2006,18(1):39-48.
[10]Sweet M J,Hume D A.CSF-1 as a regulator of macrophage activation and immune responses[J].Arch Immunol Ther Exp (Warsz),2003,51(3):169-177.
[11]Cohen P E,Zhu L,Nishimura K,et al.Colony-stimulating factor 1 regulation of neuroendocrine pathways that control gonadal function in mice[J].Endocrinology,2002,143(4):1413-1422.
[12]Pollard J W.Trophic macrophages in development and disease [J].Nat Rev Immunol,2009,9(4):259-270.
[13]Arceci R J,Pampfer S,Pollard J W.Expression of CSF-1/c-fms and SF/c-kit mRNA during preimplantation mouse development [J].Dev Biol,1992,151(1):1-8.
[14]Nishimura K,Tanaka N,Ohshige A,et al.Effects of macrophage colony-stimulating factor on folliculogenesis in gonadotrophinprimed immature rats[J].J Reprod Fertil,1995,104(2):325-330.
[15]Takasaki A,Ohba T,Okamura Y,et al.Clinical use of colonystimulating factor-1 in ovulation induction for poor responders [J].Fertil Steril,2008,90(6):2287-2290.
[16]Salmassi A,Mettler L,Jonat W,et al.Circulating level of macrophage colony-stimulating factor can be predictive for human in vitro fertilization outcome[J].Fertil Steril,2010,93(1):116-123.
[17]Salmassi A,Zhang Z,Schmutzler A G,et al.Expression of mRNA and protein of macrophage colony-stimulating factor and its receptor in human follicular luteinized granulosa cells[J].Fertil Steril,2005,83(2):419-425.
[18]Pollard J W,Bartocci A,Arceci R,et al.Apparent role of the macrophage growth factor,CSF-1,in placental development[J]. Nature,1987,330(6147):484-486.
[19]Bartocci A,Mastrogiannis D S,Migliorati G,et al.Macrophages specifically regulate the concentration of their own growth factor in the circulation[J].Proc Natl Acad Sci U S A,1987,84(17):6179-6183.
Effect of macrophage colony-stimulating factor(M-CSF)on expression of follicle stimulating hormone(FSH)and its receptor in human granulosa cells
Objective To examine the effect of macrophage colony-stimulating factor(M-CSF)on the expression of follicle stimulating hormone(FSH)and its receptor(FSHR)in human non-luteinizing granulosa cells.MethodsThe cultured human ovarian granulosa cell tumor COV434 cells were treated with different concentrations of M-CSF(0,5,10,25,50,100ng/ml).After 24 h,granulosa cells were collected and the mRNA expression of FSHR,M-CSF and M-CSF receptor was detected by quantitative PCR.Estradiol(E2)contents in culture supernatant were measured by ELISA.ResultsM-CSF significantly increased the mRNA expression of FSHR in a dose dependent manner(P<0.01),it was more markedly when the concentration of M-CSF was>10ng/ml.FSH enhanced the production of M-CSF and its receptor when the concentration<50ng/ml.Both M-CSF and FSH increased the secretion of E2in granulosa cells.ConclusionM-CSF can increase the expression of FSHR and E2 secretion in human granulosa cell,which may promote follicular development.
FSHM-CSFEstradiolGranulosa cellCOV434

2014-03-11)
(本文编辑:沈昱平)
浙江省自然科学基金(Y2090796)
310002 杭州市妇产科医院(杭州市第一人民医院集团)妇科
张治芬,E-mail:zhangzf@zju.edu.cn
