对废弃胚胎行囊胚培养在体外受精-胚胎移植中的意义
2014-04-13王荣费小阳王丽卿邹立波
王荣 费小阳 王丽卿 邹立波
对废弃胚胎行囊胚培养在体外受精-胚胎移植中的意义
王荣 费小阳 王丽卿 邹立波
目的 探讨对不可移植的废弃胚胎行囊胚培养在体外受精-胚胎移植(IVF-ET)中的意义。方法通过囊胚序贯培养法将d3废弃胚胎培养至囊胚期。比较不同来源胚胎及d3胚胎的卵裂球数与囊胚形成的关系;利用废弃胚胎囊胚形成情况对体外受精妊娠结局进行预测;并将获得的可移植囊胚行胚胎移植及冷冻。结果共收集782例患者的1 962个废弃胚胎,经序贯培养,形成囊胚376枚(19.2%);1PN胚胎、0PN胚胎、d 3卵裂球数>6的胚胎囊胚形成率较高(均P<0.05);废弃胚胎中有囊胚形成者的临床妊娠率明显高于无囊胚形成者(P<0.05);由2PN胚胎形成囊胚共64枚,其中10枚囊胚行移植,剩余囊胚行玻璃化冷冻保存,囊胚移植后临床妊娠率66.7%。解冻移植囊胚24个周期,妊娠周期13个,妊娠率54.2%。囊胚移植共获得健康婴儿18名。结论
体外受精-胚胎移植 废弃胚胎 囊胚 序贯培养
目前,体外受精-胚胎移植(IVF-ET)技术作为不孕症的主要治疗方法之一已被广泛开展。在IVF-ET治疗过程中,存在大量不可用于移植的废弃胚胎,严重限制了胚胎利用率。有报道显示,废弃胚胎可用于建立人类胚胎干细胞系,但仍有许多生殖医学中心不具备干细胞培养技术,因此,对于IVF治疗中废弃胚胎的处理仍未见系统全面的报道。我们采用商品化的囊胚培养液对d3废弃胚胎进行囊胚培养,比较不同来源胚胎囊胚形成的数量和质量,并对部分无可用卵裂期胚胎移植的患者进行囊胚移植,以期提高胚胎的利用率,现报道如下。
1 对象和方法
1.1 对象 收集我院生殖医学中心2007-06—2010-06行IVF/卵母细胞质内单精子注射(ICSI)-ET周期新鲜废弃胚胎。按照以下卵裂期胚胎评分进行对d3胚胎进行评价(表1)。

表1 卵裂期胚胎评分标准
本研究选择的胚胎包括:(1)受精异常胚胎:无原核(0PN)、单个原核(1PN)和多个原核(≥3PN,以3PN为主);(2)卵裂期发育延缓:不符合移植和冷冻标准的2原核(2PN)胚胎(均为d2仍是2PN,d3开始卵裂的胚胎);(3)废弃胚胎:主要为Ⅳ级不可移植及冷冻胚胎。本研究经本院伦理委员会批准,所有患者均签署“自愿将胚胎用于科学研究的知情同意书”。
1.2 囊胚培养及观察 将囊胚培养液(Multiblast Medium,美国Irvine公司产品)在35 mm的培养皿中做30μl的微滴,覆盖矿物油,37℃、5%CO2培养箱中平衡过夜。将d3废弃胚胎在囊胚培养液中漂洗后,转移到新鲜囊胚培养液微滴中培养至d5~7,观察胚胎发育情况,根据Gamder囊胚分级法对形成的囊胚进行分级。先根据囊胚的扩张和孵出程度将囊胚分成6级:1级,早期囊胚,囊胚腔体积<囊胚总体积的一半;2级,囊胚腔体积>囊胚总体积的一半:3级,完全扩张囊胚,囊胚腔占据整个囊胚;4级,扩张后囊胚,囊胚腔体积较早期囊胚明显扩大,透明带变薄;5级,正在孵化的囊胚,囊胚正在从透明带破裂口孵出;6级,孵化出的囊胚,囊胚完全从透明带中脱出。3~6级囊胚需对内细胞(inner cell mass,ICM)和滋养外胚层细胞(trophectoderm,TE)进行评分。ICM评分:A级,细胞数目多,结合紧密;B级,细胞数目较少,结合较松散;C级,细胞数目极少。TE评分:A级,细胞数目多,囊胚四周均有细胞分布;B级,细胞数目较少,上皮细胞较松散;C级,细胞数目极少。将d5评分≥3AA、3AB、3BA、3BB或d6~7评分 ≥4AA、4AB、4BA、4BB的囊胚定为优质囊胚。
1.3 统计学处理 采用SPSS11.0统计软件,率的比较采用χ2检验。
2 结果
本实验共收集到782例患者的1 962个废弃胚胎,经序贯培养,其中73例患者无可用卵裂期胚胎移植,685例患者行卵裂期胚胎移植。
2.1 不同来源的胚胎囊胚形成情况 根据胚胎受精情况,将废弃胚胎分为0PN、1PN、2PN、≥3PN,比较不同来源的胚胎囊胚形成情况,来源1PN的胚胎囊胚形成率最高(P<0.05),0PN次之,2PN及≥3PN最低,各组之间优质囊胚率无统计学差异。详见表2。
2.2 d3卵裂球数与囊胚形成情况 根据d3胚胎卵裂球数目将胚胎分为≤3,4~6,7~9,≥10几组,≤3组的囊胚形成率(P<0.05)最低,7~9组及≥10组囊胚形成率较高(均P<0.05),但这两组之间无统计学差异(P>0.05)。各组之间优质胚胎率无统计学差异,详见表3。
2.3 囊胚形成情况与妊娠率的关系 所有685例行卵裂期胚胎移植患者中,废弃胚胎行囊胚培养有300例患者形成囊胚,临床妊娠165例,妊娠率55.0%;385例患者未形成囊胚,临床妊娠143例,妊娠率37.1%,两组比较有统计学差异。73例患者中有9例由2PN胚胎形成10个囊胚并行囊胚移植,临床妊娠6例,妊娠率66.7%。
2.4 剩余囊胚的处理 由2PN胚胎形成囊胚共64枚,其中10枚囊胚行移植,剩余囊胚行玻璃化冷冻保存。
2.5 解冻移植 2011—2013年,共26例患者进行冻融囊胚解冻移植,解冻囊胚39枚,获得可移植囊胚35枚,移植周期24个,妊娠周期13个,临床妊娠率54.2%。新鲜和冻融囊胚移植周期共获得健康婴儿18名。
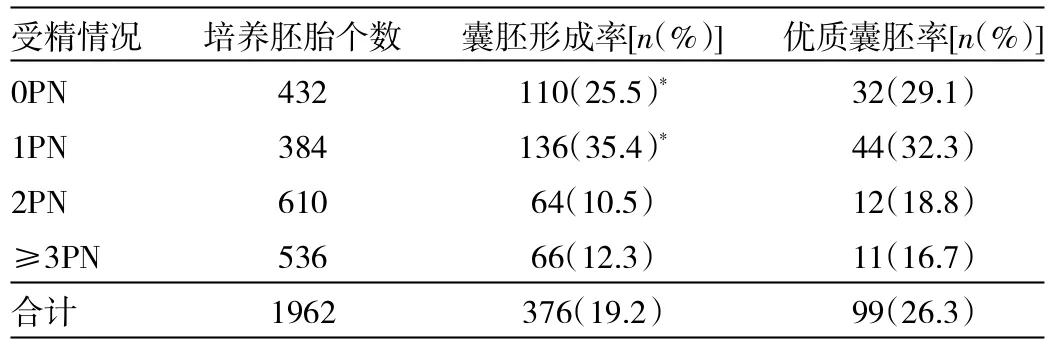
表2 不同来源胚胎与囊胚形成的关系
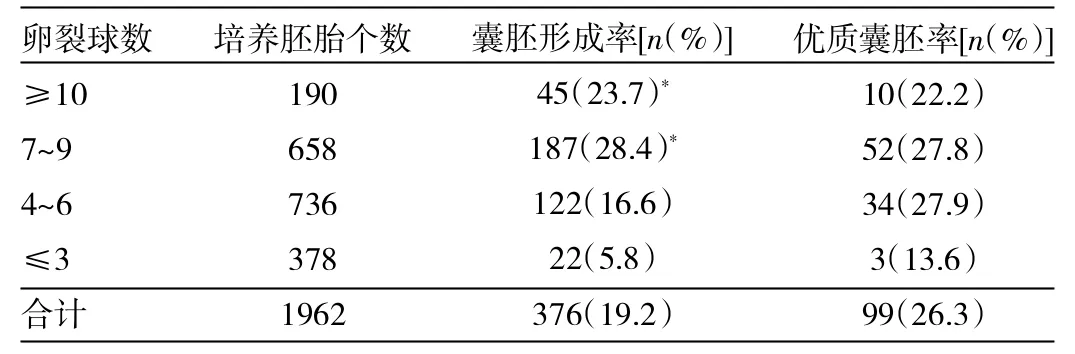
表3 d3卵裂球数与囊胚形成的关系
3 讨论
随着辅助生殖技术的大量开展,由于促排卵药物的应用产生多个卵子进行体外受精及培养,使得患者获得多个可移植胚胎的同时会产生许多不适合移植胚胎,也称为废弃胚胎。废弃胚胎主要包括异常受精胚胎、发育迟缓胚胎及胚胎评分差的胚胎。多数生殖中心对于废弃胚胎多为丢弃。国外有报道利用IVF-ET后废弃胚胎建立人类胚胎干细胞系[1]。杨华等[2]也报道利用IVF-ET后废弃的评分较低的卵裂期胚胎序贯培养至囊胚阶段并从中分离出一株人胚胎干细胞系。但是多数生殖中心并不存在培养胚胎干细胞的条件。
国内梁菊艳等[3]最早报道利用废弃胚胎行囊胚培养。温烯等[4]利用低质量人类胚胎行囊胚培养,囊胚形成率12.5%。我中心采用废弃胚胎进行囊胚培养,方法简单可靠,目的提高囊胚培养技术的同时,从废弃胚胎中获得了可用囊胚,提高了胚胎利用率。
在IVF-ET周期中,常有异常受精卵出现,形成0PN、1PN和≥3PN(以3PN为主)胚胎。3PN来源胚胎非整倍体发生率较高,染色体多体率高达70%~80%。0PN、1PN、2PN和3PN胚胎有不同程度的染色体异常发生率,序贯培养时,它们的囊胚形成情况存在差异。我们的结果显示:1PN胚胎的囊胚形成率,0PN明显高于3PN和2PN胚胎,这提示在废弃胚胎中,0PN、1PN胚胎有较好的发育潜能。临床上在无2PN正常受精胚胎移植的情况下,可选择0PN胚胎和1PN胚胎移植,但需结合胚胎植入前遗传学诊断以及产前诊断技术行染色体异常筛查。
胚胎生长速度对胚胎移植着床率、临床妊娠率、活产率有明显影响,对囊胚形成也有显著影响。囊胚形成率与卵裂速度成正比,卵裂速度较快的胚胎更容易形成优质囊胚。Neuber等[5]研究表明,d3卵裂球数目≥7个的优质胚胎更容易发育成优质囊胚。我们的研究也表明d3细胞数>6的两组显著高于≤6的两组。
同时,胚胎碎片情况也与囊胚形成密切相关。Hardy等[6]研究表明,随着胚胎碎片的增多,囊胚形成率降低,当碎片>25%时,很少有胚胎能发育到囊胚阶段;碎片<10%时不会影响囊胚的形成,但是碎片>15%,囊胚的形成率显著下降。我们培养过程中2PN胚胎形成囊胚情况明显降低,可能原因为废弃的2PN胚胎主要为碎片较多的Ⅳ级,影响了囊胚的形成。
在IVF-ET治疗过程中有部分患者因为胚胎质量差而放弃移植,但是我们的实验表明仍有部分Ⅳ级胚胎可以形成囊胚。囊胚是胚胎发育的重要阶段,研究表明囊胚移植使胚胎发育和子宫内膜的生理阶段同步化,提高了胚胎着床率的同时提高了临床妊娠率。我们对部分无可用胚胎的患者进行废弃胚胎囊胚培养移植,并获得妊娠(妊娠率66.7%)。同时,通过废弃胚胎的囊胚培养,获得了部分可以利用的囊胚并进行了玻璃化冷冻,提高了胚胎利用率。
由于胚胎植入前遗传学诊断技术的限制,为了降低成本及保证胚胎移植的安全性,我们在实际临床工作中应主要选择受精情况正常(2PN),d3碎片较多、评分较低的胚胎行囊胚培养,这样获得的囊胚才可以应用于临床中。同时由于囊胚移植多为单胚胎移植,显著降低临床多胎率。本文由于数据不多,并未进行相关统计。
同时,我中心对由2PN胚胎培养获得的冻融囊胚行冻融囊胚移植,获得满意的临床妊娠率(54.2%)。我们随访了囊胚移植获得的婴儿未发现畸形等情况。目前,对胚胎质量评估的方法中,应用最广泛的是对配子、胚胎各时期的形态特征进行评分的形态学评价法。我们的结果提示按照该方法行胚胎评价的废弃胚胎行囊胚培养后移植对子代并无不利的影响。本文由于数据不多,并未进行相关统计。
临床上的废弃胚胎有不同程度的发育潜能,若能选择合适的胚胎进行囊胚培养,可以提高胚胎利用率,使得部分无可用胚胎患者获得移植及妊娠的可能,同时移植剩余胚胎囊胚的形成对妊娠具有一定的预测意义。
[1]Lerou P H,Yabuuchi A,Huo H,et al.Derivation and maintenance of human embryonic stem cells from poor-quality in vitro fertilization embryos[J].Nat Protoc,2008,3(5):923-933.
[2]杨华,丘映,刘锋,等.应用卵裂期废弃胚胎培养建立人胚胎干细胞系的方法探索[J].广西医科大学学报,2011,28(1):31-35.
[3]梁菊艳,王芳,孙莹璞,等.废弃胚胎继续囊胚培养研究[J].生殖与避孕,2008,28(10):598-601.
[4]温烯,李蓉,郝桂琴,等.低质量人类胚胎体外发育至囊胚能力的研究[J].现代妇产科进展,2010,19(4):286-288.
[5]Neuber E,Rinaudo P,Trimarchi J R,et al.Sequential assessment findividually cultured human embryos as an indicator of subsequent good quality lastocyst development[J].Hum Reprod,2003,18 (6):1307-1312.
[6]Hardy K,Stark J,Winston R M.Maintenance of the inner cell mass in human blastocysts from fragmented embryos[J].Biol Reprod, 2003,68(4):1165-1169.
Potential use of discarded embryos for in vitro fertilization and embryo transfer(IVF-ET)
Objective To explore the potential use of discarded embryos for in vitro fertilization-embryo transfer(IVF-ET).MethodsThe discarded embryos from d3 were cultured into blastula by the sequential culture method.ResultsA total of 1962 discarded embryos from 782 patients were cultured,in which 376 blastocysts were formed with a blastocyst rate of 19.2%.The blastocyst formation rates were significantly higher from 1PN,0PN and>6 cells embryos.The clinical pregnancy rate in women with blastosphere formed was significantly higher than those without blastosphere formed.Sixty four blastocysts were formed for 2PN,10 of which were transferred while the others were frozen.The clinical pregnancy rate of blastocyst transfer was 66.7%.Thirteen women got pregnant in 24 frozen-thawed blastocyst transfer cycles.A total of 18 healthy babies were born from blastocyst transfer.ConclusionThe discarded embryos have different development potential.They can develop into biastospheres.Blastocyst from appropriate discarded embryos can improve the utilization rate of embryos.
IVF-ET Discarded embryos BlastocystSequential culture
2013-03-29)
(本文编辑:沈昱平)
金华市科技局科技项目(2007-3-043)
321000 金华市人民医院生殖中心
IVF-ET中废弃胚胎部分可发育为囊胚,选择合适的胚胎行囊胚培养,能获得部分可用胚胎,提高胚胎利用率。
