表皮生长因子受体在子宫内膜样腺癌中的表达及意义
2014-04-13庄晓苹林琼琼陈国荣董迎
庄晓苹 林琼琼 陈国荣 董迎
表皮生长因子受体在子宫内膜样腺癌中的表达及意义
庄晓苹 林琼琼 陈国荣 董迎
目的 研究表皮生长因子受体(EGFR)在子宫内膜样腺癌中的表达及意义。方法采用免疫组化、原位杂交和实时荧光定量PCR方法检测正常子宫内膜组织20例、不典型增生子宫内膜组织20例、子宫内膜样腺癌组织60例的EGFR蛋白、mRNA和基因表达。结果子宫内膜样腺癌组EGFR蛋白和mRNA表达高于正常子宫内膜组,差异有统计学意义(P<0.01);不典型增生子宫内膜组EGFR蛋白和mRNA表达高于正常子宫内膜组,但差异无统计学意义(P>0.05);子宫内膜样腺癌组EGFR蛋白和mRNA表达高于不典型增生子宫内膜组,但差异无统计学意义(P>0.05)。子宫内膜样腺癌组EGFR相对表达量高于正常子宫内膜组,差异有统计学意义(P<0.05),但不典型增生子宫内膜组和正常子宫内膜组比较,差异无统计学意义(P>0.05)。结论EGFR的过度表达参与子宫内膜样腺癌的发生、发展过程。
表皮生长因子受体 子宫内膜样腺癌 免疫组化 原位杂交 实时荧光定量PCR
肿瘤的浸润与转移是复杂而有序的多阶段生物学过程,受多种基因的调控。表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种细胞膜蛋白激酶受体,参与激活多种重要的细胞信号通路,其过度激活可以促使恶性肿瘤细胞生长、增殖和转移,过表达或异常突变对恶性肿瘤的发生、发展、诊断及预后具有重要意义。在子宫内膜样腺癌中,EGFR是否异常表达,目前国内已有相关文献[1]。本研究进一步从蛋白到基因比较子宫内膜正常组织、不典型增生组织和腺癌组织中EGFR表达,探讨其临床指导意义,现报道如下。
1 对象和方法
1.1 对象 选择2005-01—2006-12在温州市中西医结合医院子宫内膜手术标本共100例,其中正常子宫内膜组织20例,不典型增生子宫内膜组织20例,子宫内膜样腺癌组织60例。将子宫内膜样腺癌患者按2000年国际妇产科联盟手术病理分期标准(FIGO)进行手术分期和病理分级[2]:病理分级为Ⅰ级15例,Ⅱ级30例,Ⅲ级15级;临床分期为Ⅰ期28例,Ⅱ期14例,Ⅲ期18例。无肌层浸润或肌层浸润深度≤1/2者36例,肌层浸润深度>1/2者24例;无淋巴结转移者47例,有转移者13例。
1.2 主要试剂与仪器 EGFR:ZA0505兔抗人单克隆抗体(工作浓度1∶120),二抗兔/鼠通用型工作液、DAB(1∶50稀释液)、PBS、柠檬酸钠缓冲液均购自上海基因公司。EGFR探针试剂盒均购自武汉博士德生物工程有限公司。多聚赖氨酸购自SIGMA公司。Total试剂购自Invitrogen公司;石蜡包埋RNA分离和扩增试剂盒购自Ambion公司;引物设计与合成由上海生工生物工程有限公司合成。主要仪器:日本Olympus显微镜BX51型,日本Olympus显微镜摄像系统BX60型,日本Olympus荧光显微镜BX51型,美国H93/GSP-9050MBE隔水式电热恒温培养箱M388792型,美国荧光定量PCR仪ABI7500型,德国Leica切片机RM2245型,浙江台州星星冰箱LSC-198CF型。
1.3 方法
1.3.1 免疫组化检测 采用EnVision法,常规石蜡包埋,切片厚度4μm,脱蜡,依次浸泡于不同浓度乙醇中,蒸馏水洗涤;3%过氧化氢室温孵育20min以消除内源性过氧化物酶;蒸馏水冲洗,PBS液浸泡5min×3次;微波炉抗原修复:0.01mmol/L柠檬酸钠缓冲液(pH6.0)作为抗原修复液,PBS浸泡5min×3次;滴加适当稀释的一抗(EGFR 1∶120),4℃孵育过夜后,PBS浸泡5min×3次,滴加二抗,室温孵育20min,PBS浸泡5min×3次;DAB显色5min;自来水充分冲洗,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树脂封片。
1.3.2 原位杂交方法 本研究每一个标本溶解曲线呈单峰,内参位于18~25,说明标本均能达到实验标准。(1)杂交前组织处理:全部子宫内膜组织石蜡标本均制备为4μm切片,置于经多聚赖氨酸处理过的载玻片上,60℃烘烤20min,确保贴片牢固。石蜡切片经常规二甲苯脱蜡,梯度乙醇脱水后,使用0.3%过氧化氢室温处理10min,以灭活组织内固有的过氧化物酶,蒸馏水洗5min×3次;随后加入3%柠檬酸新鲜稀释的胃蛋白酶K室温消化30min。经0.01M PBS洗5min×3次后用1%多聚甲醛固定10min,含有1/1 000DEPC。(2)原位杂交方法:以上切片经蒸馏水洗3次后加入预杂交液,恒温箱38~42℃作用2~4h以封闭非特异结合点。按每张切片20μl滴加杂交液,将玻片置于湿盒中(盒底保湿可用DEPC水),38~42℃恒温孵育15h左右(时间过长易产生较高背景);同时设立省略探针的空白对照,以上操作需在无RNA酶环境中进行。杂交后洗片(2×SSC、37℃5min×3次;0.5×SSC、37℃5min×2次;0.2×SSC、37℃5min× 2次),后加入封闭液37℃30min;滴加FITC标记地高辛抗体37℃60min,经PBS洗5min×4次后;玻片自然干燥后滴加10μl二脒基苯基吲哚(DAPI)复染液封片20min。
1.3.3 实时荧光定量PCR法 (1)石蜡包埋组织RNA的提取:①石蜡包埋样本脱蜡:将二甲苯加入切片中,室温孵育10min,颠倒混匀,使石蜡充分溶解。无水乙醇洗涤2遍,去掉残余的二甲苯,干燥片状沉淀物。②石蜡包埋样本RNA提取及纯化:按照RecoverAllTMTotal Nucleic Acid Isolation Kit for FFPE试剂盒说明操作提取总RNA。③RNA溶解:纯化后的RNA用60U/L Elution溶解,分装20μl用于检测RNA质量和逆转录,其余-80℃保存备用。(2)新鲜组织RNA的提取:采用液氮研磨法将组织磨成粉末,加入Trizol混合,按Trizol说明书抽提总RNA。(3)引物设计与合成:采用在线Primer 3.0软件设计引物,GC含量40%~60%,产物大小89~203bp,采用Oligo 6.0软件评估,引物均跨内含子以减少基因组DNA的干扰。(4)实时荧光定量PCR检测不同组织中EGFR表达量:引物EGFR(221bp):上游5′-CCAGTGTGCCCACTACATTG-3′,下游5′-CGCTGCCATCATTACTTTGA-3′GAPDH(314bp);上游5′-GGTCGGAGTCAACGGATTTG-3′,下游5′-ATGAGCCCCAGCCTTCTCCAT-3′。反应在25 μl的体系中进行,其中2×QuantiTect SYBR Green PCR 12.5μl、10μM的上下游引物各1μl、样本cDNA 2μl(300ng)、RNA酶灭活水8.5μl。热循环如下:94℃、5 min;94℃、30s,57℃、30s,72℃、60s,40个循环;72℃、10min。
1.4 结果判定
1.4.1 免疫组化 EGFR蛋白表达于细胞质或细胞膜,细胞质或细胞膜不着色为阴性,淡棕色颗粒为弱阳性,棕黄色颗粒为阳性,深棕黄色颗粒为强阳性,说明该蛋白过表达。切片在光镜下测量采用高倍镜选取子宫内膜样腺癌组织、正常子宫内膜组织,进行数码拍照(统一焦距及光强),在所需区域随机拍摄5个高倍视野,用Image pro plus 6.0图像分析软件分析,准确分割阳性区域后,测量累积光密度总和(IOD sum),以及阳性区域面积总和(Area sum),两者之商(IOD sum/A rea sum),即为单位面积平均光密度(OD)值,最后再以同一切片5个视野的平均光密度的均数作为该切片所代表样本EGFR蛋白表达强度。
1.4.2 原位杂交(ISH) 在荧光显微镜下选用特异的单通道滤波片观察细胞核。绿色荧光为目的基因染色,细胞核由DAPI复染成蓝色。测定为绿色信号位于细胞质内,核呈蓝色。缺省探针及抗体的阴性对照无此沉淀。切片荧光显微镜下均采用高倍镜进行数码拍照(统一焦距及光强),在所需区域随机拍摄5个高倍视野,用Image pro plus 6.0图像分析软件分析,准确分割阳性区域后,测量累积光密度总和,以及阳性区域面积总和,两者之商即为单位面积平均光密度(OD)值,最后再以同一切片5个视野的平均光密度的均数作为该切片所代表样本EGFR mRNA的表达强度。
1.4.3 实时荧光定量PCR检测石蜡包埋组织中EGFR基因表达量 选择适宜的基线,各荧光曲线与基线的交叉点即为Ct值,同一基线下Ct值越小,其荧光信号也就最先到达某阈值而被检测到,表明其基因拷贝数越多。应用2-ΔΔCt法[2]分析目的基因和内参基因的Ct值,以GAPDH作为内参基因,正常子宫内膜组织作为对照组,EGFR相对表达量公式计算:folds=2-ΔΔCt,其中ΔΔCt=(Ct目的基因-Ct内参照基因)研究组-(Ct目的基因-Ct内参照基因)对照组,通过计算子宫内膜组织中EGFR mRNA相对于正常子宫内膜组织的表达性差异。
1.5 统计学处理 采用SPSS 15.0统计软件。计量资料以表示,组间比较采用t检验。
2 结果
2.1 EGFR蛋白在不同子宫内膜组织的表达 EGFR蛋白在细胞质或细胞膜表达。正常子宫内膜表达阴性,即细胞质或胞膜不着色(图1);不典型增生子宫内膜表达弱阳性,即细胞质或胞膜淡棕色颗粒(图2);子宫内膜样腺癌表达强阳性,即细胞质或胞膜深棕黄色颗粒棕(图3)。子宫内膜样腺癌组EGFR蛋白表达高于正常子宫内膜组,差异有统计学意义(P<0.01);不典型增生子宫内膜组EGFR蛋白表达高于正常子宫内膜组,但差异无统计学意义(P>0.05);子宫内膜样腺癌组EGFR蛋白表达高于不典型增生子宫内膜组,但差异无统计学意义(P>0.05),详见表1。
2.2 EGFR mRNA在不同子宫内膜组织的表达 EGFR mRNA在正常子宫内膜、不典型增生子宫内膜、子宫内膜样腺癌细胞质中呈不同程度阳性表达(间质细胞不表达)。正常子宫内膜主要以阴性(图4)或弱阳性表达,不典型增生子宫内膜主要以弱阳性(图5)或阳性表达、子宫内膜样腺癌主要以强阳性(图6)或阳性表达。子宫内膜样腺癌组EGFR mRNA表达高于正常子宫内膜组,差异有统计学意义(P<0.01);不典型增生子宫内膜组EGFR mRNA表达高于正常子宫内膜组,但差异无统计学意义(P>0.05);子宫内膜样腺癌组EGFR mRNA表达高于不典型增生子宫内膜组,但差异无统计学意义(P>0.05),详见表2。

图1 正常子宫内膜EGFR蛋白阴性表达(EnVision法,×200)

图2 不典型增生子宫内膜EGFR蛋白弱阳性表达(EnVision法,×200)

图3 子宫内膜样腺癌EGFR蛋白强阳性表达(EnVision法,×200)

表1 不同子宫内膜组织EGFR蛋白表达情况

表2 不同子宫内膜组织EGFR mRNA表达
2.3 EGFR基因在不同子宫内膜组织的表达 以正常子宫内膜为对照组,计算得出病变子宫内膜组织EGFR相对表达量;结果示EGFR相对表达量符合正态分布,不典型增生子宫内膜组和子宫内膜样腺癌组平均值分别为0.98±0.28、1.89±0.17,子宫内膜样腺癌组与正常组比较差异有统计学意义(P<0.05),但不典型增生子宫内膜组和正常子宫内膜组比较,差异无统计学意义(P>0.05)。
3 讨论
EGFR是I型跨膜酪氨酸激酶生长因子受体,广泛分布于哺乳动物除血管外的上皮细胞膜上。EGFR结合相应配体后使酪氨酸残基磷酸化,酪氨酸磷酸化可活化Ras,将细胞信号由细胞表面转至细胞核内介导DNA合成及细胞增殖效应。根据细胞的具体环境不同,某些配体如EGF、TGF-α、AR表达出对细胞增殖调节的双向性。研究表明,多种人类肿瘤的发生与EGFR家族的异常表达有关。常见的有EGFR信号系统受体的过量表达和(或)受体的突变[3],造成非受体依赖的酪氨酸蛋白激酶活性改变、异常的细胞内分布及稳定性增加。生理情况下,EGFR与受体结合使Src同源2区蛋白磷酸化,诱导正常的有丝分裂反应。EGFR过量表达时可见到基因扩增和重排,并且EGFR过量表达时,其底物如磷脂酶C和Ras-GAP转变为磷酸化状态,促进了肿瘤的形成和发展。EGFR已被确定为细胞生长和繁殖过程中至关重要的启动因素。目前的研究发现,EGFR信号传导的增强能引起细胞无限制地生长繁殖,而且还能影响肿瘤生长过程中的其他多种重要因素,如细胞的增殖、分化、浸润以及血管新生等[4]。EGFR的表达异常,可导致正常细胞恶性转化,并增加肿瘤细胞的侵袭、远处转移能力。

图4 正常子宫内膜EGFR mRNA阴性表达(ISH,×1 000)
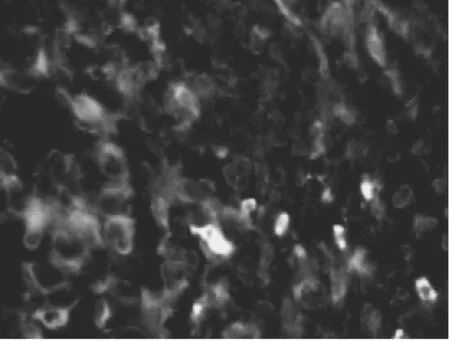
图5 不典型增生子宫内膜EGFR mRNA细胞质弱阳性表达(ISH,×1 000)

图6 子宫内膜样腺癌EGFR mRNA细胞质强阳性表达(ISH,×1 000)
据文献报道,EGFR在许多实体肿瘤如非小细胞肺癌、头颈部鳞癌、乳腺癌、胃肠癌、胰腺癌、卵巢癌及前列腺癌等上皮源性肿瘤中呈现高表达或异常表达,并在其发生、发展中起着重要作用[5-7]。本研究结果表明,与正常子宫内膜组织比较,EGFR基因和蛋白在子宫内膜样腺癌组织中均有过表达,以上结果与文献报道一致[8]。而不典型增生子宫内膜组织,EGFR基因和蛋白表达高于正常子宫内膜组织,低于子宫内膜样腺癌组织的趋势,但差异无统计学意义。综合分析上述结果,EGFR的表达随着子宫内膜病变的进展呈现逐渐强化趋势,即EGFR表达越高,其组织恶变的程度也越高。这个可能和EGFR促进了肿瘤细胞的进一步的分裂增殖有关。因而我们对子宫内膜样腺癌中EGFR表达的研究对判断子宫内膜样腺癌的预后有一定的意义,即对于判断手术切除范围及化疗方案的选择和放疗的耐受以及预后不良可起到指导作用,为肿瘤的治疗提供了一个理想的分子靶点[9]。
[1] 穆林菁,楼善贤,朱寿田,等.表皮生长因子受体在子宫内膜样腺癌中的表达[J].实用肿瘤学杂志,2005,19(3):181-182.
[2]张英丽,丁国军,石磊,等.国际妇产科联盟分期修订对术前MRI预测子宫内膜癌分期准确性的影响[J].中华医学杂志,2013,93(19):146-149.
[3]Jorissen R N,Walker F,Pouliot N,et al.Epidermal growth factor receptor:mechanisms of activation and signaling[J].ExP Cell Res, 2003,284(1):31-53.
[4]Krause D S,Van Etten R A.Tyrosine kinases as targets for cancer therapy[J].N Engl J Med,2005,353(2):172-187.
[5]KimSJ,Rabbani Z N,Dong F,et al.Phosphorylated epidermal growth faceor receptor and cyclooxygenase-2 expression in localized non-small celllung cancer[J].Med Oncol,2010,27(1):91-97.
[6]Matkovic B,Juretic A,Separovic V,et al.Immunohistochemical analysis of ER,PR,HER-3,CK5/6,P63 and EGFR antigen expression in medullary breast cancer[J].Tumori,2008,94(6):838-844.
[7]Molaei M,Pejhan S,Nayer B N,et al.Human epidermal growth factor receptor-2 family in colorectal adenocarcinoma:correlation with survival and clinicopathological findings[J].Eur J Gastroeneterol Hepatol,2009,21(3):289-293.
[8]Cronin J,McAdam E,Danikas A,et al.Epidermal growth factor receptor(EGFR)is overexpressed in high-grade dysplasia and adenocarcinoma of the esophagus and may represent a biomarker of histological progression in Barrett's esophagus(BE) [J].Am J Gastroenterol,2011,106(1):46-56.
[9]谷化平,尚培中.EGFR、VEGF和PTEN在结肠癌中的表达及与其临床病理特征的关系[J].实用癌症杂志,2011,26(3):259-262.
Expression of EGFR in endometrial adenocarcinoma and its clinical significance
Objective To investigate the expression of EGFR in endometrial adenocarcinoma and its clinical significance.MethodsThe expression of EGFR protein and mRNA were detected by immunohistochemistry,in situ hybridization and real-time quantitative reverse transcription-polymerase chain reaction(QRT-PCR)respectively,in 20 cases of normal endometrium,20 cases of atypical endometrial hyperplasia and 60 cases of endometrial adenocarcinoma.ResultsThe expressions of EGFR protein and mRNA were higher in endometrial adenocarcinoma than those in normal endometrium(P<0.01).There were no significant differences in expression of EGFR protein and mRNA both between normal endometrium and atypical endometrial hyperplasia,and between adenocarcinoma and atypical hyperplasia(P>0.05).ConclusionThe over-expression of EGFR may be involved in the occurrence and development of endometrial adenocarcinoma.
Epidermal growth factor receptor Endometrial adenocarcinoma Immunohistochemistry In situ hybridization QRT-PCR


2013-06-05)
(本文编辑:严玮雯)
浙江省医药卫生科技计划项目(2010KYA175)
325000 温州市中西医结合医院病理科(庄晓苹、董迎);温州医科大学附属第二医院病理科(林琼琼);温州医科大学附属第一医院病理科(陈国荣)
庄晓苹,E-mail:tingyuxuan56@126.com
