紫草素抑制人甲状腺髓样癌TT细胞增殖及其机制的研究
2014-04-13唐旭霞叶再元
唐旭霞 叶再元
紫草素抑制人甲状腺髓样癌TT细胞增殖及其机制的研究
唐旭霞 叶再元
目的 了解紫草素抑制甲状腺癌TT细胞增殖的作用及机制。方法采用MTT法分析紫草素对人甲状腺癌TT细胞增殖的影响;流式细胞术分析紫草素对TT细胞周期分布和凋亡的影响;透射电镜观察紫草素对TT细胞凋亡和自噬的调控。结果不同浓度紫草素作用24~72h对TT细胞均有抑制增殖的作用,并随药物浓度增加和作用时间延长而增强。紫草素作用24h,2、4μg/ml紫草素组细胞出现凋亡峰(亚二倍体峰),与空白对照组比较差异有统计学意义(P<0.05),但未见明显的细胞周期阻滞。AnnexinV-PE/7-AAD双染法分析细胞凋亡,2μg/ml紫草素作用TT细胞24h,早期凋亡细胞增至8.0%;而空白对照组为0.2%,凋亡后期继发坏死细胞为11.3%,空白对照组为0.1%;作用48h后,早期凋亡细胞为24.9%,凋亡后期继发坏死细胞上升为14.2%。2μg/ml紫草素作用TT细胞24h,透射电镜观察可见典型的细胞凋亡和自噬结构。结论紫草素具有抑制人甲状腺癌TT细胞增殖的作用,呈剂量和时间依赖关系;其作用机制与诱导细胞凋亡和自噬有关。
紫草素 甲状腺髓样癌 细胞增殖 细胞凋亡
甲状腺髓样癌(medullary carcinoma of thyroid,MTC)来源于甲状腺滤泡旁细胞(又称C细胞),约占全部甲状腺恶性肿瘤的5%~10%[1]。MTC属中度恶性肿瘤,女性发病率略多于男性。目前手术切除仍是其首选根治方式,与分化型甲状腺癌不同,131I对MTC无治疗作用,放疗、放射性核素治疗及化疗等效果均不佳[2-3]。积极寻找MTC新的治疗靶点及对治疗有效的药物具有重大意义。紫草为紫草科多年生草本植物新疆紫草干燥根,在我国有悠久的药用历史,目前研究表明,紫草素具有抗肿瘤作用[4-7]。本研究旨在探讨紫草素对MTC TT细胞是否有增殖抑制和诱导凋亡的作用,现报道如下。
1 材料和方法
1.1 材料 人甲状腺髓样癌TT细胞株系购自中国科学院细胞库,紫草素购自成都曼思特生物科技有限公司。
1.2 方法
1.2.1 TT细胞培养与传代 TT细胞为贴壁生长细胞,在37℃、5%CO2饱和湿度条件下,将TT细胞培养在F-12K培养液中。吸干培养瓶中的培养液,加入0.05%胰蛋白酶工作液1ml快速前后旋转培养瓶4~5次以便胰蛋白酶包被所有瓶内细胞,吸出胰蛋白酶工作液,另加入0.05%胰蛋白酶工作液1ml,旋转培养瓶4~5次。细胞脱落前吸出胰蛋白酶工作液。将细胞培养瓶盖松松拧上后置于37℃、5%CO2培养箱中2~5min。用手轻拍培养瓶,检查细胞脱壁情况,若无细胞脱落将细胞培养瓶再放回37℃、5%CO2培养箱中孵育数分钟,继续轻拍细胞培养瓶直至细胞完全脱落,再悬细胞于细胞培养液内(4ml),轻轻吹打细胞使得团状细胞分散,以所需细胞密度接种细胞。
1.2.2 TT细胞增殖影响的测定 采用MTT比色法。消化、收集对数生长期的TT细胞,使用含10%胎小牛血清的培养液配成5×104个/ml单个细胞悬液,每孔加200μl,以每孔10 000个细胞接种至96孔板。37℃、5% CO2培养箱孵育24h致细胞贴壁,分别加入200μl含不同终浓度的紫草素(0.5、1、2、4μg/ml),每组5个复孔,并设立空白对照组(仅加入完全培养基)。37℃、5%CO2培养箱分别培养24、48、72h,培养后每孔加MTT溶液(5mg/ml,PBS配制)20μl,37℃、5%CO2培养箱继续孵育4h。终止培养,小心吸弃孔内培养上清液。每孔加入150μl DMSO,振荡10min,使结晶物充分融解。选择490nm作为检测波长,在全波长多功能酶标仪(INFINTE M200)测定各孔光吸收值(OD值),记录结果。根据MTT结果算抑制率:抑制率=1-OD加药/OD空白× 100%。
1.2.3 TT细胞周期分布的改变 采用流式细胞术。取对数生长期细胞,6孔板内每孔接种3×105个细胞,置于37℃、5%CO2培养箱内培养12h,待其贴壁。弃上清液,每孔加入3ml含2、4μg/ml紫草素的完全培养基,继续培养24h,并设立空白对照组。胰酶消化,收集细胞,弃上清液,用预冷PBS洗涤细胞2次,加入预冷70%乙醇,于-20℃固定过夜。3 000 r/min离心10min,弃上清液,收集细胞,用预冷PBS洗涤细胞3次,弃上清液,加入200μl细胞周期染液(Guava Cell Cycle Reagent,美国Millipore公司)后混匀,避光室温孵育30min。流式细胞仪(Guava easycyte plus,美国Millipore公司)检测周期分布。
1.2.4 细胞凋亡率检测 采用流式细胞术。取对数生长期细胞,6孔板内每孔接种3×105个细胞,置于37℃、5% CO2培养箱培养12h,待其贴壁。弃上清液,每孔加入3ml含2μg/ml紫草素的完全培养基,继续培养24h和48h,并设立空白对照组。胰酶消化,1 000r/min离心10min收集细胞,PBS洗涤细胞3次,加入200μl AnnexinV-PE及7-AAD的细胞凋亡检测试剂后混匀,避光室温孵育30min。流式细胞仪分析紫草素对TT细胞凋亡的影响。
1.2.5 透射电镜观察细胞凋亡和自噬形态 取对数生长期细胞,以3×105个细胞密度接种于6孔板中,接种12h后进行加药处理。空白对照组细胞(仅加入F-12K完全培养基)和处理组(以浓度为2、4μg/ml的紫草素处理TT细胞)细胞分别经温PBS液洗涤2~3次,刮取细胞并将其移入离心管中,1 000r/min离心5min,弃上清液;细胞沉淀采用2%戊二醛4℃预固定2h,PBS洗涤3次,在2.5%的戊二醛溶液中4℃固定过夜,将经过渗透处理的样品包埋,70℃加热过夜,即得到包埋好的样品。样品在Reichert超薄切片机中切片,获得70~90nm的切片,该切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色15min,透射电镜中观察。
1.3 统计学处理 采用SPSS19.0统计软件,计量资料采用表示,组间比较较采用t检验。
2 结果
2.1 紫草素对TT细胞增殖的影响 MTT结果显示,不同浓度紫草素作用24~72h对TT细胞增殖均有抑制作用,并随药物浓度增加和作用时间延长而增强,详见表1。

表1 不同浓度紫草素作用TT细胞的抑制率(%)
2.2 紫草素对TT细胞周期分布的影响 流式细胞仪检测TT细胞空白对照组细胞周期时未发现G0/G1期前的亚二倍体峰(凋亡峰),2μg/ml浓度的紫草素处理细胞24h开始出现亚二倍体峰;紫草素浓度4μg/ml以上处理细胞时出现明显的G0/G1期前的亚二倍体峰(凋亡峰)(图2),与空白对照组细胞比较差异有统计学意义(P<0.01)。不同浓度紫草素作用TT细胞24h细胞周期的变化:M1、M2、M3细胞周期的百分比经药物作用后分别与空白对照组比较未见明显增高(P>0.05),即对细胞周期百分比的影响未见明显变化,详见表2。
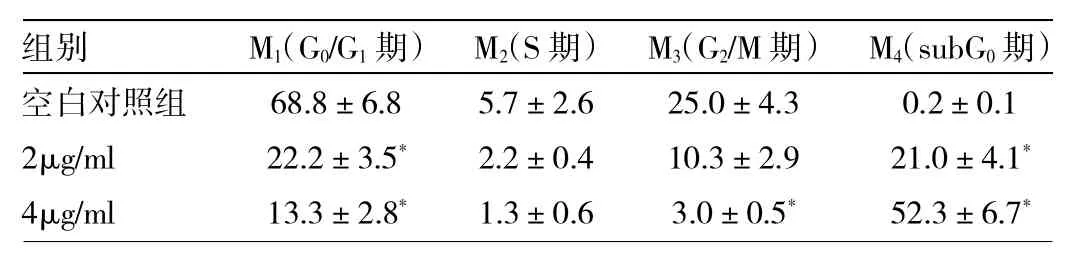
表2 不同浓度紫草素作用24h TT细胞周期分布的变化(%)
2.3 紫草素诱导TT细胞凋亡 为了进一步证实亚二倍体峰为凋亡峰,应用7-AAD及AnnexinV-PE双标记染色测定细胞凋亡。与空白对照组相比,2μg/ml浓度的紫草素作用TT细胞24h,早期凋亡(AnnexinV-PE+/7-AAD-)细胞从0.2%(空白对照组)增至8.0%;凋亡后期继发坏死(AnnexinV-PE+/7-AAD+)细胞,从0.1%(空白对照组)增至11.3%;紫草素处理48h后,早期凋亡细胞上升为24.9%,凋亡后期继发坏死细胞上升为14.2%(图3)。
2.4 透射电镜样品制备与观察TT细胞凋亡的形态 透射电镜观察空白对照组细胞的形态,发现各细胞器、细胞核、染色体形态和分布均正常(图4)。透射电镜观察2μg/ml紫草素作用24h后TT细胞,发现细胞结构出现两种典型的形态改变:凋亡(图5)和自噬体的形成(图6)。

图3 流式细胞术分析空白对照组和2μg/ml紫草素作用24、48h对TT细胞凋亡的影响(A:空白对照组;B:2μg/ml紫草素作用24h;C:2μg/ml紫草素作用48h)
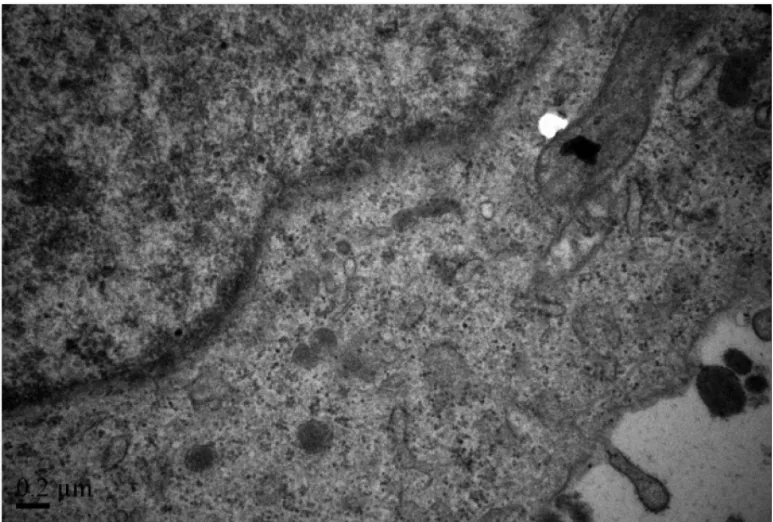
图4 透射电镜:空白对照组细胞,各细胞器、细胞核、染色体形态和分布均正常(×25 000)

图5 透射电镜:2μg/ml紫草素作用24h的TT细胞,细胞全面皱缩,但胞膜结构保持完整,胞核固缩或崩解而弥散在胞质内,染色质浓缩并边缘化(×8 000)
3 讨论
MTC 1959年由Hazard首次描述,其生物学恶性度介于甲状腺分化癌(乳头状癌和滤泡癌)与未分化癌之间,预后较乳头状癌和滤泡状癌差。目前手术切除仍是其首选根治方式,然而在确诊的同时大约50%~80%的患者已发生了颈部淋巴结转移或远处转移,而对于进展期或晚期伴远处转移的患者手术难以彻底清除肿瘤,许多患者无法实施根治性手术。近年来中药极其提取物在抗肿瘤方面取得了很好的成绩,积极寻求对MTC治疗有效的药物具有重要意义。

图6 透射电镜:2μg/ml紫草素作用24h的TT细胞,胞内出现典型的自噬囊泡:双层膜包绕的圆形或椭圆形结构(×25 000)
紫草为紫草科多年生草本植物新疆紫草或内蒙紫草的干燥根,在我国有悠久的药用历史,作为中药最早记载于东汉时期的《神农本草经》,具有清热凉血,活血,解毒透疹之功效,治温热斑疹、湿热黄疸、丹毒、痈疡等。紫草素是从紫草的根部提取的一种萘醌类化合物,现代研究表明紫草素及其衍生物有多种药理作用,如抗菌、抗炎、抗肿瘤、抗真菌、抗病毒、促进伤口愈合等[2-5,8-10]。
紫草素的抗肿瘤作用首次被报道是在1977年,Sankawa指出5~10mg/(kg·d)的紫草素能有效对抗腹水肿瘤的活性,并在1981年应用X线对紫草素、紫草及其衍生物进行了分析,得出紫草、紫草素及其衍生物具有抗肿瘤的特性[11-12]。此后国内外对紫草素的抗肿瘤作用有了很多进展。据报道,紫草素具有抗肿瘤效果,对HL60人早幼粒细胞白血病细胞系[13]、肝癌[14]、前列腺癌[14]、大肠癌[15]、口腔鳞癌[16]、基底细胞癌[17]、骨肉瘤[18]均有作用,影响肿瘤细胞的代谢、增殖、分化、信号传递、基因表达等过程,阻碍肿瘤细胞的生长[19]。
本研究发现,不同浓度紫草素(0.5~4μg/ml)作用细胞24h,对TT细胞的抑制率由11.3%(0.5μg/ml)上升至51.4%(4μg/ml);作用48h后,抑制率由15.8%(0.5μg/ ml)上升到62.7%(4μg/ml)。相同浓度的紫草素组对TT细胞增殖抑制率随着时间的增加而上升。紫草素对TT细胞增殖的抑制作用呈剂量和时间双重依赖性。流式细胞术检测空白对照组细胞周期分布时未发现G0/G1期前的亚二倍体峰(凋亡峰),2μg/ml浓度的紫草素处理细胞24h开始出现亚二倍体峰;4μg/ml紫草素处理组细胞出现明显的G0/G1期前的亚二倍体峰;但未改变TT细胞周期的分布,提示紫草素抑制TT细胞增殖不是通过诱导细胞周期阻滞的途径。
细胞凋亡早期改变之一是磷脂酞丝氨酸(PS)从细胞膜内转移到细胞膜外。在正常细胞中,PS只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中PS由脂膜内侧翻向外侧。Annexin V是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此Annexin V被作为检测细胞早期凋亡的灵敏指标之一。本研究结果发现,与空白对照组相比,2μg/ml浓度的紫草素作用TT细胞24h,早期凋亡细胞从0.2%(空白对照组)增至11.3%,凋亡后期继发坏死的细胞,从0.1%(空白对照组)增至8.0%;2μg/ml紫草素处理48h后,早期凋亡细胞增至24.9%;凋亡后期继发坏死的细胞,增至14.2%。这些结果表明,随着药物作用时间的上升紫草素诱导TT细胞凋亡和坏死的水平上升。
本研究以透射电镜观察细胞的超微结构可见部分典型的凋亡形态:微绒毛消失,细胞全面皱缩,细胞核碎裂,染色质浓聚形成半月体,细胞膜发泡,同时可见凋亡小体。此外,本研究通过电镜检测发现,紫草素处理TT细胞24h后,胞质内出现独立双层膜,且大部分呈弯曲或C型,另有一些双层膜已包绕部分胞质或细胞器,甚至部分细胞核,形成封闭的双侧膜囊泡,即自噬体,表明紫草素诱导的TT细胞死亡中,有细胞发生了自噬性活化。空白对照组以0.1%的DMSO处理细胞,细胞质内细胞器、细胞核、染色体形态和分布均正常,未见凋亡或自噬的典型形态。
综上所述,紫草素通过诱导细胞凋亡和自噬抑制使人MTC TT细胞增殖,笔者将对紫草素诱导TT细胞凋亡及自噬的分子机制做进一步研究。
[1]Cohen M S,Moley J F.Surgical treatment of medullary thyroid carcinoma.[J].Intern Med,2003,253(6):616-626.
[2]Sankawa U,Ebizuka Y,Miyazaki T,et al.Antitumor activity of shikonn and its derivatives[J].Chem Pharm Bull(Tokyo),1977,25(9):2392-2395.
[3]Sankawa U,Otsuka H,Kataoka Y,et al.Antitumor activity of shikonin,alkannin and their derivatives.II.X-ray analysis of cy-clo-alkannin leucoacetate,tautomerism of alkannin and cyclo-alkannin and antitumor activity of alkannin derivatives[J]. Chem Pharm Bull(Tokyo),1981,29(1):116-122.
[4]Su Y,Xie J,Wang Y,et al.Synthesis and antitumor activity of new shikonin glycosides[J].Eur J Med Chem,2010,45(7):2713-2718.
[5]Kontogiannopoulos K N,Assimopoulou A N,Tsivintzelis I,et al. Electrospun fiber mats containing shikonin and derivatives with potential biomedical applications[J].Int J Pharm,2011,409(1-2):216-228.
[6]Minemura K,Takeda T,Minemura K,et al.Cell-specific induction of sensitivity to ganciclovir in medullary thyroid carcinoma cells by adenovirus-mediated gene transfer of herpes simplex virus thymidine kinase[J].Endocrinology,2000,141(5):1814-1822.
[7]Soler M N,Milhaud G,Lekmine F,et al.Treatment of medullary thyroid carcinoma by combined expression of suicide and interleukin-2 genes[J].Cancer Immunol Immunother,1999,48(2-3):91-99.
[8]Sasaki K,Abe H,Yoshizaki F.In vitro antifungal activity of naphthoquinone derivatives[J].Biol Pharm Bull,2002,25(5):669-670.
[9]Tanaka S,Tajima M,Tsukada M,et al.A comparative study on anti-inflammatory activities of the enantiomers,shikonin and alkannin[J].J Nat Prod,1986,49(3):466-469.
[10]Papageorgiou V P,Assimopoulou A N,Ballis A C.Alkannins and shikonins:a new class of wound healing agents[J].Curr Med Chem,2008,15(30):3248-3267.
[11]Sankawa U,Ebizuka Y,Miyazaki T,et al.Antitumor activity of shikonin and its derivatives[J].Chem Pharm Bull(Tokyo),1977, 25(9):2392-2395.
[12]Sankawa U,Otsuka H,Kataoka Y,et al.Antitumor activity of shikonin,alkannin and their derivatives.II.X-ray analysis of cyclo-alkannin leucoacetate,tautomerism of alkannin and cyclo-alkan nin and antitumor activity of alkannin derivatives[J]. Chem Pharm Bull(Tokyo),1981,29(1):116-122.
[13]Hashimoto S,Xu M,Masuda Y,et al.beta-hydroxyisovaleryl-shikonin inhibits the cell growth of various cancer cell lines and induces apoptosis in leukemia HL-60 cells through a mechanism different from those of Fas and etoposide[J].J Biochem, 1999,125(1):17-23.
[14]Yang H,Zhou P,Huang H,et al.Shikonin exerts antitumor activity via proteasome inhibition and cell death induction in vitro and in vivo[J].Int J Cancer,2009,124(10):2450-2459.
[15]Hsu P C,Huang Y T,Tsai M L,et al.Induction of apoptosis by shikonin through coordinative modulation of the Bcl-2 family, p27,and p53,release of cytochrome c,and sequential activation of caspases in human colorectal carcinoma cells[J].J Agric Food Chem,2004,52(20):6330-6337.
[16]Nam K N,Son M S,Park J H,et al.Shikonins attenuate microglial inflammatory responses by inhibition of ERK,Akt,and NF-kappaB:neuroprotective implications[J].Neuropharmacology,2008, 55(5):819-825.
[17]Min R,Tong J,Wenjun Y,et al.Growth inhibition and induction of apoptosis in human oral squamous cell carcinoma Tca-8113 cell lines by Shikonin was partly through the inactivation of NF-kappaB pathway[J].Phytother Res,2008,22(3):407-415.
[18]Chang I C,Huang Y J,Chiang T I,et al.Shikonin induces apoptosis through reactive oxygen species/extracellular signal-regulated kinase pathway in osteosarcoma cells[J].Biol Pharm Bull,2010,33(5):816-824.
[19] 黄河,刘宗潮.紫草素及其衍生物的抗肿瘤作用[J].肿瘤防治杂志, 2005,12(1):75-78.
Shikonin induces apoptosis of human thyroid carcinoma TT cells
Objective To investigate the effect of shikonin on proliferation of human thyroid carcinoma TT cells.MethodsHuman thyroid carcinoma TT cells were treated with shikonin in vitro.Cell proliferation was examined by MTT method,cell apoptosis was detected by flow cytometry.ResultsMTT assay showed that shikonin inhibited TT cell proliferation in a dose-and time-dependent manner(P<0.01).Flow cytometry revealed sub-diploid(apoptosis)peaks in TT cells after treated with shikonin 2μg/ml and 4μg/ml for 24h;however,there was no cell cycles arrest.Annexin V-PE/7-AAD staining also demonstrated cell apoptosis.Electron microscopy showed typical morphological characteristics of autophagy and cell apoptosis after treatment of shikonin.ConclusionShikonin can inhibit proliferation of human thyroid carcinoma TT cells,which is associated with the cell apoptosis and autophagy.
Shikonin Medullary carcinoma of thyroid Cell proliferation Cell apoptosis


2013-08-09)
(本文编辑:严玮雯)
浙江省自然基金课题(LY13H130003)
310006 杭州,浙江中医药大学附属第一医院耳鼻咽喉科(唐旭霞);浙江省人民医院外科(叶再元)
叶再元,E-mail:yezhaiyuan@163.com
