C-MYC在涎腺腺样囊性癌中的表达及意义
2014-04-13胡思思葛明华凌志强陆晓筱郑传铭陈超谭卓
胡思思 葛明华 凌志强 陆晓筱 郑传铭 陈超 谭卓
C-MYC在涎腺腺样囊性癌中的表达及意义
胡思思 葛明华 凌志强 陆晓筱 郑传铭 陈超 谭卓
目的 研究原癌基因C-MYC在涎腺腺样囊性癌(SACC)中的表达及意义。方法应用免疫组化法对54例SACC和20例正常涎腺组织石蜡标本中C-MYC表达水平进行检测并比较。结果20例正常涎腺组织中C-MYC均呈阴性表达,54例SACC标本中C-MYC阳性表达43例,阳性率为79.6%,差异有统计学意义(P<0.05)。有神经浸润、T4期C-MYC阳性率较无神经浸润、T1~3期高(P<0.05),C-MYC的表达与年龄、性别、肿瘤部位、组织学类型、远处转移及淋巴结转移等生物学特性的差异均无统计学意义(均P>0.05)。结论原癌基因C-MYC在SACC中高表达,与T分期及神经侵犯有关,有望成为SACC进展及预后的生物学标志之一。
腺样囊性癌 涎腺肿瘤 C-MYC基因 免疫组化
涎腺腺样囊性癌(SACC)约占口腔、颌面部总恶性肿瘤的1%,占所有涎腺总恶性肿瘤的21.9%[1],可以发生在任何涎腺,其中50%~60%发生在小涎腺。SACC生长缓慢,易发生局部浸润、神经浸润、原位复发以及远处转移。C-MYC原癌基因位于8q24染色体,与N-MYC、L-MYC共同归属于MYC家族[2]。C-MYC蛋白是一种涉及细胞分化、生长、增殖以及凋亡的转录因子,并且参与调节人类15%的基因[3]。C-MYC原癌基因扩增与肿瘤形成及转归关系密切,目前已发现C-MYC在多种肿瘤中呈现高表达和(或)扩增,如肝癌、乳腺癌、宫颈癌、前列腺癌等[4-7]。有研究发现MYC基因仅在9%SACC样本中扩增[8]。本研究选取SACC的手术标本54例,采用免疫组化法观察组织中C-MYC的表达情况,从而研究C-MYC在SACC的表达水平和临床意义,现报道如下。
1 对象和方法
1.1 对象 选取浙江省肿瘤医院2000-10—2009-05收治经病理诊断确认的SACC患者54例,男23例,女31例,年龄27~76岁,平均(49.0±0.5)岁,其中<46岁26例,≥46岁28例。根据国际抗癌联盟分期标准(2010年)[9],T1~3期23例,T4期31例,有神经侵犯30例,无神经侵犯24例。根据组织学类型分型,实性型18例,筛孔型24例,导管型12例。远处转移8例(经影像学及病理确诊均为肺转移),无远处转移46例。选取同期浙江省肿瘤医院20例经病理确认的正常涎腺组织,男7例,女13例,年龄23~72岁,平均(51.0±0.3)岁。
1.2 方法 将标本用甲醛固定、石蜡包埋、切片等一系列处理后进行SP免疫组化染色,包括切片脱蜡,滴加封闭液,依次加一抗(兔抗人C-MYC多克隆抗体,1∶250)、二抗(生物素标记的羊抗兔IgG),进行DNB显色、苏木素复染等。将切片置于400倍显微镜下观察并拍照,每张切片随即选取10个清晰、不重复的部位,进行图像分析,若细胞内(细胞核或细胞质)出现棕黄色颗粒,则评定为阳性细胞,总评分标准同时考虑阳性细胞百分比和显色程度:分别将阳性细胞百分比<5%、5%~24%、25%~49%、50%~74%、≥75%定为0、1、2、3、4分;按着色深浅分别将无着色、淡黄色、棕黄色、棕褐色定为0、1、2、3分。将两项分数相加后进行综合评分,0~2分、3~4分、5~6分、7分分别为阴性(-)、弱阳性(+)、阳性(++)、强阳性(+++)[10]。为了简化统计,将阴性、弱阳性均归为阴性(-),将阳性、强阳性均定为阳性(+)。所有切片由2位以上病理科医师复核。
1.3 统计学处理 采用SPSS17.0统计软件。C-MYC的表达与年龄的关系采用Pearsonχ2检验,C-MYC的表达与组织学类型的关系采用对数似然比法,C-MYC的表达与性别、肿瘤部位、T分期、远处转移、神经侵犯以及淋巴结转移的关系采用Fisher确切概率法。
2 结果
2.1 C-MYC在SACC中的表达 C-MYC在20例正常涎腺组织中均呈阴性表达,在54例SACC组织中,阳性表达43例,阳性率79.6%(图1),两者差异有统计学意义(P<0.01)。
2.2 C-MYC表达与SACC生物学特征的关系 经病理及影像学确诊,8例远处转移患者均为肺转移。在30例有神经浸润的患者中,阳性表达30例;在24例无神经浸润的患者中,阳性表达13例;在T1~3期的23例SACC患者中,C-MYC阳性表达14例,T4期的31例患者中,C-MYC阳性表达29例。有神经浸润、T4期CMYC阳性率较无神经浸润、T1~3高,差异有统计学意义(P<0.05),C-MYC的表达与年龄、性别、肿瘤部位、组织学类型、远处转移及淋巴结转移等生物学特性的差异均无统计学意义(均P>0.05),详见表1。
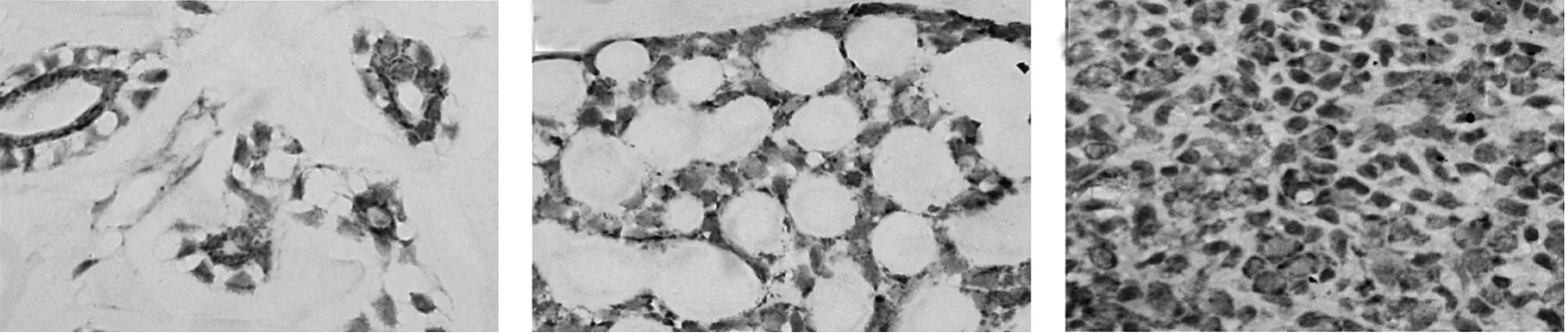
图1 SACC中C-MYC免疫组织化学结果(A:导管型;B:筛孔型;C:实性型;SP染色,×400)
3 讨论
C-MYC原癌基因激活方式主要包括基因扩增和染色体易位重排,在调节细胞生长、分化及恶性转化中发挥作用。在关于前列腺癌的研究中,人们发现8号染色体的突变,包括8q24扩增(涵盖C-MYC癌基因),与前列腺癌进展有关。Hawksworth等[7]检测经过显微切割的前列腺癌细胞和配对的癌旁组织C-MYC mRNA水平,结果发现前列腺癌中C-MYC的高表达是具有生物学相关性的,所以C-MYC有望成为前列腺癌生物标记物。研究还发现,C-MYC在胰腺癌[11]、神经外胚瘤[12]中发现C-MYC高表达和(或)扩增。Chen等[5]证明C-MYC蛋白是一种乳腺癌易感基因BRCA1的转录启动因子。像体内很多蛋白一样,C-MYC蛋白在调节蛋白的同时也受到其他蛋白的调节,如去泛素(DUBs)[13]。
C-MYC原癌基因具有转化细胞的能力,这也是CMYC原癌基因发挥致癌作用的机制之一。Kaposi-Novak等[4]发现C-MYC原癌基因的活化与肝退变结节进展为肝细胞癌有关。腺样囊性癌(ACC)高级别转化(以往称为去分化)是指低级别ACC向高级别或未分化癌进展转变的一种现象[14]。有研究证明,C-MYC原癌基因与ACC高级别转化有关[15]。Costa等[15]选取了5例高级别转化ACC患者,采用比较基因组杂交的方法以确定高级别转化腺样囊性癌的表观遗传改变,发现染色体增多大部分出现在高级别转化区域,而染色体缺失只出现在一般区域。有染色体增加的区域主要包括 8q24、17q11.2-q12、17q23和15q11-13;有染色体丢失的区域主要包括9q34、4p16、1p36.1和11q22;荧光原位杂交分析显示C-MYC增加。该研究证明ACC高级别转化过程进程中C-MYC基因扩增。
在54例SACC中,C-MYC原癌基因阳性表达43例,阳性率为79.6%,明显高于正常涎腺组织。本次研究进行的C-MYC的表达与54例SACC临床病理因素分析表明,有神经浸润、T4期C-MYC阳性率较无神经浸润、T1~3高(P<0.05),C-MYC与T分期及神经侵犯相关。涎腺恶性肿瘤的T分期主要依据肿瘤大小及有无腺体外侵犯,已有研究证明MYC基因扩增与乳腺癌侵袭性相关[16],另一项研究表明C-MYC原癌基因的表达与胰腺癌神经侵犯有关[17],因此在SACC中,C-MYC高表达有利于肿瘤浸润神经,并且向高级别肿瘤进展。同时本研究统计分析显示C-MYC与远处转移及淋巴结转移无关,考虑样本量太少,尚需进一步验证。SACC较为经典的生物标记物包括p53和细胞周期蛋白D1[18],C-MYC是否能成为SACC的新的生物标记物尚需进一步研究。
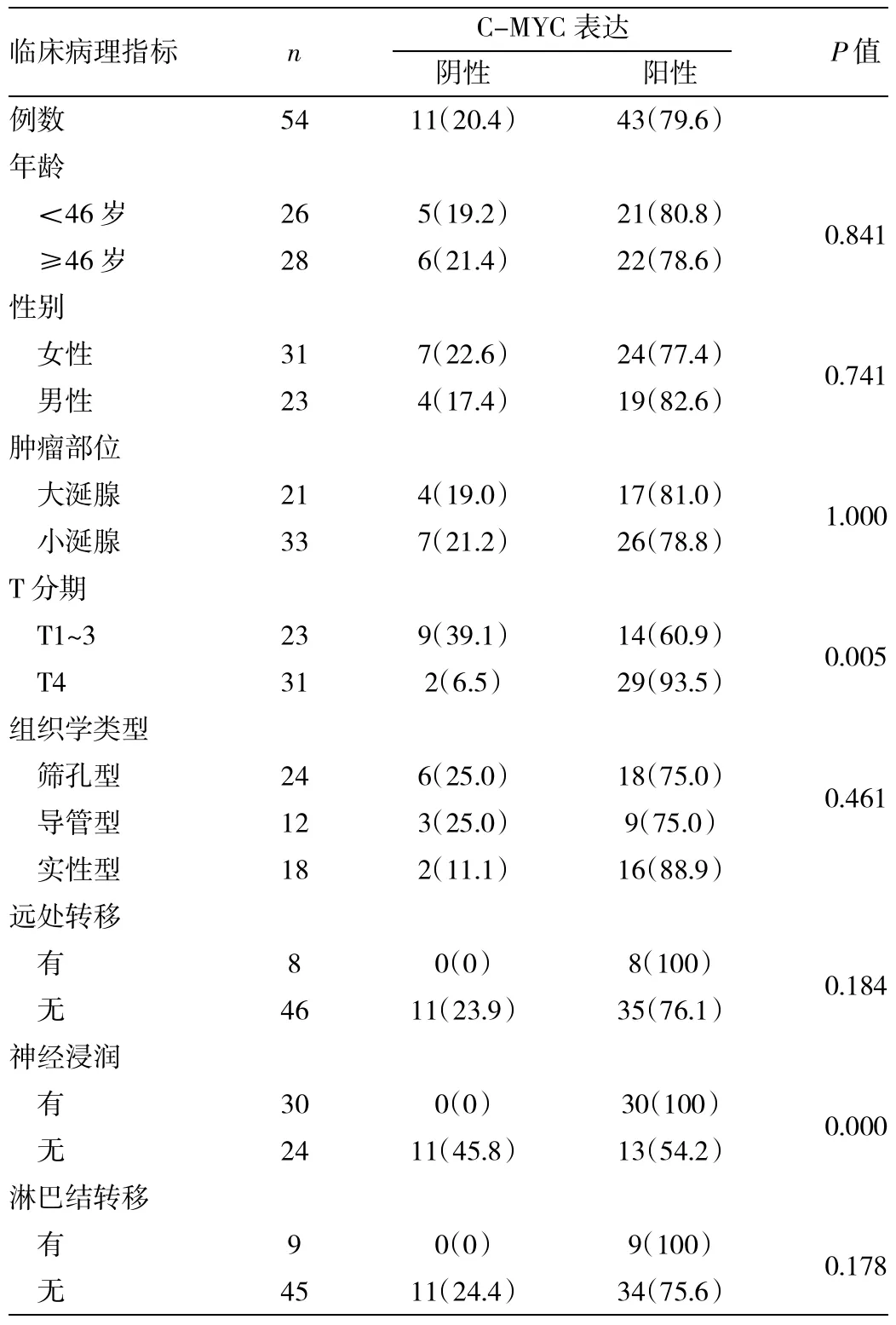
表1 C-MYC表达与54例SACC临床病理因素的相关性[例(%)]
[1]Godge P,Sharma S,Yadav M.Adenoid cystic carcinoma of the parotid gland[J].Contemp Clin Dent,2012,3(2):223-226.
[2]Pouryazdanparast P,Brenner A,Haghighat Z,et al.The role of 8q24 copy number gains and c-MYC expression in amelanotic cutaneous melanoma[J].Mod Pathol,2012,25(9):1221-1226.
[3]Dang C V,O'Donnell K A,Zeller K I,et al.The c-Myc target gene network[J].Semin Cancer Biol,2006,16(4):253-264.
[4]Kaposi-Novak P,Libbrecht L,Woo H G,et al.Central role of c-Myc during malignant conversion in human hepatocarcinogenesis[J].Cancer Res,2009,69(7):2775-2782.
[5]Chen Y,Xu J,Borowicz S,et al.c-Myc activates BRCA1 gene expression through distal promoter elements in breast cancer cells[J].BMC Cancer,2011,11:246-259.
[6]Rughooputh S,Manraj S,Eddoo R,et al.Expression of the c-myc oncogene and the presence of HPV 18:possible surrogate markers for cervical cancer[J].Br J Biomed Sci,2009,66(2):74-78.
[7]Hawksworth D,Ravindranath L,Chen Y,et al.Overexpression of C-MYC oncogene in prostate cancer predicts biochemical recurrence[J].Prostate Cancer Prostatic Dis,2010,13(4):311-315.
[8]Sequeiros-Santiago G,Garcia-Carracedo D,Fresno M F,et al. Oncogene amplification pattern in adenoid cystic carcinoma of the salivary glands[J].Oncol Rep,2009,21(5):1215-1222.
[9]Sobin L H,Gospodarowicz M K,Wittekind C.International Union Against Cancer(UICC):TNM Classification of Malignant Tumours [M].7th.New York:Wiley-Liss,2010:117-126.
[10] 葛明华,凌志强,谭卓,等.表皮生长因子受体在涎腺腺样囊性癌中的表达及其在肿瘤侵袭中的作用[J].中华肿瘤杂志,2012,34(4):278-280.
[11]Thakur A,Bollig A,Wu J,et al.Gene expression profiles in primary pancreatic tumors and metastatic lesions of Ela-c-myc transgenic mice[J].Mol Cancer,2008,7:11-27.
[12]Momota H,Shih A H,Edgar M A,et al.c-Myc and beta-catenin cooperate with loss of p53 to generate multiple members of the primitive neuroectodermal tumor family in mice[J].Oncogene, 2008,27(32):4392-4401.
[13]Sacco J J,Coulson J M,Clague M J,et al.Emerging roles of deubiquitinases in cancer-associated pathways[J].IUBMB Life, 2010,62(2):140-157.
[14]Costa A F,Altemani A,Hermsen M.Current concepts on dedifferentiation/high-grade transformation in salivary gland tumors [J].Patholog Res Int,2011,2011:325965.
[15]Seethala R R,Cieply K,Barnes E L,et al.Progressive genetic alterations of adenoid cystic carcinoma with high-grade transformation[J].Arch Pathol Lab Med,2011,135(1):123-130.
[16]Singhi A D,Cimino-Mathews A,Jenkins R B,et al.MYC gene amplification is often acquired in lethal distant breast cancer metastases of unamplified primary tumors[J].Mod Pathol,2012, 25(3):378-387.
[17]He C,Jiang H,Geng S,et al.Expression of c-Myc and Fas correlates with perineural invasion of pancreatic cancer[J].Int J Clin Exp Pathol,2012,5(4):339-346.
[18]Wegner A,Wasniewska E,Jarmolowska-Jurczyszyn D,et al. The role of immunohistochemical staining(protein p53,cyclin D1)in the prognosis of adenoid cystic carcinoma salivary gland tumors[J].Otolaryngol Pol,2007,61(4):423-427.
Expression of C-MYC in salivary adenoid cystic carcinoma and its clinicopathological significance
Objective To investigate the expression of C-MYC in salivary adenoid cystic carcinoma(SACC)and clinicopathological significance.MethodsImmunohistochemisty was used to determine tissue expression of C-MYC in 54 patients with salivary adenoid cystic carcinoma from Zhejiang Provincial Cancer Hospital and 20 samples of normal gland tissue.The clinicopathological significance of C-MYC expression was analyzed.ResultsC-MYC was positively expressed in 43 of 54 SACC tissues and none of 20 normal salivary gland tissues with the positive rate was 79.6%and 0.0%,respectively(P<0.05).Furthermore,C-MYC expression was higher in stage T4and perineural invasion patients than those with state T1~3 and no perineural invasion patients(P<0.05).C-MYC expression was not correlated with age,gender,tumor location,lymph node metastasis,distant metastasis and histological type(P>0.05).ConclusionThe expression of proto-oncogene C-MYC was correlated with T staging and perineural invasion in SACC,incicating that it may be uses as a biological marker for SACC progress and prognosis.
Carcinoma Adenoid cystic salivary gland neoplasms C-MYC Immunohistochemistry


2013-10-15)
(本文编辑:严玮雯)
浙江省医药卫生平台重点资助计划(2012ZDA005);浙江省卫生高层次创新人才培养工程基金资助[浙卫发2008(134)]
325035 温州医科大学(胡思思、葛明华、陆晓筱);浙江省肿瘤医院、浙江省肿瘤研究所(凌志强),头颈肿瘤外科(郑传铭、陈超、谭卓)
葛明华,E-mail:gemingh@163.com
