漆树的药理研究进展
2014-04-11李顺祥傅超凡
潘 宇, 李顺祥, 傅超凡
(1.湖南中医药大学药学院, 湖南 长沙 410208; 2.湖南憨豆农林科技有限公司, 湖南 长沙 410004)
漆树的药理研究进展
潘 宇1, 李顺祥*, 傅超凡2
(1.湖南中医药大学药学院, 湖南 长沙 410208; 2.湖南憨豆农林科技有限公司, 湖南 长沙 410004)
目的 漆树在东亚地区沿用历史悠久,其炮制品干漆在中国古代常用于祛瘀、破积、通经、止痛、杀虫。现代研究发现漆树的有效成分具有抗癌、抗炎、抗菌、抗氧化的主要药理作用。本文综述了近年来国内外漆树药理实验相关研究,为深度挖掘漆树的医学价值提供理论依据。
漆树;药理成分;药理作用;综述
漆 树 ( 原 Rhus verniciflua Stokes, 现 Toxicodendron vernicifluum ( Stokes) F.A.Barkley) 在 中 国、 韩 国 与 日 本 作为一种传统的草本药,其炮制品干漆具有益气补虚、祛瘀通经、 消积杀虫的功效, 最早载于 《神农本草经》, 列为上品。《本草纲目》 所载干漆其味为辛、苦,性温,有毒,入肝、胃经;主要功效为祛瘀、破积、通经、止痛、杀虫。民间常用漆树籽油炖鸡,治疗产妇营养不良、腹部不适或消化不良等症。近年来,随着国内外药理研究不断深入,漆树的医疗价值逐渐被世人重视,特别是韩国在药理方面研究最多, 许多试验研究证实漆树的提取物 (RVS) 含有的漆树黄酮、漆树多糖与糖蛋白具有抗癌、抗炎、抗菌、抗氧化等多种药理作用,揭示漆树在临床医学领域具有很大的潜在开发前景。
1 药理成分
漆树的主要活性成分是生漆, 而漆酚 (urushiol) 是生漆主要成分, 含有量占生漆的 60% ~70%, 是一种具有 15~17 个碳原子的不同饱和度长侧链的单元酚、 邻苯二酚或间苯二酚的混合物,含致敏性的毒性物质,能引起皮肤瘙痒等过敏反应,现代药理研究多除去漆酚,降低漆树治疗疾病的副作用。不少研究发现漆树的提取物含有丰富的黄酮类物质: 黄颜木素 ( fustin) 、 非瑟酮 ( fisetin) 、 硫 菊 黄素 ( sulfuretin) 、 紫铆因 ( butein) 等化合物[1]( 具体结构见图 1), 2% ~5%的漆树多糖 (相对分子质量为 0.78 × 104~1.58 ×104) 和 3% ~7%的糖蛋白, 药理研究主要集中在以上三大活性成分。
2 药理作用
2.1 抗肿瘤作用 Kotake等[2]开始研究漆树多糖的抗癌作用, 其动物体内试验发现天然漆树多糖对 S180肉瘤荷瘤小鼠具有显著的抑制活性,证实漆树多糖的抗癌活性取决于多糖分子量大小与侧链结构,低剂量、低分子量漆树多糖的抗癌活性更强。由于多糖结构复杂以及分子量很大,对漆树多糖的抗癌活性的作用机制,漆树多糖不同侧链结构的抗癌活性强弱的相关研究远远不够,目前此方面的深入研究有待加强。 Choi等[3]证实了漆树提取物的糖蛋白与黄酮类物质能显著抑制人体慢性B淋巴细胞白血病增殖。
随着研究的深入,国外学者在细胞水平上开始关注漆树提取物抑制肿瘤增殖的作用机制,并且发现漆树黄酮类提取物, 具有十分明显的抑制肿瘤生长的活性。 Samoszuk等[4]从漆树提取的紫铆因, 证实紫铆因利用干预人体乳腺癌细胞系 UACC-812 与纤维细胞相互作用的间接机制, 抑制乳腺癌细胞克隆生长。 Son 等[5]证实漆树的三氯甲烷–甲醇提取物部分 (RCMF) 能选择性抑制与诱导凋亡转移肝细胞系生长, 其选择性抑制机制可能是与 RCMF降低BNL SV A.8 细胞系的 MnSOD (锰超氧化物歧化酶) 的活性与细胞内 GSH (谷胱甘肽) 水平有关。 后来, 人们开始从分子水平来研究漆树的抑制肿瘤增殖的作用机制。 Huang等[6]从漆树 科 ( Anacardiaceae) 的 野 漆 树 ( 原 Rhus succedanea L., 现 Toxicodendron succedaneum ( L.) Kuntze) 汁液中分离出 3 种与烷基苯二酚 (alkyl hydroquinone) 结构相似的氢醌类 (hydroquinone) 化合物, 发现 10'(Z), 13'(E),15'( E)-heptadecatrienylhydroquinone[ HQ17 (3) ] 是一种 拓扑异构酶 (Topo) Ⅱ抑制剂, 对癌细胞最具细胞毒性, 能抑制白血病 ( leukemia HL-6 ) 细胞生长, 其作 用机制是通过聚集 TopoⅡ-DNA裂解复合体, 迅速抑制 HL-60 细胞的DNA合成与破坏染色体, 不可逆抑制 TopoⅡα活性。 实验结果说明除了黄酮类之外,漆树极有可能还存在另外一种非常有效的抑制肿瘤活性成分,可开发为一种高效低毒的抗癌靶向药物的替代品。
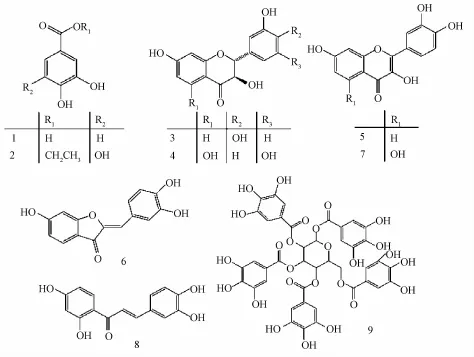
图1 漆树中黄酮类化合物的结构
最近,人们开始关注漆树提取物的临床疗效试验,证实漆树提取物结合化学疗法或者其他化学药物具有更加明显的抑制肿瘤增殖作用,并且能降低西药化疗的副作用与耐药性,多例临床试验结果表明,利用漆树提取物与其他疗法或者药物可作为综合治疗肿瘤的手段。
Lee等[7]证 实 漆 树 提 取 物 能 阻 止 人 体 血 清 尿 素 氮(BUN)、 肌酐 (Cr)、 丙氨酸转氨酶 (ALT)、 天冬氨酸转氨酶 (AST) 与一氧化氮 (NO) 增加, 同时减少肝肾组织的丙二醛 (MDA) 水平, 提高抗氧化酶 (过氧化氢酶、 谷胱甘肽与超氧化物歧化酶)的活性,能降低顺铂化疗的副作用。 Kim等[8]进一步发现去致敏成分 (除去漆酚) 的漆树提取物,利用抑制人体肿瘤细胞系的恶性细胞增殖、抗半胱天冬酶-9 (Caspase-9) 细胞凋亡与抑制 PI3K-Akt/PKB通道的机制,降低肝癌患者进行肝移植手术后的肝癌细胞转移的复发几率, 并且降低阿霉素 ( adriamycin) 产生的耐药性。 Cheon 等[9]与 Lee等[10]的抗癌临床研究证实了除致敏成分漆树的提取物与化疗联合治疗确实能明显降低化疗抑制恶性肿瘤增殖的副作用。
Li等[11]与 Ko等[12]的研究证实漆树提取物 ( 黄酮衍生物与漆树多糖蛋白)是通过诱导癌细胞凋亡机制发挥抗癌作用, Kim等[13]证实漆树提取物是通过激活癌细胞凋亡信号通路, 活化 Caspase和 Bax蛋白、 抑 制 Bcl-2 蛋 白 表 达、释放细胞色素 C的机制发挥抗癌药理作用, Kim等[13]进一步发现漆树的诱 导 癌 细胞凋亡 机 制是通过 减 少 Bcl-2 蛋白家族表达与增加 Bax蛋白表达、 调节线粒体膜外电势(MMP, ψΔWm) 损失与释放细胞色素 C到胞液、 活化Caspase-9 灭活致癌因子 PI3K-Akt/PKB激酶。
以上研究说明,漆树提取物的抗癌作用机制比较复杂,主要是抑制癌细胞增殖、诱导癌细胞凋亡、调节癌细胞信号通路,调节蛋白质表达及清除自由基等达到抗肿瘤作用,表明漆树提取物作为抗癌药物具有潜在的开发前景。
2.2 抗炎作用 Oh 等[14]从漆树提取的糖蛋白, 证实作用机制是通过抑制脂多糖 (LPS) 诱导巨噬细胞系 (RAW)264.7 的炎症疾病信号因子: 胞内蛋白激酶 (PKCa)、 一氧化氮 合 酶 ( iNOS ) 、 环 氧 化 酶 ( COX-2 ) 、 催 化 蛋 白-1(AP-1) 和核酸因子 (NF-κB) 水平表达, 体现抗炎活性。
Jung等[15]从漆树提取出不同的酚性物质 ( PRF), 证实作用机制是影响与炎症密切相关的细胞信号分子活动:通过有效抑制磷酸化–氨基末端激酶 ( phospho-JNK1/2)与转录因子 NF-κB的信号通路, 呈浓度依赖性抑制 NO、前列腺素 E2 ( PGE2)、 肿瘤坏死因子-α ( TNF-α)、 iNOS蛋白与 COX-2 蛋白表达, 利用调节 LPS 诱导途径–丝裂原活化蛋白激酶 (MARKs) 信号通路 (胞外信号调节酶、p38 丝裂原活化蛋白激酶和氨基末端激酶), 显著抑制 LPS诱导 RAW 264.7 的炎症反应。
Lee等[16]证实其抗炎机制是漆树提取物的非 瑟酮 ( fisetin) 能减少细胞外信号调节激酶 ( ERK) 与氨基末端激酶 (JNK) 磷酸化, 同时激活类风湿关节炎 1L-1B-诱导成纤维样滑膜细胞 p38MARK磷酸化, 通过降低血管通透性、白细胞迁移,提高细胞免疫力表现明显的抗炎活性,并能降低胶原诱导关节炎模型的炎症发生率与损害率。 Lee等[17]证实漆树提取物中的硫黄菊素 ( sulfuretin) 能增强血红素加氧酶 (HO-1) 表达, 抑制 LPS 诱导 C57BL/6 小鼠腹膜巨噬细胞 RAW264.7 的 NO、 PGE2、 TNF-α和 IL-1β产生达到抗炎作用。
以上研究证实,漆树提取物的抗炎作用机制主要是通过调节炎症疾病信号因子表达与调控信号分子的信号通路来体现抗炎活性。
2.3 抗菌作用 Choi等[18]利用体外细胞培养方法发现漆酚能显著降低大肠杆菌 ( Escherichia coli) 和酵母菌 ( Saccharomyces cerevisiae) 造成的生物淤积影响。 Kim等[19]的动物药理实验研究证实漆树的黄酮类化合物结构不同,其抑菌强度不同,抑制的菌种种属也不同。此实验明确了漆树提取物的结构与抑菌强度、 抑制菌种的关系。 Suk 等[20]研究漆树提取的漆酚二聚体~四聚体在实验动物体内的抑菌机制,发现漆树提取物能迅速促进小鼠体内幽门螺杆菌( Helicobacter pylori) 菌株内 的 细 胞 膜 分 裂 与 细 胞 溶 解, 并降低或根除胃组织内的白介素 (IL-1) 表达。
以上实验说明,漆树提取物的抑菌作用相关报道不多,多是停留在在动物体内/体外的药理实验研究水平上, 通过观察实验抑菌参考指标来确定漆树提取物的抑菌强度,而相关临床研究目前尚未发现公开报道。
2.4 降血糖、 降血脂作用 Jung等[21]证实, 漆树提取物能显著抑制链脲霉 素 ( streptozocin) 诱 导 的 糖 尿 病 小 鼠 模型的血糖水平与血液硫代巴比妥酸反应物富集 (P<0.05)。 Lee等[1]证 实漆 树 提 取物 比 化 学 药物 依 帕 司 他( Epalrestat) 、 氨基胍 ( Am inoguanidine) 具有更高的抑制血糖水平, 具 有 很 强 的 治 疗 糖 尿 病 并 发 症 的 作 用。 Jeong等[22]证实漆树提取物通过抑制细胞因子诱导 NO产物形成、 iNOS 诱导蛋白质表达、 NF-κB转录以及胰岛素分泌,保护胰腺 β-细胞来治疗 I型糖尿病。
Oh 等[23]证实漆树提取物提取的糖蛋白, 具有调节 NF-κB与催化蛋白-1 的转录因 子水平, 引起氚 核华氏-1339 诱导高血脂小鼠模型总胆固醇 (TC)、 甘油三酯 (TG)、 低密度脂蛋白 (LDL) 降低、 而高密度脂蛋白 (HDL) 升高、一氧化氮产物 ( NO) 降低、 3-羟基-3-甲基辅酶 A (HMGCoA) 还原酶活性与硫代巴比妥酸反应物 (TBARS) 活性显著提高, 同时过氧化氧酶 (CAT)、 超氧化物岐化酶(SOD)、 谷胱甘肽过氧化物酶 (GPx) 活性增强。
漆树提取物的降血糖作用研究相对较多,而降血脂作用相关研究鲜有报道,糖蛋白在降血脂起着关键作用,提示漆树提取物在治疗糖尿病方面可能具有利用价值。
2.5 抗凝血作用 Lee等[24]研究硫酸化漆树多糖的抗凝血作用与结构之间的关系,发现反应活性大小与漆树多糖羟基位置, 硫基位置相关 ( C-6 >C-2 >C-4, 硫基主要连接在 C-2 羟基上), 并引入羧基, 能缩短漆树多糖的凝血时间。 实验结果表明硫基与羧基具有协同作用, 侧链的 6-OSO3基团在抗凝血活性具有重要作用。 Liu 等[25]采用流式细胞仪测定健康人体的细胞内的钙动员响应,发现漆树提取物能控制血小板膜上受体表达的构象变化,显著抑制钙动员和血小板凝聚。
2.6 神经调节作用 Sapkota等[26]证实 漆树提取物在信使RNA与蛋白质水平上, 能显著调节大鼠大脑与人体多巴胺细胞系 SH-SY5YRA的脑源性神经营养因子 (BDNF) 和神经胶质细胞源性的神经营养因子 (GDNF) 基因表达。 实验表明漆树提取物具有神经调节和神经保护的作用,对帕金森病具有潜在的治疗作用。 Cho等[27]证实漆树提取物利用抗谷氨酸盐诱导神经毒性与减少活性氧族 (ROS) 产生的机制, 明显保护小鼠海马 HT22 细胞, 保护 SOD、 糖皮质激素受体 (GR)、 GSH-Px的生物活性, 显著抑制微神经胶质 BV2 细胞的 LPS 诱导 NO产生, 发挥明显的抗氧化作用。结果表明,漆树提取物中的黄酮类物质具有治疗氧化应激与病理炎性导致的神经退行性疾病。 Kim等[28]动物实验证实漆树叶提取物可能对帕金森疾病具有潜在治疗作用。
2.7 其他方面作用 漆树提取物还具有抗氧化作用[29]、抗病毒作用[30]、 抗脂肪形成[31]、 治疗急性肾 衰竭[25]、 治疗青光眼[32]、 抗过敏[33]等。
3 结 论
中国是生产漆树最多的国家,资源丰富,使用历史悠久,古代曾有利用漆树树脂制成的炮制品干漆来治疗多种疾病的先例。国外的研究者大多是关注漆树提取物的有效部位或者有效成分的药理作用,特别是黄酮类成分研究最多,如黄颜木素、非瑟酮、硫菊黄素、紫铆因等,在抗肿瘤、抗炎、抗菌、神经调节等药理作用最为突出,但是对其结构分析鉴定鲜有报道,对药理作用与结构之间的关系研究甚少。漆树多糖与糖蛋白在抗氧化、降血糖和抗凝血方面具有显著的生活活性。以上众多研究显示,漆树提取物的抗癌与抗炎药理作用相对突出,非常值得继续关注。此外,漆树提取物与其它药物联合运用比单独使用漆树提取物具有更好的生物活性,这成为今后临床治疗相应病症的发展趋势。但是,各类成分深层次的活性机制方面以及不同成分之间协同拮抗机理需要深入研究,比如漆树提取物内的大分子物质糖蛋白与黄酮类物质是否具有共同发挥药理作用,如何降低致敏性成分漆酚对人体皮肤以及肠胃的不良反应,提高漆树药理成分在人体的生物利用度,将是今后一个重要研究课题。
[ 1 ] Lee E H, Song D G, Lee JY, et al.Inhibitory effect of the compounds isolated from Rhus verniciflua on aldose reductase and advanced glycation endproducts[ J] .Biol Pharm Bull,2008, 31(8): 1626-1630.
[ 2 ] Kotake T, Dina S, Konishi T, etal.Molecular cloning ofaβgalactosidase from radish that specifically hydrolyzesβ-( 1 →3) -and β-(1→6) -galactosyl residues of arabinogalactan protein[ J] .JPlant Physiol, 2005, 138: 1563-1576.
[ 3 ] Choi H S, Seo H S, Kim S R, et al.Antiinflammatory and antiproliferative effects of Rhus verniciflua Stokes in RAW264.7 cells[ J] .Mol Med Rep, 2014, 9(1): 311-315.
[ 4 ] Samoszuk M, Tan J, Chorn G.The chalcone butein from Rhus verniciflua Stokes inhibits clonogenic growth of human breast cancer cells co-cultured with fibroblasts[ J] .BMCComplem Altern MBMC Complem Altern Med, 2005, 5: 5.
[ 5 ] Son Y O, Lee K Y, Lee JC, et al.Selective antiproliferative and apoptotic effects of flavonoids purified from Rhus verniciflua Stokes on normal versus transformed hepatic cell lines[ J].Toxicol Lett, 2005, 155(1) : 115-125.
[ 6 ] Huang C P, Fang W H, Lin L I, et al.Anticancer activity of botanical alkyl hydroquinones attributed to topoisomerase IIpoisoning[ J].Toxicol Appl Pharmacol, 2008, 227 ( 3 ):331-338.
[ 7 ] Lee JH, Lee H J, Lee H J, etal.Rhus verniciflua Stokes prevents cisplatin-induced cytotoxicity and reactive oxygen species production in MDCK-I renal cells and intactmice[ J] .Phytomedicine, 2009, 16(2/3): 188-197.
[ 8 ] Kim K S,Jung H S, ChoiW C, etal.A case of recurred hepatocellular carcinoma refractory to doxorubicin after liver transplantation showing response to herbal medicine product, Rhus verniciflua Stokes extract[ J] .Integr Cancer Ther, 2010, 9(1): 100-104.
[ 9 ] Cheon SH, Kim K S, Kim S, et al.Efficacy and safety of Rhus verniciflua Stokes extracts in patients with previously treated advanced non-small cell lung cancer[ J] .Forsch Komplementmed, 2011, 18(2) : 77-83.
[10] Lee S, Kim K, Jung H, et al.Efficacy and safety of standardized allergen-removed Rhus verniciflua Stokes extract in patients with advanced ormetastatic pancreatic cancer: A Korean Single-Center Experience [ J] .Oncology, 2011, 81 ( 5-6 ):312-318.
[11] Li Y, Ma C, Qian M, et al.Butein induces cellapoptosis and inhibition of cyclooxygenase2 expression in A549 lung cancer cells[ J] .Mol Med Rep, 2014, 9(2): 763-767.
[12] Ko JH, Lee S J, Lim K T.36kDa Glycoprotein isolated from Rhus verniciflua Stokes fruithas a protective activity to glucose/ glucose oxidase-induced apoptosis in NIH/3T3 cells[ J].Toxicol in Vitro, 2005, 19(3) : 353-363.
[13] Kim JH, Go H Y, Jin D H, et al.Inhibition of the PI3KAkt/PKB survival pathway enhanced an ethanol extract of Rhus verniciflua Stokes-induced apoptosis via amitochondrial pathway in AGS gastric cancer cell lines[ J].Cancer Lett, 2008, 265(2): 197-205.
[14] Oh P S, Lee S J, Lim K T.Glycoprotein isolated from Rhus verniciflua Stokes inhibits inflammation-related protein and nitric oixide production in LPS-stimulated RAW 264.7 cells[ J].Biol Pharm Bull, 2007, 30(1) : 111-116.
[15] Jung C H, Kim JH, Myung H H, et al.Phenolic-rich fraction from Rhus verniciflua Stokes( RVS) suppress inflammatory response via NF-κB and JNK pathway in lipopolysaccharide-induced RAW 264.7 macrophages[ J] .J Ethnopharmacol,2007, 110(3): 490-497.
[16] Lee J D, Huh J E, Jeon G J, et al.Flavonol-rich RVHxR from Rhus verniciflua Stokes and its major compoundfisetin inhibits inflammation-related cytokines and angiogenic factor in rheumatoid arthriticfibroblast-like synovial cells and in vivo models[ J] .Int Immunopharmacol, 2009, 9(3) : 268-276.
[17] Lee D S, Jeong G S, Li B, et al.Anti-inflammatory effects of sulfuretin from Rhus verniciflua Stokes via the induction of heme oxygenase-1 expression in murine macrophages[ J] .Int Immunopharmacol, 2010, 10(8) : 850-858.
[18] Choi Y H, Kim JC, Ahn JC, et al.Anti-biofouling behavior of natural unsaturated hydrocarbon phenols impregnated in PDMSmatrix[ J] .Ind Eng Chem, 2008, 14(3) : 292-296.
[19] Kim JS, Kwon Y S, Chun W J, et al.Rhus verniciflua Stokes flavonoid extracts have anti-oxidant, anti-microbial and α-glucosidase inhibitory effect[ J] .Food Chem, 2010, 120 ( 2 ):539-543.
[20] Suk K T, Baik SK, Kim H S, et al.Antibacterial effects of the urushiol component in the sap of the lacquer tree( Rhusverniciflua Stokes) on Helicobacter pylori. [ J] .Helicobacter,2011, 16(3): 434-443.
[21] Jung CH, Zhou S, Ding G X, et al.Antihyperglycemic activity of herb extracts on streptozotocin-induced diabetic rats[ J]. Biosci Biotechnol Biochem, 2006, 70(10) : 60231-60238.
[22] Jeong G S, Lee D S, Song M Y, et al.Butein from Rhus verniciflua protects pancreaticβ-cells against cytokine-induced toxicitymediated by inhibition of nitric oxide formation[ J] .Biol Pharm Bull, 2011, 34(1 ): 97-102.
[23] Oh P S, Lee S J, Lim K T.Hypolipidemic and antioxidative effects of the plantglycoprotein (36 kDa) from Rhus verniciflua Stokes fruit in Triton WR-1339-induced hyperlipidemic mice[J] .Biosci Biotechnol Biochem, 2006, 70(2): 447-456.
[24] Lee J, Lim K T.Plant-originated glycoprotein (36 kDa) suppresses interleukin-4 and-10 in bisphenol A-stimulated primary cultured mouse lymphocytes[ J] .Drug Chem Toxicol, 2010,33(4): 421-429.
[25] Liu C S, Nam TG, Han MW, etal.Protective effect of detoxified Rhus verniciflua Stokes on human keratinocytes and dermal fibroblasts against oxidative stress and identification of the bioactive phenolics[ J] .Biosci Biotechnol Biochem, 2013, 77(8): 1682-1688.
[26] Sapkota K, Kim S, Kim M K, et al.A detoxified extract of Rhus verniciflua Stokes upregulated the expression of BDNF and GDNF in the rat brain and the human dopaminergic cell line SH-SY5Y[ J] .Biosci Biotechnol Biochem, 2010, 74 ( 10 ):1997-2004.
[27] Cho N, Choi JH, Yang H, et al.Neuroprotective and antiinflammatory effects of flavonoids isolated from Rhus verniciflua in neuronal HT22 andmicroglial BV2 cell lines[ J] .Food Chem Toxicol, 2012, 50(6) : 1940-1945.
[28] Kim S, Park SE, Sapkota K, et al.Leaf extractof Rhus verniciflua Stokes protects dopaminergic neuronal cells in a rotenone model of Parkinson's disease[ J] .J Pharm Pharmacol,2011, 63(10): 1358-1367.
[29] Lee D S, LiB, Kim K S, et al.Butein protects human dental pulp cells from hydrogen peroxide-induced oxidative toxicity via Nrf2 pathway-dependent heme oxygenase-1 expressions[ J]. Toxicol In Vitro, 2013, 27(2) : 874-881.
[30] Kang SY, Kang JY, Oh M J.Antiviral activities of flavonoids isolated from the bark of Rhus verniciflua Stokes against fish pathogenic viruses in vitro[ J].J Microbiol, 2012, 50 ( 2 ):293-300.
[31] Song N J, Yoon H J, Kim K H, et al.Butein is a novel antiadipogenic compound [ J] .J Lipid Res, 2013, 54 ( 5 ):1385-1396.
[32] Choi S J, Lee M Y, Jo H, et al.Preparative isolation and purification of neuroprotective compounds from Rhus verniciflua by high speed counter-current chromatography[ J] .Biol Pharm Bull, 2012, 35(4): 559-567.
[33] Park D K, Lee Y G, Park H J.Extract of Rhus verniciflua bark suppresses 2,4-dinitrofluorobenzene-induced allergic contact dermatitis[ J] .Evid Based Complement Alternat Med,2013, 2013: 879696.
R285.5
: A
: 1001-1528(2014)03-0593-05
10.3969/j.issn.1001-1528.2014.03.032
2013-03-17
国家中医药管理局 “药用植物学” 重点学科课题 (国中医药发 [2009] 30 号); 湖南省高校科技创新团队资助项目 (湘教通 [2010] 212 号)
潘 宇 (1983—) , 男, 博士生, 研究方向: 中药资源与成分。 Tel: 13755044140, E-mail: panyu1226@126.com
*通信作者: 李顺祥 (1964—) , 博士, 教授, 研究员, 博士生导师, 研究方向: 中药有效成分与资源。 Tel:(0731)88458229, E-mail:lishunxiang@hotmail.com
