Pestalotiopsis adusta 次级代谢产物对 HeLa 细胞抑制作用
2014-04-11关永强曹蒙蒙宋小妹罗都强
关永强, 曹蒙蒙, 刘 亭, 宋小妹, 罗都强*
(1.河北大学生命科学学院,河北 保定 071002;2.河北大学药物化学与分子诊断教育部重点实验室,河北 保定 071002;)
[成分分析]
Pestalotiopsis adusta 次级代谢产物对 HeLa 细胞抑制作用
关永强1,2, 曹蒙蒙1,2, 刘 亭1,2, 宋小妹1,2, 罗都强1,2*
(1.河北大学生命科学学院,河北 保定 071002;2.河北大学药物化学与分子诊断教育部重点实验室,河北 保定 071002;)
目的 研究木榄枝内生真菌的次级代谢产物,探讨其抗肿瘤活性。方法 应用正相硅胶柱色谱、薄层色谱、羟丙基葡聚糖凝胶 Sephadex LH-20 和重结晶等方法等多种方法分离纯化, 用 NMR和 MS 等波谱技术解析化合物的结构, 采用MTT法筛选具有抑制肿瘤细胞生长活性的化合物。 结果 共分离鉴定出 12 个化合物, 分别为 5-甲氧基-4,6-二甲基-7-O-α-L-鼠李糖基-异苯并呋喃酮 (1) 、 7-羟基-5-甲氧基-4,6-二甲基-异苯并呋喃酮 (2)、 海绵尿苷 (3)、 1-(2-脱氧-D-呋喃核糖基) 胸腺嘧啶 (4)、 2-苯乙基-α-D-吡喃甘露糖苷 (5)、 2,3-二羟基苯乙醇 (6)、 4-羟基苯乙基乙酸酯 (7)、 4,3'-二羟基苯乙基丙酸酯 (8)、 N-(4-羟基苯乙基) 乙酰胺 (9)、 3-丙基-吲哚 (10)、 3β, 5α, 9α-三羟基-(22E,24R)-麦角甾-7,22-二烯-6 酮 (11) 、 (5S, 1'R)-4,5-二氢-5-(1'-羟基) 乙基-2-(3H)-呋喃酮 (12)。 结论 12 个化合物均为首次从该内生真菌中分离得到, 化合物 2、 7、 8、 11 对子宫颈癌细胞 (HeLa) 均有抑制作用。
木榄枝;内生真菌;次级代谢产物;抗肿瘤活性
木榄 Bruguiera gymnorhiza(L.)Lam.俗名大叶橙红树, 属于红树科木榄属 Bruguiera 植物。 木榄为常绿乔木,花、果期近全年,多有膝状呼吸根及支柱根, 单叶对生,具长柄, 革 质[1]。木榄分布十分广泛,主要分布于温热潮湿的澳大利亚北部、非洲大陆、东南亚等地地区的海岸线沿岸,在中国主要分布于广东、广西、海南、台湾等地。木榄的药用价值十分广泛,据民间记载木榄的根、茎、叶、果实等不同部位具有清热解毒、止血、收敛及止泻等多种药理功效[2]。 近些年来, 植物内生拟盘多毛孢属次级代谢产物的研究备受关注,研究人员发现了多种具有丰富生物学功能多样性和化学结构多样性的化合物,这些次级代谢产物具有丰富的生物活性, 如抗肿瘤、 抗菌、 抗 HIV等众多活性[3]。 实验所用木榄内生真菌 Pestalotiopsis adusta 属于拟盘多毛孢属 Pestalotiopsis, 本实验对寄生在木榄枝内 P.adusta 的次级代谢产物进行相关化学成分的研究, 从中分离鉴定出了12个已知化合物,并对其进行生物活性的研究,查阅相关文献,未见有这12个化合物从该内生真菌中分离得到的信息。
1 仪器与材料
柱色谱硅胶及薄板色谱硅胶 (GF 254,10 ~40 μm, 200 ~300 目, 烟台江友硅胶开发有限公司); Sephadex LH-20(25 ~100 μm, GE Healthcare Co., Ltd., Sweden) 。 Waters高效液相色谱仪(717 Plus, 600 Controller,2424ELS/2489UV/Visible Detecter), Bruker AVANCE III-600 核磁共振谱仪 (德国 BRUKER光谱仪器公司); ESI和 HRESI-MS:APEIIIFT-MS 质谱仪 (APEX-ulltra 7.0T) (德国 BRUKER光谱仪器公司)。
菌株 Pestalotiopsis adusta 采自海南省东寨港红树林保护区的木榄茎部, 子宫颈癌细胞 (HeLa)由河北大学药物化学与分子诊断教育部省部共建重点实验室提供。
2 培养及发酵
cPDA培养基:200 g马铃薯, 洗净去皮切碎,加水煮沸 30 min, 纱布过滤取滤液, 葡萄糖 20 g,MgSO41.5 g,KH2PO43 g, VB110 mg, 柠檬酸0.1 g加水混合至 1 000 mL,调 pH至 6.0 ~6.5。
将菌株 P.adusta 活化后接种于 cPDA液体培养基 (已经过 121 ℃高压蒸汽灭菌 15 min) 培养6 d,制备种子液。待种子液长成后, 将其按 10%的接种量接种于大米固体培养基 (500 mL三角瓶,每瓶加入 80 g大米, 100 m L水, 共接种 80 瓶于28 ℃下恒温培养38 d)。
3 提取与分离
发酵产物用乙酸乙酯萃取7次,减压浓缩,获得粗提物70 g, 将浸膏进行硅胶柱色谱分离, 以石油醚-乙酸乙酯 (19 ∶1,9 ∶1, 6 ∶1, 3 ∶1, 1 ∶1,1 ∶3) 梯度洗脱, TLC检识合并相同组分, 得到A1 ~A6 六个部分。A1、 A2 部分经硅胶柱色谱,以石油醚-乙酸乙酯梯度洗脱, 其中 6 ∶1 部分及3 ∶1 部 分 经 Sephadex LH-20 [ 三 氯 甲 烷-甲 醇(1 ∶1), 纯甲醇] 凝胶色谱分离得到化合物5(10 mg) 与化合物 6(8 mg)。 A3 部分经硅胶柱色谱,以石油醚-乙酸乙酯梯度洗脱, 其中 3 ∶1 部分经Sephadex LH-20(甲醇), 制备型薄层色谱分离得到化合物 7(9 mg)、 8(14 mg)、 9(7 mg)。 A4部分经硅胶柱色谱, 以石油醚-乙酸乙酯梯度洗脱,其中 1 ∶1 部分经过 Sephadex LH-20 [ 三氯甲烷-甲醇 (1 ∶1),纯甲醇] 分离得到化合物 4(18mg)、化合物 10(23 mg), 重结晶纯化得到化合物 11 (26 mg)。 A5、A6 部分经硅胶柱色谱, 以石油醚-乙酸乙酯梯度洗脱, 其中分别以1 ∶1 及1 ∶3 部分经 Sephadex LH-20 [三氯甲烷 ∶甲醇 (1 ∶1), 纯甲醇]、 TLC制备型薄层色谱及 HPLC硅胶柱色谱分离得到化合物 1(29 mg)、 2(22 mg)、 3(18 mg) 及 12(14 mg)。
4 结构鉴定
化合 物 1 : 分 子 式 C17H22O8, 黄 色 油 状 物 ,=-64(c=0.25, MeOH); HR-ESI-MS (m/z):377.121 5 [M+Na+]。1H-NMR(CD3OD,600 MHz) δ:5.51(1H, d, J=1.2 Hz,H-1'),5.21(2H, s, H-2), 4.49(1H, dd, J=3.3,1.2 Hz, H-2'), 4.00(1H, m, H-5'), 3.91 (1H, dd,J=9.5, 3.3 Hz, H-3'), 3.79(3H,s, 5-OCH3), 3.52(1H, dd, J=9.5, 9.5 Hz,H-4') , 2.26(3H, s, 6-CH3), 2.19(3H, s, 4-CH3), 1 .25(3H, d , J =6.2 Hz, H -6')。13C-NMR(CD3OD, 150 MHz) δ:169.8(s, C-1), 163.0(s, C-7), 153.5(s, C -5), 147.1 (s, C-3), 125.2(s, C-6), 120.7(s, C-4),111.7(s, C-8), 105.0(d, C-1'), 72.1(d,C-5'), 71.0(d, C-4'), 70.7(d, C-3') , 70.6 (d,C-2'), 68.4(t, C-2),59.5(q, 5-OCH3),16.6(q, C-6') , 10.0(q, 4-CH3), 9.2(q, 6-CH3)。 由以上数据分析, 并结合文献 [ 4] 报道,确定该化合物为 5-甲氧基-4,6-二甲基-7-O-α-L-鼠李糖基-异苯并呋喃酮 (5-methoxy-4,6-dimethyl-7-O-α-L-rhamnosyl-phthalide)。
化 合 物 2: 分 子 式 C11H12O4, 无 色 晶 体,1H-NMR(CD3OD, 600MHz) δ:7.69(1H, s, 7-OH), 5.21(2H, s, H-2), 3.78(3H, s, 5-OCH3), 2.21(3H, s, 6-CH3),2.16(3H, s,4-CH3)。13C-NMR(CD3OD, 150 MHz) δ:173.0(s,C-1), 163.8(s, C-7), 153.8(s, C-5), 143.4 (s, C-3), 118.5(s, C-6), 116.5(s, C-4),106.1(s, C-8), 70.8(t, C-2),60.3(q,5-OCH3), 11.4(q, 4-CH3), 8.5(q, 6-CH3)。 由以上数据分析, 并结合文献 [4] 报道, 确定该化合物 7-羟基-5-甲氧基-4, 6-二甲基-异苯并呋喃酮 (7-hydroxy-5-methoxy-4,6-imethyl-iso benzofuranone)。
化 合 物 3: 分 子 式 C9H12N2O6,白 色 固 体,1H-NMR(CD3OD,600 MHz) δ:11.2(1H, br.s,1-NH), 8.01(1H,d,J=8.1 Hz, H-4), 5.91 (1H, d, J=4.7 Hz, H-1'), 5.72(1H, d, J= 8.1 Hz, H-5) , 4.19(1H, dt, J=21.3, 5.0 Hz,H-3',4'),4.03(1H, d, J=3.9 Hz, H-2'),3.86(1H, dd, J=12.2, 2.2 Hz, H-5'a), 3.75 (1H, dd, J=12.2,2.9 Hz,H-5'b)。13C-NMR (CD3OD, 150 MHz) δ:164.8(s, C-6), 151.1 (s, C-2), 141.3(d, C-4), 101.3(d, C-5),89.4(d, C-1'), 85.0(d, C-4'), 74.3(d, C-2'), 69.9(d, C-3'), 61.0(t, C-5')。 由以上数据分析, 并结合文献 [5]报道,确定该化合物为海绵尿苷 (spongouridine) 。
化合 物 4: 分 子 式 C10H14N2O5, 白 色 固 体,1H-NMR(CD3OD, 600 MHz) δ:7.83(1H, d,J=0.9 Hz, H-4), 6.30(1H, t, J=6.8 Hz,H-1'), 5.01(1H, t, J=5.2 Hz, 5'-OH), 4.56 (1H, m, H-4') , 4.42(1H, m, H-3'), 3.82 (1H, dd, J=12.0, 3.0Hz, H-5'a), 3.75(1H,dd, J=12.0, 3.0 Hz, H-5'b), 2.32-2.21(2H,m, H-2'), 1.90(3H, s, 5-CH3)。13C-NMR (CD3OD, 150 MHz) δ:165.0(s, C-6), 151.0 (s, C-2), 136.8(d, C-4), 110.2(s, C-5),87.4(d, C-1'), 84.9(d, C-4'), 70.8(d, C-3'), 61.4(t, C-5'), 39.8(t, C-2'), 11.2(q,5-CH3)。由以上数据分析,并结合文献 [6]报道, 确定该化 合 物 为 1-(2-脱氧-D-呋喃核糖 基)胸腺嘧啶 [1-(2-deoxy-d-ribofuranosyl)thymine] 。
化合 物 5: 分 子 式 C14H20O6, 黄 褐 色 固 体,[ α]D=+63.7(c=1.13, MeOH); ESI-MS (m/z):307.1 [M+Na]+。1H-NMR(CD3OD, 600 MHz) δ:7.19-7.31(m,5H,H-2', 3', 4',5',6'), 3.93(m, 1H, H-2), 3.75-3.65(m,2H,H-8), 3.65-3.60(m, 2H, H-7), 3.47-3.33(m,2H, H-5,6), 3.33-3.23(m, 2H, H-3, 4),2.96(2H, t, J=7.1 Hz, H-9);13C-NMR (CD3OD, 150 MHz) δ:138.9(s, C-1'), 128.6 (d, C-3'), 128.6(d, C-5'), 128.0(d, C-2'),128.0(d, C-6'), 125.8(d, C-4'),98.7(d, C-2), 73.7(d, C-6), 72.2(d, C-4), 72.1(d,C-3), 70.3(t, C-8), 68.7(t, C-5) , 61.1(t,C-7), 35.4(t, C-9)。 由以上数据分析,并结合文献[7] 报道, 确定该化合物为 2-苯乙基-α-D-吡喃甘露糖苷 (2-Phenylethyl-α-D-mannopyranoside)。
化合 物 6: 分 子 式 C8H10O3, 无 色 油 状 物,1H-NMR(CD3OD, 600 MHz) δ:6.68(1H, dd,J=7.96, 7.98 Hz, H-5), 6.66(1H, dd, J= 1.53, 7.98 Hz, H-6), 6.55(1H, dd, J=1.53,7.96 Hz,H-4), 3.69(2H,t,J=7.3Hz, H-8),2.68(2H, t, J=7.2 Hz, H-7)。13C-NMR (CD3OD, 150 MHz) δ:145.9(s, C-2), 142.5 (s, C-3), 127.1(s, C-1), 121.8(d, C-6),120.9(d, C-5),113.6(d, C-4), 65.3(t, C-8), 34.1(t, C-7) 。 由以上数据分析, 并结合文献[8] 报道, 确定该化合物为 2,3-二羟基苯乙醇(2,3-dihydroxy phenyl-ethanol)。
化 合 物 7: 分 子 式 C10H12O3, 白 色 固 体,1H-NMR(CD3OD,600MHz) δ:7.04(2H, d,J=8.4 Hz, H-2, 6) , 6.74(2H, d, J=9 Hz,H-3, 5), 4.21(2H, t, J=7.2 Hz,H-8), 2.83 (2H, t, J=7.2 Hz, H-7), 2.01(3H, s, H-10)。13C-NMR(CD3OD, 150 MHz) δ:171.5(s,C-9), 155.7(s, C-4), 129.9(d, C-2, 6),129.5(s, C-1), 114.9(d, C-3, 5), 65.2(t,C-8), 33.8(t, C-7), 19.4(q, C-10)。由以上数据分析, 并结合文献 [9] 报道, 确定该化合物为 4-羟基苯乙基乙酸酯 (4-hydroxy phenethyl acetate)。
化合 物 8: 分 子 式 C11H14O4, 黄 白 色 固 体,1H-NMR(CD3OD, 600 MHz) δ:7.06(2H, d,J=8.4 Hz, H-2, 6), 6.73(2H, d, J=8.40 Hz,H-3, 5),4.69(2H, t, J=5.85 Hz, H-8),4.27(2H, t, J=7.05 Hz, H-3'), 2.97(2H, t,J=5.85 Hz, H-7), 2.85(2H, t, J=7.05 Hz,H-2') 。13C-NMR(CD3OD, 150 MHz) δ:170.3 (s, C-1'), 155.7(s, C-4), 129.5(d, C-2,6),128.4(s, C-1), 114.9(d,C-3,5), 69.4 (t, C-8), 65.8(t, C-3'), 33.7(t, C-2'),30.5(t, C-7)。由 以 上 数 据 分 析,并 结 合 文 献[10] 报道, 确定该化合物为 4,3'-二羟基苯乙基丙酸酯 (4 ,3'-dihydroxy phenethyl propionate) 。
化合物 9: 分子式 C10H13NO2, 白色固体, ESIMS(m/z):202.084 1 [ M+Na]+;1H-NMR (CD3OD, 600 MHz) δ:7.05(2H, d,J=8.2 Hz,H-2, 6), 6.67(2H, d, J=8.3 Hz, H-3, 5), 3.31 (2H, t, J=6.0 Hz, H-8), 2.70(2H, t, J=6.0 Hz, H-7), 1.92(3H, s, H-11)。13C-NMR (CD3OD, 150MHz) δ:171.8(s, C-10), 155.5(s,C-1), 130.8(s, C-4),129.3(d, C-2,6), 114.8 (d, C-3, 5), 41.0(t, C-8), 34.2(t, C-7),21.1(q, C-11)。 由以上数据分析,并结合文献[11] 报道, 确定该化合物为 N-(4-羟基苯乙基)乙酰胺 [N-(4-hydroxyphenethyl)acetamide]。
化合物 10: 分 子 式 C11H13N, 黄 色 油 状 物,1H-NMR(CD3OD, 600 MHz) δ:8.06(1H, d,J=7.6 Hz, H-5), 7.91(1H, s, H-2), 7.45 (1H, d, J=7.8 Hz, H-8), 7.29 ~7.16(2H,m, H-6, 7) , 2.13(2H, t, J=7.2 Hz, H-10),1.33(2H, m, H-11), 0.92(3H,t, J=7.0 Hz, H-12)。13C-NMR(CD3OD, 150 MHz) δ: 136.8(s, C-9), 131.9(d, C-2), 126.2(s,C-4), 122.2(d, C-7), 121.0(d, C-6) , 120.6 (d,C-5), 111.5(d,C-8), 107.4(s,C-3),31.7(t, C-10), 29.3(t, C-11), 13.0(q, C-12)。 由以上数据分析, 并结合文献 [12] 报道,确定该化合物为 3-丙基-吲哚 (3-propyl-indole)。
化合物 11: 分子式 C28H44O4, 无色晶体; mp 218 ~219 ℃;[ α]20D=-29(c=0.50, CHCl3)。1H-NMR(CD3OD, 600 MHz) δ:5.65(1H,s, H-7), 5.24(1H, dd, J=15.3, 6.9 Hz,H-23),5.16(1H, dd, J=15.3, 6.6 Hz,H-22), 4.04 (1H, m, H-3), 1.02(3H, d, J=6.6 Hz, H-21), 0.98(3H,s, H-19), 0.92(3H,d, J=6.9 Hz, H-28), 0.84(3H, d, J=6.6 Hz, H-27),0.82(3H, d, J=6.6 Hz, H-26), 0.61(3H, s,H-18)。13C-NMR(CDCl3, 150 MHz) δ:198.4(s, C-6), 165.0(s, C-8), 135.1(d, C-22), 132.5 (d, C-23), 119.7(d, C-7), 79.5(s, C-5),74.7(s, C-9), 67.4(d, C-3), 56.0(d, C-17),51.9(d,C-14), 45.5(s, C-13), 42.8(d,C-24),41.9(s, C-10), 40.3(d,C-20),36.8(t,C-4), 34.9(t, C-12), 33.1(d, C-25), 29.9 (t, C-2), 29.7(t, C-11),27.9(t, C-16), 25.5 (t, C-1), 22.4(t, C-15), 21.1(q, C-21), 20.3 (q, C-19), 20.0(q, C-26), 19.6(q, C-27),17.6(q, C-28), 12.3(q, C-18)。 由以上数据分析, 并结合文献 [13] 报道, 确定该化合物为 3β,5α,9α-三羟基-(22E,24R)-麦角甾-7,22-二烯-6 酮[3β, 5α, 9α-Trihydroxy-(22E, 24R)-ergosta-7,22-dien-6-one]。
化合 物 12: 分 子 式 C6H10O3,无 色 油 状 物,[ α]20D=+9.3(c=3.7, CHCl3);1H-NMR (CD3OD, 600 MHz) δ:4.39-4.45(1 H, m, H-1'), 3.73-3.79(1 H, m,H-5),2.55-2.60(2 H, m, H-3a,b), 2.05-2.37(2H, m, H-4a,b),1.23(3H,d,J=6.5 Hz,H-2')。13C-NMR (CD3OD, 150 MHz) δ:178.9(s, C-2), 84.5(d,C-5), 68.7(d, C-1'), 28.1(t, C-3) , 23.6(t,C-4), 17.6(q, C-2')。 由以上数据分析, 并结合文献 [14] 报道,确定该化合物为 (5S, 1'R)-4,5-二氢-5-(1'-羟基) 乙基-2-(3H)-呋喃酮[ (5S, 1'R)-4,5-dihydro-5-(l'-hydroxy)ethyl-2-(3H)-furanone]。
5 活性筛选
采用 MTT法[15], 对 1 ~12 号化合物进行了抗肿瘤活性鉴定, 测试结果如下表1。
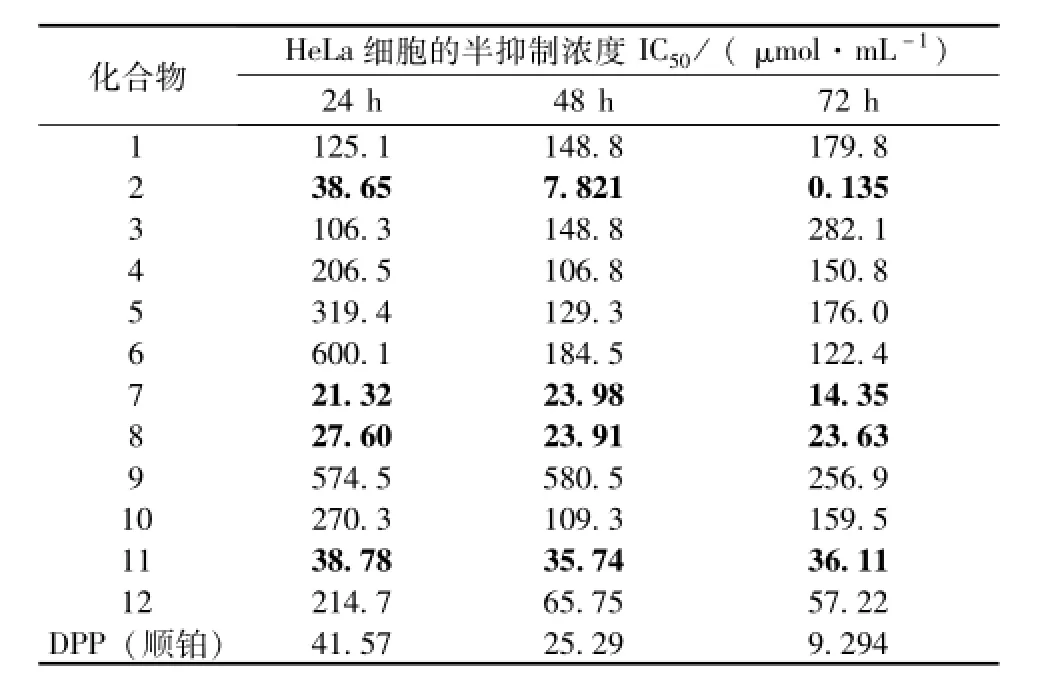
表 1 化合物 1 ~12 对体外肿瘤细胞 (HeLa) 抑制活性筛选结果Tab.1 Inhibitory activities of com pounds 1-12 against He-La cancer cells in vitro
通过筛选发现化合物 2、 7、 8、 11 对子宫颈癌细胞 (HeLa) 均有抑制作用, 其中化合物 2、 7、 8对 HeLa肿瘤细胞 48 h 的半抑制浓度值 (IC50) 均低于阳性对照物顺铂,其中化合物2尤为突出。除2、 7、 8、 11 外其他化合物 48 h 的半抑制浓度值(IC50) 均大于 50 μmol/mL, 可能对 HeLa肿瘤细胞没有抑制作用。
[ 1 ] 尚随胜, 龙胜京.红树植物木榄的活性成分研究概况[J].中草药, 2005, 36(3):465-467.
[ 2 ] 墨竹乘.红树植物的药用和食用[J].海洋信息, 1998 (8):12-13.
[ 3 ] 易晓华.植物内生真菌次生代谢产物研究进展[J].中国农学通报, 2009, 25(21):255-260.
[ 4 ] Xing JG, Deng H Y, Luo D Q.Two new compounds from an endophytic fungus Pestalotiopsis heterocornis[ J] .J Asian Nat Prod Res, 2011, 13(12):1069-1073.
[ 5 ] Huang R, Zhou X, Peng Y, etal.Nucleosides from themarine sponge Callyspongia SP[ J] .Chem NatCompd, 2011, 46 (6):1010-1011.
[ 6 ] Yan H J, Gao SS, Li CS, et al.Chemicial consitituents ofa marine-derived endophytic fungus Penicillium commune G2M[ J] .Molecules, 2010 , 15(5):3270-3275.
[ 7 ] Klein T, Abgottspon D, Wittwer M, et al.FimH antagonists for the oral treatmentof urinary tract infections:from design and synthesis to in vitro and in vivo Evalution [ J] .J Med Chem,2010, 53(24):8627-8641.
[ 8 ] Tian J, Sun H D.Chemical constituents of Clerodendrum indicum[ J].Nat Prod Res Dev, 1998, 11(3):1-5.
[ 9 ] Wu H H, Tian L, Chen G, et al.Six compounds from marine fugus Y26-02 [ J] .J Asian Nat Prod Res, 2009, 11(8): 748-751.
[10 ] Nishida T, Yoshinaga H, Toyoda T, et al.First and secondgeneration practical syntheses of chroman-4-one derivative:A key intermediate for the preparation of SERT/5-HT1Adual inhibitors[ J] .Org Process Res Dev, 2012, 16(4):625-634.
[11] Gutierrez M, Capson T L, et al.Antiplasmodialmetabolites I-solated from the marine octocoral Muricea autera [ J] .J Nat prod, 2006, 69(10):1379-1383.
[12] Watanabe Y, Yamamoto M, Shim SC, et al.The transition metal-catalyzed N-heterocyclization.The rhodium-catalyzed Synthesis of Indoles[J] .Chem Lett, 1980(5):603-605.
[13] Xiong H Y, Fei D Q, Zhou J S, et al.Steroids and other constituents from the mushroom Armillaria lueo-virens[ J]. Chem Nat, 2009, 45(5):759-761.
[14 ] Hedeis C, Schiffer T.Synthesis of nonracemic 2, 3, 6-trisubstitude piperidine derivative from Lactons bia tandom witting{2+3 } cycloaddition reacion.A novel entry to prosopis and cassia alkaloids [ J] .Tetrahedron, 1999, 55(4): 1043-1056.
[15 ] Huang H L, Wang C M, Wang Z H, et al.Tirucallane-type triterpenoids from Dysoxylum lenticellatum [ J] .J Nat Prod,2011, 74(10):2235-2242.
Effect of secondary m etabolites of endophytic fungus Pestalotiopsis adusta on HeLa cells
GUAN Yong-qiang1,2, CAOMeng-meng1,2, LIU Ting1,2, SONG Xiao-mei1,2, LUO Du-qiang1,2*
(1.Colloge of Life Science, HebeiUniversity, Baoding 071002, China; 2.Key Laboratory ofMedicinal Chemistry and Molecular Diagnosisof HebeiUniversity, Baoding 071002, China)
AIM To research the secondarymetabolites ofendophytic fungus Pestalotiopsisadusta isolated from the stem of Bruguiera gymnorhiza and their inhibitory effectagainst human cancer cells.M ETHODS Compounds were isolated and purified by column chromatography on Silica gel, Sephadex LH-20, Silica gel thin layer chromatography and recrystallization.Compounds structurewere analysed by NMR and MSspectroscopty and the inhibitory activities against HeLa cellswere evaluated by MTTmethod.RESULTS Twelve compoundswere isolated and purified as:5-methoxy-4,6-dimethyl-7-O-L-rhamnosyl-phthalide(1),7-hydroxy-5-methoxy-4,6-dimethyl-isobenzofuranone(2) , spongouridine(3) , 1-(2-deoxy-D-ribofuranosyl)thymine(4) , 2-phenylethyl-α-D-mannopyranoside(5), 2,3-dihydroxy phenyl-ethanol(6), 4-hydroxy phenethyl acetate(7), 4,3'-dihydroxy phenethyl propionate(8) , N-(4-hydroxyphenethyl)acetamide(9) , 3-propyl-indole(10) , 3β,5α, 9α-trihydroxy-(22E, 24R)-ergosta-7,22-dien-6-one(11), (5S,1'R)-4,5-dihydro-5-(l'-hydroxy)ethyl-2-(3H)-furanone(12).CONCLUSION These compounds are isolated from endophytic fungus Pestalotiopsis adusta for the first time, compounds 2, 7, 8, and 11 can inhibit HeLa cells.
Bruguiera gymnorhiza; endophytic fungus; secondarymetabolites; anti-tumor activity
R284.1
:A
:1001-1528(2014)02-0325-05
10.3969/j.issn.1001-1528.2014.02.024
2013-06-25
国家自然科学基金 (31171885); 教育部博士点基金 (20121301110006)
关永强 (1989—) , 男, 硕士生, 主要从事天然药物化学研究。 Tel:13472275608, E-mail:gyq8925@126.com
*通信作者: 罗 都 强 (1965—) , 男, 教 授, 主 要 从 事 天 然 产 物 化 学 及 农 药 活 性 研 究。 Tel:(0312)5929898, E-mail:duqiangluo @163.com
