UHPLC-MS/MS同时测定大鼠血浆中 6 种木脂素类成分及其药代动力学研究
2014-04-11宋小妹张伟东王鹏远王晓娟
王 青, 王 莹, 宋小妹, 张伟东, 王鹏远, 顾 宜, 王晓娟*
(1.陕西国际商贸学院, 陕西 咸阳 712046; 2.第四军医大学口腔医院药剂科, 陕西 西安 710032;3.陕西中医学院药学院, 陕西 咸阳 712046)
[制 剂]
UHPLC-MS/MS同时测定大鼠血浆中 6 种木脂素类成分及其药代动力学研究
王 青1, 王 莹2, 宋小妹3, 张伟东2, 王鹏远2, 顾 宜2, 王晓娟2*
(1.陕西国际商贸学院, 陕西 咸阳 712046; 2.第四军医大学口腔医院药剂科, 陕西 西安 710032;3.陕西中医学院药学院, 陕西 咸阳 712046)
目的 建立 利 用 UHPLC-MS/MS 法 同 时 测定 大 鼠 血 浆中 Gomisin D、 Gomisin E、 五味 子 醇 甲、 五 味 子 甲 素、Gomisin R和五味子乙素 6 种木脂素的分析方法, 并研究大鼠灌胃给予五味子提取物后的药代动力学特征。 方法 采用 Agilent Poroshell120 EC-C18色谱柱, 流动相为乙腈-0.1%甲酸水溶液梯度洗脱, 采用电喷雾电离源 (ESI) , 扫描方式为多反应离子监测 (MRM)。 结果 大鼠血浆中6 种木脂素成分的校正曲线线性关系良好, 日内、 日间精密度和准确度符合要求, 提取回收率 75.76% ~88.82%。 结论 该方法简便、 快速、 灵敏、 稳定, 适用于五味子提取物的体内分析,为其进一步研究奠定基础。
UHPLC-MS/MS; 大鼠血浆; 五味子; 木脂素; 药代动力学
五味子是木兰科植物五味子 Schisandra chinensis(Turcz.)Bail1.的干燥成熟果实。习称 “ 北五味子”。其味酸、甘,性温。 有收敛固涩,益气生津,补肾宁心的功能,用于久嗽虚喘,梦遗滑精,遗尿尿频,久泻不止,自汗盗汗,津伤口渴,短气脉虚, 内热消渴, 心悸失眠等症[1]。 五味子中含有多糖、 挥发油和木脂素 类成分[2-3], 其中 木脂素类成分与五味子的抗肝脏损伤、抗氧化作用明显相关[4]。五味 子 中木脂素类 成 分在体内代 谢 研 究,国内外文献已有报道,主要为五味子中单一成分血药浓度测定[5-8]或 分别与 黄芩、 丹参配伍后 对其成分在大鼠体内的药代动力学影响[9-10]。 本实验 采用UHPLC-MS/MS 法同时测定五味子提取物中 6 种木脂素类成分的血药浓度,研究大鼠给予五味子提取物后的药代动力学特征,为五味子在临床上的合理应用提供理论依据[11]。
1 试药与仪器
1.1 试药 Gomisin D、Gomisin E、五味子醇甲、五味子甲素、 Gomisin R、 五味子乙素 ( 中国科学院昆明植物研究所); 尼莫地平 (Nimodipine, 批号 100270—200002, 中国食品药品检定研究院);乙腈、 甲醇 (色谱纯, 美国 Fisher公司); 水为实验室自制三蒸水;其它试剂均为分析纯。五味子提取物粉末购自西安昊轩生物制品有限公司,其中Gomisin D、 Gomisin E、 五味子醇甲、 五味子甲素、Gomisin R、 五 味 子 乙 素 含 有 量 分 别 为 0.222、0.008、 9.311、 0.816、 1.466、 2.040 mg/g。
1.2 仪器 1290—6460 型三重四极杆串联质谱仪(美国 Agilent technology公司), 配有电喷雾离子源(ESI) 及 MassHunter VersionB.04.10 工 作 软 件;Agilent1290 Infinity超 高 效 液 相 色 谱 系 统, 配 有G4220A二元泵、 G1314E VWD检 测 器、G1316C柱温箱及 G4226A自动进样器。
1.3 动 物 Sprague-Dawley大 鼠, 雄性, 体质量(300 ±20)g, 第四军医大学实验动物中心提供,动物许可证号 SCXK(军 2011025)。
2 方法与结果
2.1 色谱条件 色谱柱:Agilent Poroshell 120 ECC18(2.7 μm, 2.1 mm×100 mm), 流动相为乙腈-0.1% 甲 酸 水 溶 液 梯 度 洗 脱, 体 积 流 量 0.4 mL/min,柱温 35 ℃, 进样量 1 μL。 梯度洗脱条件见表1。

表1 流动相洗脱梯度Tab.1 Mobile phase gradients
2.2 质谱条件 采用电喷雾电离源 (ESI); 扫描方式为多反应监测模式 (MRM) ; 喷雾气压 45 psi,雾化器温度 350 ℃; 毛细管电压正离子 4 kV, 负离子 3.5 kV;气流流量 10 L/min。扫描时间为23min。用于定量分析的离子反应及质谱参数见表2。
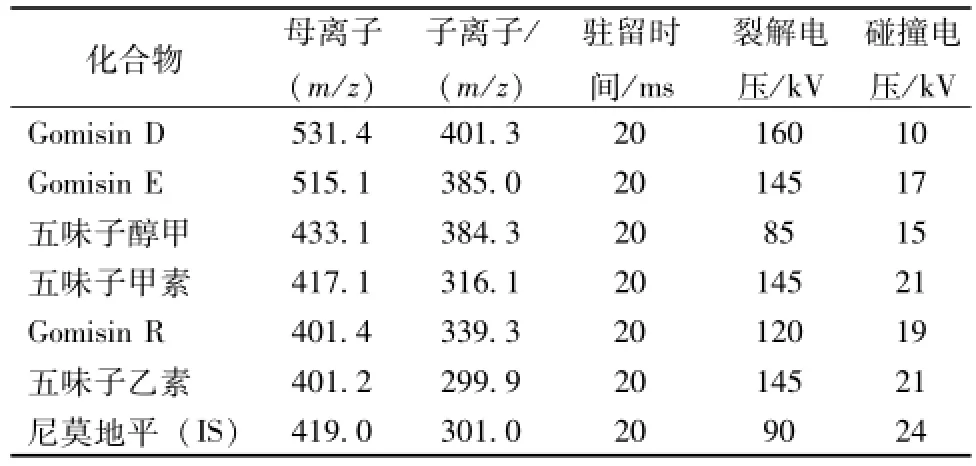
表2 定量离子及质谱参数Tab.2 Quantitative ionand M ass spectrum parameters
2.3 溶液的配制
2.3.1 对照品溶液的配制 精密称取 Gomisin D、Gomisin E、 五味子醇甲、 五味子甲素、 五味子乙素对照品 19.5、 0.785、 27.8、 3.09、 2.06 mg, 加甲醇溶解, 并定容至10mL量瓶中, 即为对照品贮备液①; 再分别取 对 照品贮备液 ①1mL及 Gomisin R对照品1.955mg,加甲醇溶解定容至50mL量瓶中,即为对照品贮备液②。
精密移取对照品贮备液②1 mL至 10 mL量瓶中, 甲醇定容至刻度, 制成含量分别为 Gomisin D 3 900 ng/mL、 Gomisin E 157 ng/mL、 五味子醇甲5 560 ng/mL、 五味子甲素 618 ng/mL、五味子乙素412 ng/mL、 Gomisin R 39100 ng/mL的混合对照品溶液,摇匀,4℃保存备用。
2.3.2 内标溶液的配制 精密称取尼莫地平对照品适量, 用甲醇溶解定容至10 mL量瓶中, 作为内标贮备液。精密量取内标贮备液适量,用甲醇配成2.176 μg/mL的内标溶液,4 ℃保存备用。
2.3.3 五味子提取溶液配制 准确称取五味子提取物粉末 1.5 g,用生理盐水 20 mL溶解混匀, 配成 0.075 g/m L的五味子提取物溶液。
2.4 给药方案与样品采集 健康雄性 SD大鼠 5只, 给药前禁食12 h, 灌胃给予五味子提取物溶液2.0 mL/只 (相当于五味子提取物粉末 0.5 g/kg)。给药后于 0、 5、10、 15、30 min 和 1、2、 3、 4、6、 8、12、 24 h 自眼底静脉取血 0.5 mL置肝素化的 EP管中, 3 000 r/min 离心 10 min, 转移上层血浆贮存于 -20 ℃。
2.5 样品处理 精密吸取大鼠空白血浆 100 μL血浆中, 加入 10 μL尼莫地平涡旋混合 1 min, 加入100 μL甲醇涡旋混合 0.5 min, 再加入 300 μL乙腈涡旋混合 0.5 min, 12 000 r/min 离 心 10 min,取上清液 400 μL 45 ℃氮气吹干,100 μL甲醇复溶, 高速离心后1μL进样测定。
2.6 数据处理 应用 DAS 2.0 药代动力学软件求出药代动力学参数。
2.7 测定方法的建立
2.7.1 方法的专属性 空白血浆、 空白血浆加分析物标准品及给药后的血浆样品色谱图见图1。 结果显示,空白血浆在与对照品对应的保留时间处没有色谱峰,血浆内源性物质、代谢产物及其他成分均不干扰6个目标成分的检出。
2.7.2 标准曲线及检测灵敏度 精密吸取混合对照 品 溶 液0.125、 0.625、 1.25、 2.5、 5.0、10.0 mL, 分别置于 10 mL量瓶中, 加甲醇至刻度, 制得混合对照品系列液。取 100 μL空白血浆依次加入 10 μL内标液和 10 μL的混合对照品系列液, 涡旋混合 1 min, 按 “2.5” 项下处理, 1 μL进样测定。以目标物和内标物的峰面积比Y对目标物浓度 X用加权最小二乘法进行回归运算[12-13]。结果见表 3。 6 个成分的定量限 (LOQ) 分别为4.88、 0.21、 6.95、 0.77、 48.88、 0.52 ng/m L。
2.7.3 准确度与精密度 用空白血浆配制低、中、高3个质量浓度的质控样品各5份,测得峰面积后带入随行标准曲线计算相应的药物浓度,与理论值相比,计算方法的准确度;同一质量浓度每隔2 h测定1次,平行测定3次,计算日内精密度;每隔1 d测定 1次, 平行测定3次,计算日间精密度。结果见表 4。 日内精密度 RSD值小于 10%, 准确度在 89.71% ~98.82%之间, 日间精密度 RSD值小于 12%, 准确度在 90.58% ~98.74%之间, 均符合有关规范要求[14-15]。
2.7.4 提取回收率 用空白血浆配制低、 中、 高 3个质量浓度的质控样品各5份,按样品处理项下的方法进行处理。测得峰面积后与同浓度对照品溶液直接进样所得峰面积进行比较,计算提取回收率。结果见表5。 结果显示高中低质控样品的提取回收率在 75.76% ~88.82%之间, RSD均小于 13%。
2.7.5 样品稳定性实验 配制低、中、高 3 个质量浓度的质控样品各5 份, 贮存于 -20 ℃冰箱中,反复冻融3 次, 每次间隔24 h, 按样品处理项下的方法进行处理后进样测定,测得实际值均在理论值的 85.31% ~97.93%范围波动,RSD<14%, 表明样品可以耐受3次冻融。低、中、高质量浓度质控样品室温放置 24 h, 在 -20 ℃冰箱中放置 30 d,测 得 实 际 值 在 理 论 值 的 85.07% ~96.65%,RSD<12%; 样品经处理后在自动进样器中放置24 h 后, 测 定 实 际 值 在 理 论 值 的 85.05% ~96.01%, RSD<13%, 均符合相关规定, 表明该 6种成分在血浆样品中稳定性良好。

图 1 空白血浆色谱图 (A), 加有混合对照品 ( Gom isin D、 Gom isin E、 五味子醇甲、 五 味 子 甲素、 Gom isin R、 五 味子乙素) 和 内 标的空白血 浆 色 谱图(B), 大鼠灌胃给药 0.5 h后的血浆色谱图 (C)Fig.1 Typical chromatograms of blank plasma (A), spiked p lasma w ith reference subtances(Gom isin D, Gom isin、 schizandrol A、 schizandrin A、 Gom isin R、 and schizandrin B and the IS( B) and plasma from rats at 0.5 h after administration(C)
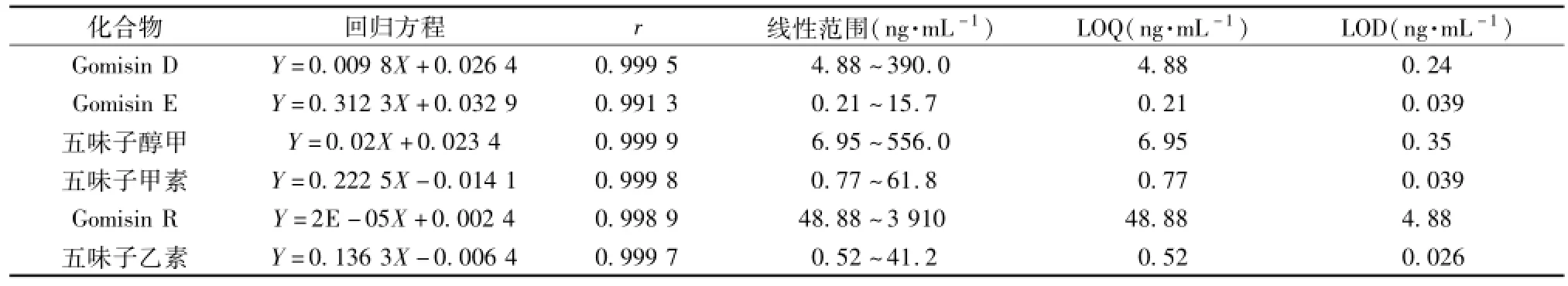
表3 标准曲线及线性范围Tab.3 Calibration curves and dynam ic range
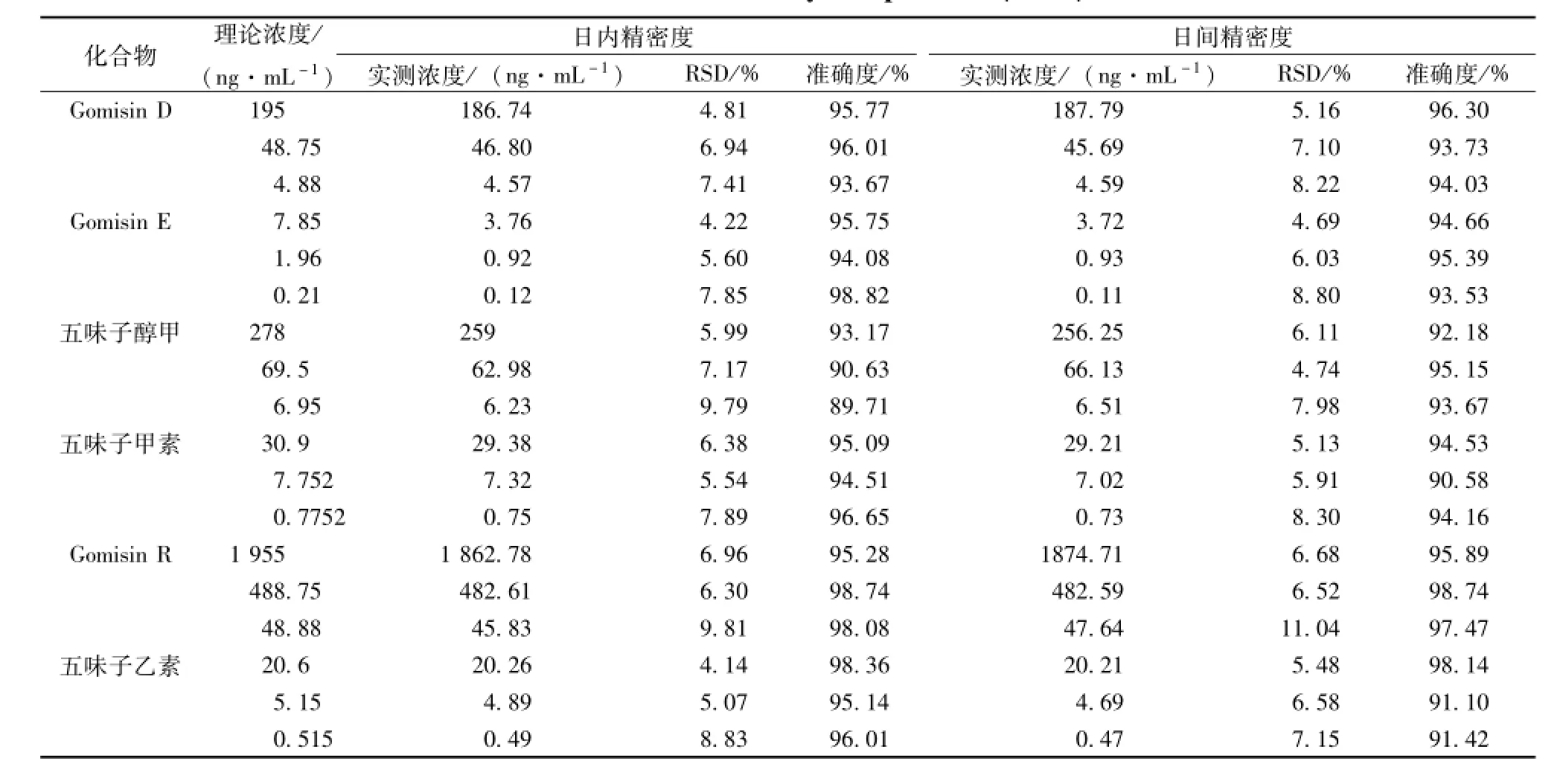
表 4 准确度与精密度实验结果 (n=5)Tab.4 Results of accuracy and precision( n=5)
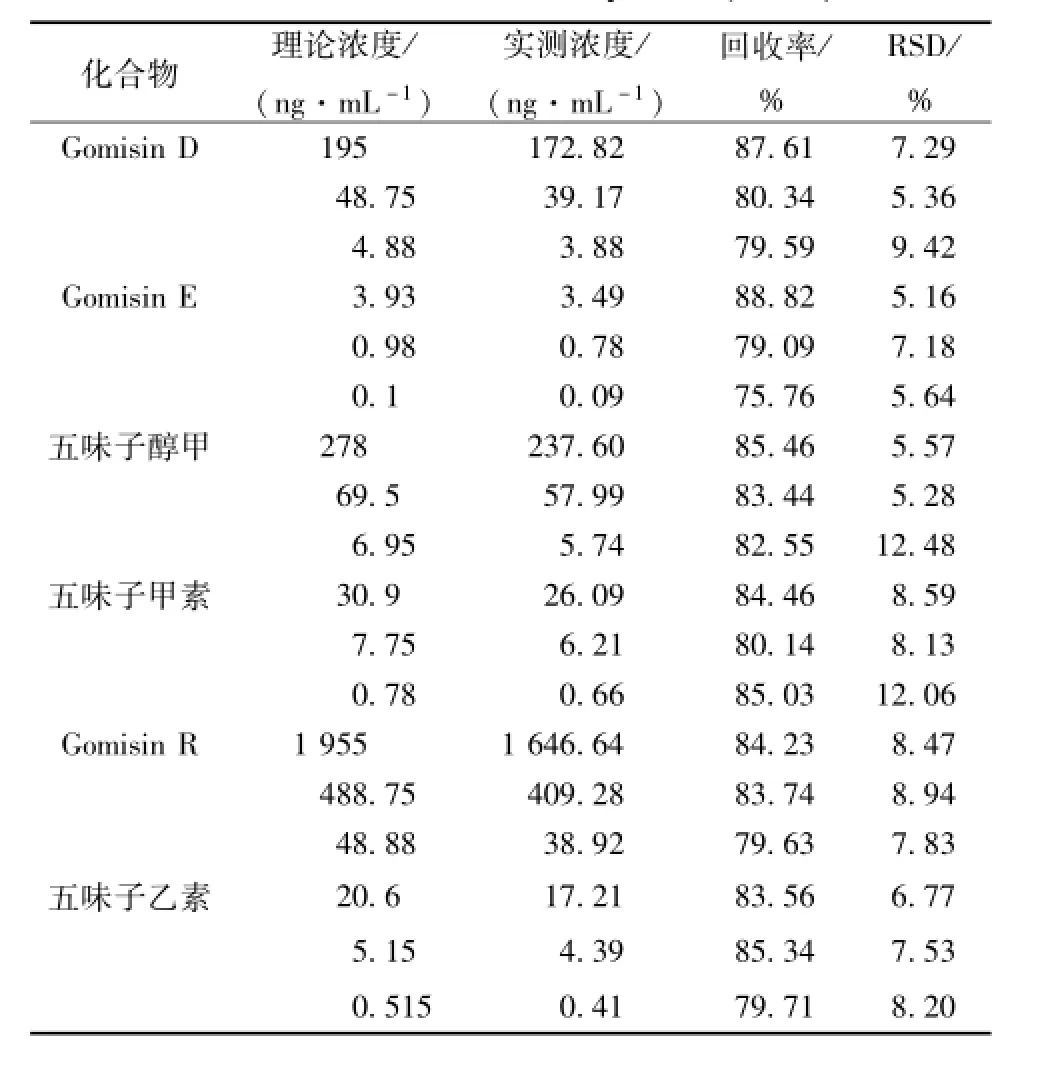
表 5 回收率实验结果 (n=5)Tab.5 Results of recovery tests(n=5)
2.7.6 基质效应 取 6 份不同来源的大鼠空白血浆 100 μL, 按样品处理项下的方法制得含尼莫地平内标液和低、中、高3个质量浓度的质控样品;另取流动相代替空白血浆,制得与上述标准品相同系列浓度的混合标准品溶液和内标物溶液,测得的相应峰面积比值用于评价基质效应,结果其比值均在 85.29% ~101.99%之间, 表明大鼠血浆生物基质不影响样品测定。
2.8 大鼠给药后的药代动力学 应用建立的 UHPLC-MS/MS 方法, 测定大鼠血浆药物浓度, 各时间点平均药-时曲线见图 2。 各组药代动力学参数见表 6。 由图 2、 表 6 可知, 6 种成分中 Gomisin E及五味子乙素的 t1/2明显较长, 表明此两种成分的消除较慢。
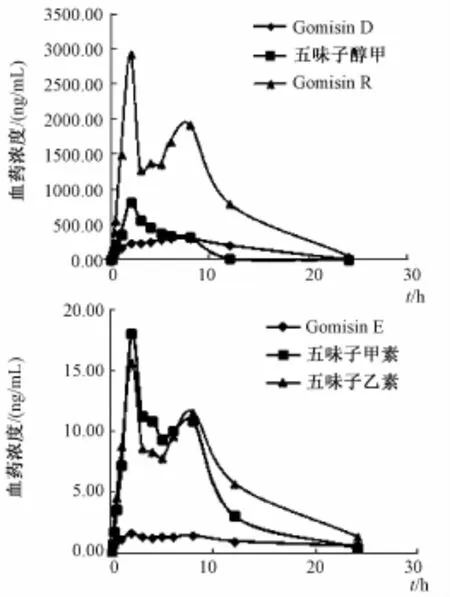
图 2 大鼠灌胃给予五味子提取物后的平均药-时曲线 (n=5)Fig.2 M ean concentration-time curve of rats after oral adm inistration of schisandra extracts(n=5)
3 讨论
本实验采用 UHPLC-MS/MS 同时测定大鼠灌服五味子提取物后血浆中6种木脂素类成分的量,以尼莫地平为内标,采用正离子模式检测。样品预处理采用了甲醇-乙腈沉淀蛋白方法, 操作简便, 血浆样品只需 100 μL, 杂质不干扰测定, 具有良好的精密度和准确度,有较高的灵敏度和专属性,重现性好,符合生物样品分析方法要求,适合大批量样品的分析测定。
实验结果显示, 6 种被测成分在 10 min 时即可检测到且达峰时间除 Gomisin D外均较短,提示这几种成分在胃部被很快吸收入血,与化合物结构差异有关;药时曲线呈现双峰,提示这6种成分在吸收过程中可能存在肠-肝循环、 肠-肠循 环或胃-肠循环。
本研究采用 UHPLC-MS/MS 系统建立了同时测定大鼠血浆样品中6种木脂素类成分特异、灵敏、可靠的定量分析方法, 该方法较 HPLC显著提高了定性分析的准确性以及定量分析的灵敏度,适于五味子的进一步药代动力学研究。
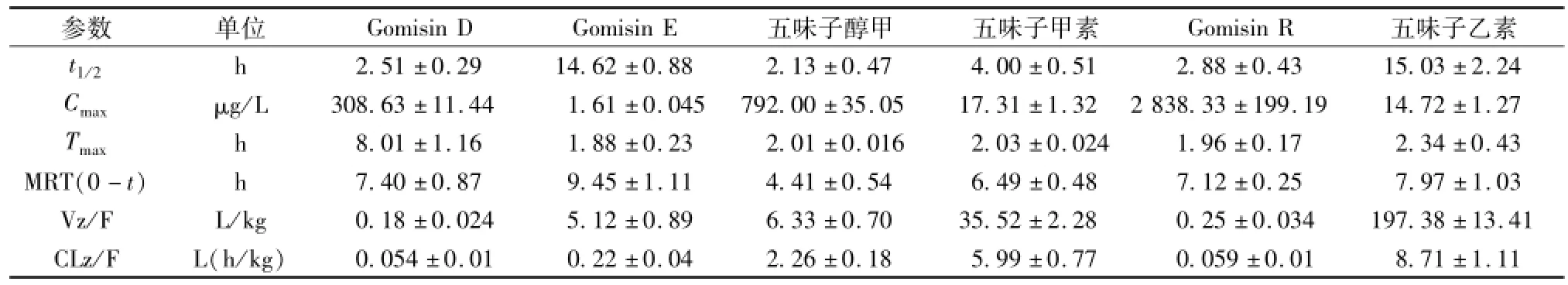
表 6 大鼠灌胃给予五味子提取物后的药动学参数 (n=5)Tab.6 Pharm acokinetics parameters of rats after oral adm inistration of schisandra extracts(n=5)
[ 1 ] 国家药典委员会.中华人民共和国药典:2010 年版一部[S].北京: 中国医药科技出版社, 2010:61-62.
[2] 应国清,愈志明,单剑锋,等.北五味子有效组分的研究进展[J].河南中医, 2005, 25(6):84.
[ 3 ] 名延波, 赵 华, 周 丽, 等.五味子的研究进展[J].实用药物与临床, 2007, 10(6):365-367.
[ 4 ] 杨 放, 袁 军, 付 平.五味子的研究概述[J].华西药学杂志, 2003, 186(5):438.
[ 5 ] 陈玮莹, 李 慧, 罗文鸿, 等.LC-MS 法快速测定大鼠血浆五味子乙素及其药代动力学分析[J].中国现代医学杂志, 2007, 17(14):1665-1669.
[ 6 ] Xu M, Wang G, Xie H, et al.Pharmacokinetic comparisons of schizandrin after oral administration of schizandrin monomer,Fructus Schisandrae aqueous extract and Sheng-Mai-San to rats[J] .JEthnopharmacol, 2008, 115(3):483-488.
[ 7 ] Mao S, Zhang H, Lv L, et al.Rapid determination and pharmacokinetics study of lignans in rat plasma after oral administration of Schisandra chinensis extract and pure deoxyschisandrin.[J] .Biomed Chromatoqr, 2011, 25(7):808-815.
[8] 吴春涛,刘铁楠,张志斐.大鼠血浆中五味子乙素浓度的HPLC测定法[ J].华北煤炭医学院学报, 2011, 13(3): 310-311.
[9] 韩 敏,黄志芳,易进海,等.黄芩与五味子配伍后对黄芩、 五味子脂甲代谢动力学的影响[J].中国实验方剂学杂志, 2012, 18(2):109-113.
[10] 王胜春, 赵慧萍, 皇甫孟军, 等.五味子与丹参配伍后对其成分五味子乙素、 醇甲的药代动力学影响[J].中成药,2004, 26(12):987-991.
[11] 杨万军, 张伟东, 王 莹, 等.射干麻黄配伍对射干异黄酮类成分在大鼠体内药代动力学的影响[J].中成药,2012, 34(11):2094-2099.
[12] 郭宗儒.药物化学总论[M].北京: 中国医药科技出版社,1994:5.
[13] Obach R S, Baxter JG, Liston T E, et al.The prediction of human pharmacokinetic parameters from preclinical and in vitro metabolism data[ J] .J Pharmacol Exp Ther, 1997, 283(1): 46-58.
[14] Shah V P, Midha K K, Hulse JD, etal.Bioanalyticalmethods validation—a revisitwith a decade of progress[ J] .Pharm Res,2000, 17(12):1551-1557.
[15] Karnes H T, March C.Precision, accuracy and data acceptance criteria in biopharmaceutical analysis[ J] .Pharm Res, 1993,10(10):1420-1426.
Sim ultaneous determ ination of six lignans compounds in rat p lasm a and pharm acokinetics by UHPLC-MS/MS
WANG Qing1, WANG Ying2, SONG Xiao-mei3, ZHANGWei-dong2, WANG Peng-yuan2,GU Yi2, WANG Xiao-juan2*
(1.Shaanxi Instituteof International Tradeand Commerce, Xiangyang 712046, China; 2.Department of Pharmacy, Schoolof Stomatology, Fourth Military Medical University, Xi'an 710032, China; 3.School of Pharmacy, Shaanxi University of Chinese Medicine, Xianyang 712046, China)
AIM To establish a UHPLC-MS/MS analyticalmethod for simultaneous determination of six lignans compounds of Gomisin D,Gomisin E, schizandrol A, schizandrin A,Gomisin R and schizandrin B in rat plasma and to study the pharmacokinetic characteristics after oral administration of Schisandra Chinensis Fructus. M ETHODS Chromatographic separation was achieved on an Agilent Poroshell 120 EC-C18column, with gradient elution using amobile phase that consisted of acetonitrile-0.1%formic acid in water.Detetion was performed by a triple-quadrupole tandem mass spectrometer inmultiple reactionmonitoring(MRM)mode using the electrospray ionization technique.RESULTS The calibration curve of six lignans compounds showed a good linear relationship, the intra-and inter-day precisions and accuracy met the requirements and the extraction recovery ranged between 75.76% ~88.82%.CONCLUSION This established method is simple, rapid,sensitive and stable and applicable to the analysis of Schisandra Chinensis Fructus for its further study.
UHPLC-MS/MS; rat plasma; Schisandra Chinensis Fructus; lignans; pharmacokinetics
R284.1
:A
:1001-1528(2014)02-0266-06
10.3969/j.issn.1001-1528.2014.02.011
2013-03-15
王 青 (1987—) , 女, 硕士, 从事中草药药效物质基础研究。 E-mail:709225603@qq.com
*通信作者: 王晓娟 (1962—) , 女, 主任药师, 从事天然药物化学与中药新制剂研究。 E-mail:wxjyh231@fmmu.edu.cn
