酸碱平衡与人体健康
2014-04-09张琼芬
张琼芬
【摘 要】缓冲溶液对人体健康具有非常重要的意义,人体的各种体液都属于缓冲溶液。本文从缓冲溶液的缓冲原理出发,论述了在生命代谢的过程中,缓冲溶液所起的作用及对人体健康的重要意义。
【关键词】体液 缓冲溶液 酸中毒 碱中毒 意义
中图分类号:G4 文献标识码:A DOI:10.3969/j.issn.1672-0407.2014.12.023
一、人体内各种体液都有其特定的pH值范围
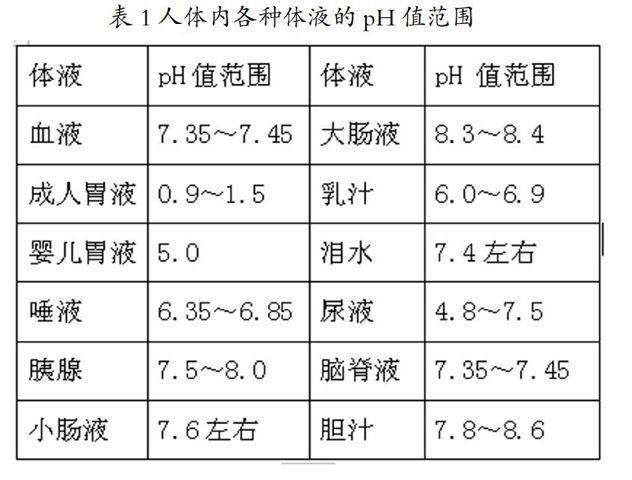
人体细胞生存于各种体液所形成的环境中,然而人体细胞对于体液酸碱性的变化非常敏感,体液的酸碱度哪怕是很微小的变化,都会影响到生物体的代谢作用,严重时甚至造成生命危险。因此人体内各种体液都保持着它们各自特定的pH值范围,这对于体内的各种生物化学反应和物质的存在状态是非常重要的。人体内各种体液的pH值范围见表1
在上述人体各部分的pH值中,以血液pH值要求最严格,血液的酸碱平衡遵循Henderson—Hasselbalch方程式:pH=pka+lg[HCO3-]/[H2CO3],pKa为H2CO3电离常数的负对数值,38℃时,Pka=6.1,正常人血浆中[HCO3-]=24mol/L,[H2CO3]=1.2mol/L,其比值为20:1,由此可得血液的pH=pka+lg[HCO3-]/[H2CO3]=6.1+lg20=6.1+1.3=7.4,血液的pH值稳定在7.4左右,只允许有0.05的波动。实验证明人体血液中存在一种能抵抗外来酸或碱影响其pH值的缓冲系统,它们可防止体液的pH值发生大幅度变化。
二、人体血液是天然的缓冲系统
能够抵抗外加少量酸、碱、或稀释,而本身pH值不发生显著变化的作用称缓冲作用,具有缓冲作用的溶液叫缓冲溶液。缓冲溶液一般可由(1)弱酸及其盐(如CH3COOH-CH3COONa、H2CO3-Na2CO3);(2)多元弱酸酸式盐及其次级盐(NaH2PO4-Na2HPO4、Na2CO3-NaHCO3);(3)弱碱及其盐(NH3.H2O-NH4Cl)组成。
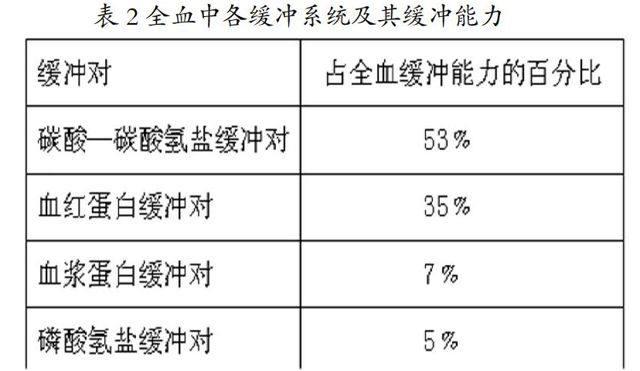
生物体液都是一些天然的缓冲溶液,而人体血液中能起缓冲作用的缓冲组分主要有以下4对:(1)碳酸—碳酸氢盐缓冲对(H2CO3-NaHCO3,H2CO3-KHCO3);(2)血红蛋白缓冲对(HHb-KHb,HHbO2-KHHbO2);(3)血浆蛋白缓冲对(HPr-NaPr);(4)磷酸氢盐缓冲对(NaH2PO4-Na2HPO4 KH2PO4-K2HPO4)。血液的主要缓冲系统及其缓冲能力见表2
三、缓冲溶液的作用原理
缓冲溶液之所以具有缓冲作用,是因为溶液中有抗酸成分和抗碱成分,能保持溶液的pH值几乎不变,现以血液中最重要的碳酸—碳酸氢盐缓冲对为例来说明缓冲作用的原理。
血液中最主要的缓冲对是碳酸—碳酸氢盐缓冲对,它在血液中的浓度最高缓冲能力最大,在维持血液pH中作用最大。在H2CO3-NaHCO3缓冲溶液中存在电离平衡。当溶液中加入少量酸(即H+)时,溶液中较多的共轭碱HCO3-只动用其中一小部分HCO3-和外来的H+结合生成H2CO3,电离平衡向左移动,当建立新平衡时,溶液里C(H+)不会显著增加,故溶液的pH值不会明显下降,pH值相对稳定。抗酸的离子方程式是:H++HCO3-=H2CO3,这里HCO3-起了对抗C(H+)增大的作用,故HCO3-(主要来自NaHCO3)是抗酸成分;反之,当向溶液中加入少量碱(即OH-)时,H+立即与OH-结合生成水,H+浓度降低,溶液中较多的共轭酸H2CO3中只动用其中一小部分H2CO3立即将质子转移给水分子,使平衡向右移动,补充H+。当达到新平衡时,C(H+)不会显著降低,溶液的PH值不会明显上升,pH值相对稳定。抗碱的离子方程式是:H2CO3+OH-=HCO3-+H2O,在此过程中H2CO3起了对抗OH-增大的作用,故H2CO3是抗碱成分。缓冲溶液除了能抵抗外来酸、碱的影响外,也能抵抗稀释对溶液pH值造成的影响,所以病人在静脉滴注大量生理盐水后,并不会使血液的pH值产生大的变化。
四、缓冲溶液对人体健康的重要意义
缓冲溶液对人体健康有着非常重要的意义,人体内各种体液的pH值均被控制在一个狭小的范围之内,便可保证机体的各种功能的发挥。有很多因素引起血液酸度增加:如当体内产生酸过多,肾功能不足或严重腹泻丢失大量的碳酸氢钠使碳酸氢钠浓度降低,血液pH值低于7.35,可造成代谢性酸中毒。有时因肺换气不足,如肺气肿、呼吸道梗阻等,使碳酸浓度升高,pH值降低,造成呼吸性酸中毒。这时抗酸成分HCO3-和过多H+的反应,平衡向左移动,使C(H+)降低并恢复正常,生成的H2CO3分解成水和二氧化碳。二氧化碳在血液中的溶解度低,通过肺部加速呼吸而排出体外,并通过肾脏调节HCO3-浓度回升。通过肺部和肾脏的调节,H2CO3和HCO3-的浓度恢复正常,从而保证血液PH在正常范围。如果血液中的酸性物质过多,pH值小于7.35产生酸中毒,体内抗酸成分HCO3-纠正不过来时,可用抗酸药物NaHCO3、乳酸钠、三羟甲基氨基甲烷等对症治疗;有很多因素引起血液碱度增加:如摄入过多的碱性物质、发高烧、严重呕吐、气喘等。此时抗碱成分H2CO3发挥作用,平衡向右移动,进一步离解出H+,以补充血液中降低的H+浓度,使C(H+)恢复正常。肺部和肾脏也同时调节H2CO3和HCO3-的浓度,使之处于正常,从而保证血液pH在正常范围。如果血液中的碱性物质过多pH值大于7.45产生碱中毒,体内抗碱成分纠正不过来时,可用抗碱药物如氯化铵等对症治疗。
