红籽鸢尾高频离体再生条件的初步筛选
2014-04-09张永侠原海燕顾春笋黄苏珍
张永侠, 原海燕, 顾春笋, 黄苏珍,①
〔1. 南京农业大学园艺学院, 江苏 南京 210095; 2. 江苏省·中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
红籽鸢尾(IrisfoetidissimaLinn.)为鸢尾科(Iridaceae)鸢尾属(IrisLinn.)多年生草本植物,原产于西欧和非洲北部。该种的叶鞘呈深绿色剑形,蒴果饱满且蒴果成熟开裂后露出红、橙黄和白等不同色泽的种子并一直垂挂到翌年春天,集观花、观叶和观果为一体,观赏价值较高。另外,该种还具有耐寒性好、在长江中下游地区四季常绿、适应性强及耐粗放管理等优点,是一种优良的常绿地被植物。
鸢尾属植物通常以种子和分株方式进行繁殖,繁殖率较低,难以满足生产需求[1-3]。虽然红籽鸢尾的结实率相对较高,但由于种子休眠期较长且休眠时间不等,使其发芽率低、出苗不整齐,自然繁殖系数仅为5~8,极大地限制了该种的推广和应用。
组织培养方法是解决鸢尾属植物快速繁殖的有效途径之一[4-6],但关于红籽鸢尾的组织培养研究还未见报道。作者以红籽鸢尾茎尖为外植体,对其愈伤组织和不定芽诱导以及生根培养基中的适宜激素组合进行筛选,初步建立红籽鸢尾的高效再生体系,为其种苗的规模化生产、推广应用以及转基因育种等工作奠定研究基础。
1 材料和方法
1.1 材料
供试红籽鸢尾于2010年引自法国,现定植于江苏省·中国科学院植物研究所鸢尾属植物种质圃。
1.2 方法
1.2.1 外植体消毒 红籽鸢尾植株用清水冲洗,去掉根和叶,保留2 cm茎尖作为外植体。将外植体置于体积分数10%洗涤液中浸泡10~15 min,流水冲洗干净后吸干表面水分;在无菌超净工作台上用体积分数75%乙醇浸泡45 s后,经无菌水浸泡并冲洗2次;再用质量体积分数0.1%HgCl2消毒10~12 min,无菌水再次冲洗5次,最后用无菌滤纸吸干表面水分,备用。
1.2.2 愈伤组织诱导培养基筛选 将已灭菌的外植体切成2 mm×2 mm×2 mm的小块,分别接种于6组含不同质量浓度2,4-D和6-BA的MS培养基(含30 g·L-1蔗糖和6 g·L-1琼脂,pH 5.8)中, 并置于温度(25±2) ℃ 、 光照时间12 h·d-1、光照度3 000 lx的条件下进行愈伤组织诱导培养。其中,2,4-D质量浓度分别为0.5、1.0、1.5、2.0和2.5 mg·L-1,6-BA质量浓度分别为0.1、0.2和0.3 mg·L-1。每处理5瓶,每瓶接种6个外植体,并设置3次重复。每天观察并记录在不同培养基上愈伤组织的诱导状况,30 d后统计愈伤组织诱导率。愈伤组织诱导率=(诱导出愈伤组织的外植体数/接种外植体数)×100%。
1.2.3 不定芽诱导培养基筛选 在筛选出的最适愈伤组织诱导培养基上继代培养2~3次后,将长势良好且一致的愈伤组织接种到5组含有不同质量浓度6-BA和NAA的MS培养基(含有30 g·L-1蔗糖和6 g·L-1琼脂,pH 5.8)上,并置于温度(25±2) ℃、光照时间12 h·d-1、光照度3 000 lx条件下进行不定芽诱导培养。6-BA质量浓度分别为0.5、1.0、1.5和2.0 mg·L-1,NAA质量浓度分别为0.2、0.3和0.5 mg·L-1。每处理5瓶,每瓶接种6块愈伤组织,并设置3次重复。每天观察并记录在不同培养基上不定芽诱导以及愈伤组织褐化状况, 30 d后统计不定芽诱导率及愈伤组织褐化率。不定芽诱导率=(诱导出不定芽的愈伤组织块数/接种的愈伤组织块数)×100%;愈伤组织褐化率=(褐化的愈伤组织块数/接种的愈伤组织块数)×100%。
1.2.4 生根培养基筛选 选择高3~5 cm且长势健壮的不定芽分别转接于含0.2、0.5、1.0和1.5 mg·L-1NAA的MS和1/2MS培养基(含30 g·L-1蔗糖和6 g·L-1琼脂,pH 5.8)上,并于温度(25±2) ℃ 、光照时间12 h·d-1、光照度3 000 lx的条件下进行生根培养。每处理3瓶,每瓶接种10个不定芽,并设置3次重复。每天观察并记录不同培养基上不定芽的生根状况,30 d后统计不定芽的生根率;同时,观察并统计根的颜色、数量和长度,并根据组培苗生长状况和叶的发黄枯萎程度对组培苗长势进行分级(分为Ⅰ级、Ⅱ级、Ⅲ级和Ⅳ级)。生根率=(生根的不定芽数/接种的不定芽数)×100%;
1.2.5 炼苗与移栽 将生根的组培苗放在室内炼苗2~3 d,然后置于温室内炼苗2~3 d;选取生长健壮的植株,洗净根部培养基,移栽到装有栽培基质〔V(田土)∶V(泥炭)∶V(珍珠岩)∶V(河沙)=2∶1∶1∶1〕的穴盘里,浇透水并置于温室内培养。每天定时喷水,5周后统计组培苗成活率。成活率=(成活植株数/移栽植株数)×100%。
1.3 数据统计与分析
使用EXCEL 2007统计分析软件对实验数据进行整理,并采用SPSS 19.0统计分析软件对相关数据进行方差分析和Duncan’s多重比较。
2 结果和分析
2.1 不同激素组合对愈伤组织诱导的影响
实验过程中,红籽鸢尾茎尖外植体接种在愈伤组织诱导培养基上7 d后出现膨大现象,10 d后陆续有淡绿色或黄色愈伤组织出现。表1结果表明:在添加1.5 mg·L-12,4-D和0.1 mg·L-16-BA的MS培养基上,红籽鸢尾愈伤组织诱导率最高,达到77.27%,与其他5组培养基差异显著(P<0.05),愈伤组织的生长状况也最好,呈淡绿色或黄色且生长旺盛。

表1 在添加不同激素组合的培养基上红籽鸢尾茎尖愈伤组织诱导状况比较
2.2 不同激素组合对不定芽诱导的影响
实验过程中,红籽鸢尾的愈伤组织在转接到不定芽诱导培养基上10 d左右开始变绿,21 d左右出现绿色芽点,28 d后可看到明显的不定芽。表2结果表明:除添加0.5 mg·L-16-BA和0.2 mg·L-1NAA的培养基外,其余4组培养基上不定芽的诱导率都很高,均在68%以上,最高达到75.56%;愈伤组织褐化率却较低,均低于15%;并且这4组培养基上不定芽的诱导率和愈伤组织的褐化率与前者均差异显著(P<0.05),但这4组培养基2个指标间的差异不显著。从表2还可见:培养基中6-BA添加量低于1.0 mg·L-1时,不定芽长势健壮;而6-BA添加量高于1.0 mg·L-1时,红籽鸢尾不定芽生长细密且长势较弱。 另外, 在6-BA添加量为1.0 mg·L-1时, 添加0.2或0.3 mg·L-1NAA,不定芽诱导率差异不显著。
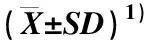
表2 在添加不同激素组合的培养基上红籽鸢尾不定芽诱导率及愈伤组织褐化率比较
2.3 基本培养基类型和NAA添加量对不定芽生根的影响
由统计结果(表3)可见:不论是以MS还是1/2MS为基本培养基,随着NAA添加量的提高,红籽鸢尾不定芽的生根率和生根质量均逐渐下降。NAA添加量较高(1.0~1.5 mg·L-1)时,不定芽上萌出的不定根短小、数量多且较细密,对组培苗的生长有一定的影响;当NAA添加量为0.2 mg·L-1时,不定芽的生根率显著高于其他处理组,生根数为3~6条,且根系粗壮。在NAA添加量相同的条件下,以MS为基本培养基,组培苗的生长状况优于以1/2MS为基本培养基。

表3 基本培养基类型及NAA添加量对红籽鸢尾不定芽生根的影响
2.4 组培苗的成活率统计
统计结果表明:经培养室和温室炼苗后,移栽到栽培基质中的红籽鸢尾组培苗的成活率较高,均达到95%以上。
3 讨论和结论
研究结果表明:在MS培养基中添加0.1 mg·L-16-BA和1.5 mg·L-12,4-D对红籽鸢尾茎尖愈伤组织的诱导效果最好,诱导率达77.27%;并且愈伤组织的生长状况也最好,呈淡绿色或黄色且生长旺盛。综合考虑不定芽诱导率、愈伤组织褐化率及培养成本,确定红籽鸢尾茎尖不定芽诱导的最适培养基为添加1.0 mg·L-16-BA和0.2 mg·L-1NAA的MS培养基,诱导率为72.22%;最适生根培养基为添加0.2 mg·L-1NAA的MS培养基,生根率达100.00%。
与其他研究者[2-3]有关鸢尾属植物组织培养的研究结果相比,作者筛选出的红籽鸢尾茎尖愈伤组织诱导培养基的诱导率较高,这可能与外植体不同有关。实验结果表明:6-BA添加量为1.0~2.0 mg·L-1,红籽鸢尾茎尖不定芽诱导率都很高,均在68%以上;但当6-BA添加量高于1.0 mg·L-1时,不定芽诱导率虽未明显下降,但不定芽生长不良。鸢尾属植物的组培苗生根相对比较容易,作者筛选出的红籽鸢尾组培苗的生根培养基配方与毕晓颖等[6]的筛选结果明显不同,但与徐立军等[7]的研究结果相似,表明鸢尾属不同种类适宜的生根培养基有一定差异。
参考文献:
[1] BOLTENKOV E V, MIRONOVA L N, ZAREMBO E V. Effect of phytohormones on plant regeneration in callus culture ofIrisensataThunb.[J]. Biology Bulletin, 2007, 34(5): 446-450.
[2] 吴月燕, 毛军平, 周倩倩. 路易斯鸢尾组织培养过程中愈伤组织的诱导和芽的分化[J]. 浙江农业科学, 2009(1): 86-89.
[3] 王文元, 王文和, 周文强, 等. 花菖蒲类鸢尾组培愈伤组织诱导及芽的分化研究[J]. 北方园艺, 2012(21): 92-94.
[4] BOLTENKOV E V, ZAREMBO E V.Invitroregeneration and callogenesis in tissue culture of floral organs of the genusIris(Iridaceae) [J]. Biology Bulletin, 2005, 32(2): 138-142.
[5] ISHMURATOVA M M, RAKHIMOVA A F. The use ofinvitroculture for propagation of theIrisL. hybrids[J]. Rastitel’Nye Resursy, 1999, 35(4): 74-78.
[6] 毕晓颖, 陈 晨, 郑 阳, 等. 野鸢尾的组织培养与快速繁殖[J]. 植物生理学通讯, 2009, 45(10): 1007.
[7] 徐立军, 管耀义, 张建佐. 有髯鸢尾“爱抚”的组培快繁研究[J]. 河北林业科技, 2005(4): 79.
