弓形虫胚层发育相关蛋白基因的克隆和序列分析
2014-04-09田维鹏周东辉张念章朱兴全宋铭忻
田维鹏,周东辉,张念章,朱兴全,宋铭忻
刚地弓形虫(Toxoplasmagondii)是一种专性细胞内寄生原虫,在全球范围内广泛感染人类和所有恒温动物。该病原能通过先天性或获得性途径感染宿主,是免疫抑制及免疫缺陷人群的主要致死病因之一[1-5]。由弓形虫引起的弓形虫病是一种重要的人兽共患寄生虫病,可造成严重的公共安全问题并给畜牧业生产带来巨大的经济损失[1-5]。因而对于预防和治疗弓形虫病的研究有着至关重要的意义。目前,国内外对于弓形虫抗原基因的研究主要集中于膜表面抗原(surface antigen,SAG)、微线体蛋白(microneme protein,MIC)、棒状体蛋白(rhoptry protein,ROP)、致密颗粒蛋白(dense granule protein,GRA)等[6-12],这四大类抗原均为弓形虫入侵和毒力相关蛋白。它们虽然能够代表弓形虫入侵宿主阶段的大部分蛋白,却不能代表其它类型的抗原蛋白。因而对于新型抗原基因的研究能够加快弓形虫病诊断和疫苗方面的发展,从而减少弓形虫病的危害。
弓形虫胚层发育相关蛋白(Toxoplasmagondiiembryogenesis-related protein,TgERP)是弓形虫卵囊发育阶段的特有蛋白,属于胚胎发育晚期丰富蛋白(late embryogenesis abundant domain-containing proteins,LEAs)[13]。这类蛋白在弓形虫中的功能尚不清楚,但在植物、无脊椎动物和微生物中,关于LEAs有诸多报道[14]。LEAs具有显著的多样性。虽然其各自的功能尚不清楚,但LEAs被认为在抵御各种恶劣外界环境的变化方面有着至关重要的作用[15]。TgERP是子孢子特有抗原,定位于卵囊上,推测与卵囊抵御外界环境的变化有关。同时该蛋白在卵囊上含量丰富,且免疫原性良好[16],但目前尚未见关于该基因在不同基因型弓形虫虫株的遗传变异研究报道。本研究首次从不同宿主和地理来源的15个弓形虫虫株中克隆了TgERP基因,并分析了其遗传变异情况,研究结果将为进一步评价该蛋白在弓形虫病的血清学诊断和基因疫苗等方面的价值奠定基础。
1 材料与方法
1.1虫株 本试验所用弓形虫样品Prugniaud(PRU)、TgPLh、QHO、TgC7、PYS和RH,均由家畜疫病病原生物学国家重点实验室寄生虫功能基因课题组保存,其余虫株的基因组DNA由美国田纳西大学微生物系苏春雷教授提供。所有虫株的具体信息见表1。
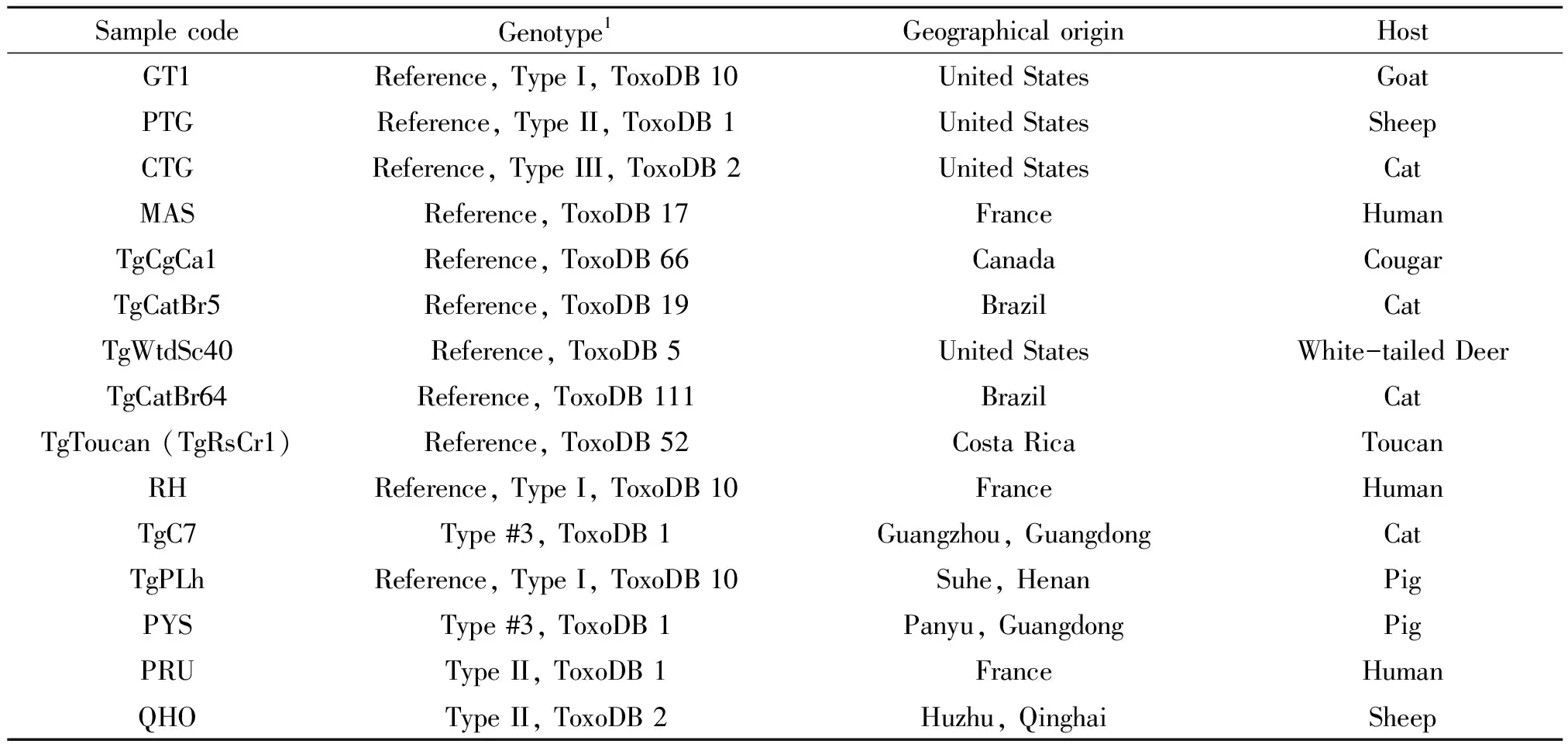
表1 本试验所用弓形虫样品
Note: 1:Based on genotyping results of Zhou et al. (2011, 2010)[17-18]
1.2主要试剂 PremixTaqVersion2.0、DL2000 DNA Marker和pMD18-T Vector试剂盒为宝生物工程(大连)有限公司产品,普通琼脂糖凝胶DNA回收试剂盒和大肠杆菌(Escherichiacoli)DH5α感受态细胞购自天根生化科技(北京)有限公司,Wizard® SV Genomic DNA Purification System购自Promega公司。
1.3引物设计 根据 网站中的弓形虫VEG株(Gene ID:TGVEG_027520)TgERP基因的序列设计一对引物,上游引物(TgERP-F)序列为:5′-ATGGCGACCGAGCACTCACAC-3′,下游引物(TgERP-R)序列为:5′-CTAGCCAAGCTTTTCTTGAACCTT-3′,由生工生物工程(上海)有限公司合成。
1.4样品处理及DNA提取 从液氮里取出弓形虫TgPLh虫株、TgC7虫株、PYS虫株、QHO虫株及RH虫株迅速置于37 ℃水浴中解冻,分别腹腔接种昆明鼠(0.5 mL/只)复苏。连续传3代后,分别收集感染弓形虫TgPLh株、TgC7株、PYS株、QHO株及RH株昆明鼠的腹水置1.5 mL灭菌的EP管中,600 r/min离心10 min,弃掉上清液,-80 ℃保存。另取人工感染弓形虫PRU株昆明鼠的脑组织,用灭菌的微型剪刀剪碎后碾磨,-80 ℃保存。将上述处理的样品按照Wizard® SV Genomic DNA Purification System说明书操作步骤提取DNA,提取的DNA置于-20 ℃冰箱保存。
1.5目的基因的克隆 分别以15个弓形虫虫株的基因组DNA为模板,用引物TgERP-F/TgERP-R扩增TgERP基因。PCR体系为:Premix Taq 12.5 μL、Primers(20 μmol/L)各 0.5 μL、DNA模板1 μL,用ddH2O补齐至25 μL。PCR扩增条件简单描述为:94 ℃ 5 min, 94 ℃ 30 s、57.3 ℃ 30 s、72℃ 1 min共35个循环,最后72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳由凝胶成像系统摄像。
1.6TgERP基因序列测定及分析 将上述PCR产物胶回收纯化后连接pMD18-T载体,热激法导入E.coliDH5α感受态细胞。经PCR鉴定的阳性菌液送由生工生物科技(上海)有限公司测序。将测序结果连同http://toxodb.org网站下载的VEG株(Gene ID:TGVEG_027520)和ME49株(Gene ID: TGME49_276850)的相应序列,利用公式D=1-M/L计算TgERP基因的种内变异率(M代表相同碱基数,L代表序列碱基总数)[19]。利用Clustal X1.83及Mega 4.0软件对获得的序列进行比对及计算遗传距离,然后用Paup4.0程序中的邻接法(Neighbor-joining method, NJ)绘制种系发育树,并用Puzzle 5.2程序构建最大似然树(Maximum Likelihood, ML)[20-21]。邻接法采用Tamura-Nei模型进行分析;ML法采用Hky替代模型和Quartet puzzling搜索程序进行分析,采用自展检验(bootstrap test)估算所构建系统树的可靠性,复制数为1 000[21]。
1.7TgERP氨基酸序列的推导与分析 分别将获得的15株弓形虫的TgERP基因测序结果,利用DNAStar软件翻译成TgERP蛋白序列后进行蛋白序列比对,分析其在氨基酸水平上的变异。
2 结 果
2.1PCR扩增结果 15个弓形虫虫株均成功地扩增出长度约300 bp的片段,与预期目的片段长度相符,且无非特异性条带,空白对照为阴性(图1)。
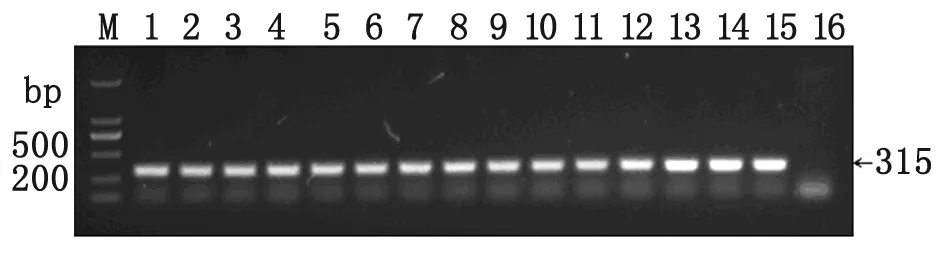
图1TgERP基因的PCR产物电泳图
Fig.1AgarosegelelectrophoresisforPCRproductsoftheTgERPgene
M: DNA maker 2000; 1-15: PCR products of TgPLh, TgC7, PYS, QHO, PRU, RH, GT1, PTG, CTG, MAS, TgCgCa1, TgCatBr5, TgWtdSc40, TgCatBr64, and TgToucan for TgERP gene;
16: Negative control.
2.2测序结果及分析 从15个弓形虫虫株中扩增的TgERP基因长度均为315 bp,A+T含量在46.67%~46.98%之间。利用DNAStar 5.0的Megalign软件分析15个TgERP基因序列发现,仅在核苷酸序列的第224位发生了碱基的变异,变异率为0%~0.32%。其中TgPLh株、RH株、GT1株、MAS株、TgCatBr5株、TgCatBr64株及TgToucan株序列相同。
2.3TgERP基因系统发生树 通过系统发育树分析显示,用ML和NJ法构建的种系发育树的拓扑结构基本一致(图2)。其中基因型I型的RH株、TgPLh株和GT1株聚在一个分支上,基因型II型的PTG株、QHO株、PRU株和基因型Ⅲ型的弓形虫CTG株聚在同一个分支上,其余基因型为稀有型的虫株在两个分支上均有出现。TgERP基因序列无法区分不同基因型的弓形虫虫株(图2)。
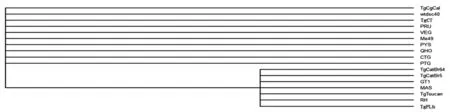
图2 TgERP基因核苷酸序列的遗传进化树分析
2.4TgERP氨基酸序列的分析 将15株弓形虫虫株TgERP基因的ORF利用生物学软件进行翻译,结果表明该段序列共编码104个氨基酸。与弓形虫VEG株和ME49的相应序列进行比对后发现,仅在氨基酸序列的第75位发生缬氨酸与丙氨酸的变异,变异率在0%~0.96%之间(图3)。

图3 TgERP氨基酸序列的比对结果
3 讨 论
TgERP是卵囊阶段的特有蛋白,在卵囊壁上含量丰富,具有较好的反应原性[12]。Hill等[18]应用该蛋白建立了ELISA诊断方法,对农场饲养动物的弓形虫卵囊感染情况进行了初步调查,证明卵囊污染在所检测地区普遍存在。为了阐明TgERP基因在不同基因型弓形虫虫株的序列变异规律,本研究首次从不同宿主和地理来源的15个弓形虫虫株中克隆了TgERP基因。经核苷酸序列比对后发现,该基因的变异率为0%~0.32%。对推导的氨基酸序列比对发现,变异位点仅发生在氨基酸序列的第75位,说明该蛋白在不同基因型的弓形虫虫株中变异很小,具有高度的保守性。系统发育分析表明,ML法和NJ法构建的系统发育树拓扑结构基本一致。TgERP基因序列虽然能够区分弓形虫基因型I型和基因型II/III型虫株,但不能完全区分所有弓形虫基因型虫株,不适合作为遗传标记分子来研究弓形虫的基因分型。
TgERP基因编码的蛋白序列仅在第75位发生缬氨酸与丙氨酸的变异,变异率为0%~0.96%,表明该蛋白在不同弓形虫虫株中高度保守,可以作为血清学诊断方法的候选抗原,也可能作为疫苗研究的候选抗原,值得进一步研究。
参考文献:
[1]Montoya JG, Liesenfeld O. Toxoplasmosis[J]. Lancet, 2004, 363(9425): 1965-1976.
[2]Weiss LM, Dubey JP. Toxoplasmosis: A history of clinical observations[J]. Int J Parasitol, 2009, 39(8): 895-901. DOI: 10.1016/j.ijpara.2009.02.004
[3]Zhou P, Chen Z, Li HL, et al.Toxoplasmagondiiinfection in humans in China[J]. Parasit Vectors, 2011, 4: 165. DOI: 10.1186/1756-3305-4-165
[4]Dubey JP. Toxoplasmosis of animals and humans[M]. 2nded. Boca Raton: CRC Press, 2010: 313.
[5]Dubey JP, Jones JL.Toxoplasmagondiiinfection in humans and animals in the United States[J]. Int J Parasitol, 2008, 38(11): 1257-1278. DOI: 10.1016/j.ijpara.2008.03.007
[6] Meng M, He S, Zhao G, et al. Evaluation of protective immune responses induced by DNA vaccines encodingToxoplasmagondiisurface antigen 1 (SAG1) and 14-3-3 protein in BALB/c mice[J]. Parasit Vectors, 2012, 5: 273. DOI: 10.1186/1756-3305-5-273
[7]Yuan ZG, Ren D, Zhou DH, et al. Evaluation of protective effect of pVAX-TgMIC13 plasmid against acute and chronicToxoplasmagondiiinfection in a murine model[J]. Vaccine, 2013, 31(31): 3135-3139. DOI: 10.1016/j.vaccine.2013.05.040
[8]Peng GH, Yuan ZG, Zhou DH, et al.Toxoplasmagondiimicroneme protein 6 (MIC6) is a potential vaccine candidate against toxoplasmosis in mice[J]. Vaccine, 2009, 27(47): 6570-6574. DOI: 10.1016/j.vaccine.2009.08.043
[9]Liu MM, Yuan ZG, Peng GH, et al.Toxoplasmagondiimicroneme protein 8 (MIC8) is a potential vaccine candidate against toxoplasmosis[J]. Parasitol Res, 2010, 106(5): 1079-1084. DOI: 10.1007/s00436-010-1742-0
[10]Yuan ZG, Zhang XX, Lin RQ, et al. Protective effect against toxoplasmosis in mice induced by DNA immunization with gene encodingToxoplasmagondiiROP18[J]. Vaccine, 2011, 29(38): 6614-6619. DOI: 10.1016/j.vaccine.2011.06.110
[11]Yuan ZG, Zhang XX, He XH, et al. Protective immunity induced byToxoplasmagondiirhoptry protein 16 against toxoplasmosis in mice[J]. Clin Vaccine Immunol, 2011, 18(1): 119-124. DOI: 10.1128/CVI.00312-10
[12]Chen J, Li ZY, Zhou DH, et al. Genetic diversity amongToxoplasmagondiistrains from different hosts and geographical regions revealed by sequence analysis of GRA5 gene[J]. Parasit Vectors, 2012, 5: 279. DOI: 10.1186/1756-3305-5-279
[13]Fritz HM, Bowyer PW, Bogyo M, et al. Proteomic analysis of fractionatedToxoplasmaoocysts reveals clues to their environmental resistance[J]. PLoS One, 2012, 7(1): e29955. DOI: 10.1371/journal.pone.0029955
[14]Tunnacliffe A, Wise MJ. The continuing conundrum of the LEA proteins[J]. Naturwissenschaften, 2007, 94(10): 791-812. DOI: 10.1007/s00114-007-0254-y
[15]Hundertmark M, Hincha DK. LEA (late embryogenesis abundant) proteins and their encoding genes inArabidopsisthaliana[J]. BMC Genomics, 2008, 9: 118. DOI: 10.1186/1471-2164-9-118
[16]Hill D, Coss C, Dubey JP, et al. Identification of a sporozoite-specific antigen fromToxoplasmagondii[J]. J Parasitol, 2011, 97(2): 328-337. DOI: 10.1645/GE-2782.1
[17]Zhou P, Sun XT, Yin CC, et al. Genetic characterization ofToxoplasmagondiiisolates from pigs in southwestern China[J]. J Parasitol, 2011, 97(6): 1193-1195. DOI: 10.1645/GE-2851.1
[18]Zhou P, Nie H, Zhang LX, et al. Genetic characterization ofToxoplasmagondiiisolates from pigs in China[J]. J Parasitol, 2010, 96(5): 1027-1029. DOI: 10.1645/GE-2465.1
[19]Chilton NB, Gasser RB, Beveridge I. Differences in a ribosomal DNA sequence of morphologically indistinguishable species within theHypodontusmacropicomplex (Nematoda: Strongyloidea)[J]. Int J Parasitol, 1995, 25(5): 647-651.
[20]Li L, Yu LY, Zhu XQ, et al.Orientobilharziaturkestanicumis grouped within African schistosomes based on phylogenetic analyses using sequences of mitochondrial genes[J]. Parasitol Res, 2008, 102(5): 939-943. DOI: 10.1007/s00436-007-0857-4
[21]Liu GH, Gasser RB, Su A, et al. Clear genetic distinctiveness between human- and pig-derivedTrichurisbased on analyses of mitochondrial datasets[J]. PLoS Negl Trop Dis, 2012, 6(2): e1539.DOI: 10.1371/journal.pntd.0001539
