三种重组蛋白混合抗原的间接ELISA法检测人血清弓形虫IgM和IgG抗体
2014-04-09丁邦胜罗庆礼沈继龙
丁邦胜,李 霞,罗庆礼,余 莉 ,沈继龙
弓形虫是一种专性胞内寄生原虫,也是机会性致病原虫,人体获得性感染弓形虫后通常无明显的临床表现,但对免疫力低下的病人可引起严重的弓形虫病[1-2]。母体孕期弓形虫感染可引起死胎、流产、畸形和智力障碍等[3]。弓形虫病的临床表现多种多样,仅靠临床表现来诊断十分困难,实验室检测是一种非常重要的辅助手段。弓形虫病的检测方法虽多,但血清免疫诊断尤其ELISA检测法仍是当前弓形虫感染实验室诊断的主要手段[4-8]。就ELISA法而言,诊断抗原的选择和抗原的质量对检测结果的准确性非常重要。在以往的研究中我们已完成了刚地弓形虫RH株pET-28a/rSAGl,pET-28a/HXGPRT和pET-28a/AK载体的构建以及重组蛋白的免疫特异性的验证[9-11];HXGPRT和AK两种蛋白酶对弓形虫生存作用的研究[12-15]以及用重组抗原rSAG1,rHXGPRT和rAK组合成“鸡尾酒”式的多种抗原的联合诊断对弓形虫IgG抗体检测的初步研究[16]。本文是以rSAG1、rHXGPRT和rAK作为检测抗原,对66例IgM阳性和70例弓形虫IgG血清,以及30阴性血清进行平行检测,探索三种抗原混合在弓形虫病免疫诊断中的应用价值。
1 材料与方法
1.1材料
1.1.1主要仪器、试剂和菌种 上海第三分析仪器厂生产的UV-754紫外分光光度计;美国BIO-RAD公司的PowerPac蛋白电泳仪;美国BioTech公司的全自动酶标仪。蛋白纯化试剂盒His·Ban Purification Kit购自Novagen公司;弓形虫IgG和弓形虫IgM试剂盒(Toxo-ELISA kit),由美国Zeus(宙斯)公司生产;HRP标记羊抗人IgG,IgM为华美公司产品;其它试剂为国产。含pET-28a/rSAGl,pET-28a/HXGPRT和pET-28a/AK原核表达载体的菌株为安徽医科大学安徽病原生物学省级实验室保种,保存条件为-80℃。
1.1.2样本来源 阳性血清由安徽省立医院检验科留取。共收集阳性血清132例,其中:4例IgG和IgM均阳性,62例IgM阳性IgG阴性,66例IgG阳性IgM阴性,所以实际66例IgM阳性,70例IgG阳性,两种抗体阳性血清共136例。男31例,女101例,年龄1~88岁,这些病人血清经Toxo-ELISA试剂盒筛选。阴性血清30例,取自体检人群中的正常人,经Toxo-ELISA试剂盒筛选结果为阴性。所有血清均-80℃保存备用,阳性和阴性对照均由进口试剂盒所配带。
1.2方法
1.2.1重组抗原的制备 将-80℃保存的含有弓形虫pET-28a/rSAG1,pET-28a/HXGPRT和pET-28a/AK表达载体的菌种复苏活化,扩大培养,IPTG诱导表达重组蛋白rSAG1,rHXGPRT和rAK。按His·Band Purification Kit说明书,用6×His亲和层析柱纯化表达产物:38.5 kDa的重组蛋白rSAG1,30 kDa的重组蛋白rHXGPRT和43 kDa的重组蛋白rAK。用SDS-PAGE分析表达产物的纯度,Western-blot验证重组蛋白的免疫特异性[9-11],改良的Bradford法(考马斯亮蓝法)测定所得蛋白浓度。
1.2.2最佳检测条件的建立 取弓形虫IgM,IgG阳性和阴性血清各20份,每份50 μL,混匀成阳性和阴性的混合血清,进行如下正交叉试验:分别将rSAGl、rHXGPRT和rAK稀释成10、5、2.5、1.25 μg/mL四种浓度,再将相同浓度的3种重组抗原按1∶1∶1比例等体积混合,用含有不同浓度混合抗原的pH 9.6碳酸盐缓冲液100 μL/孔包被聚苯乙烯酶标板。阳性和阴性混合血清分别按1∶50、1∶100、1∶200进行稀释,加样100 μL/孔,37 ℃孵育1 h,PBS洗板5次。再分别加1∶2 000、1∶4 000、1∶8 000稀释度的辣根过氧化物酶标记的羊抗人IgM,IgG抗体,37 ℃孵育30 min,PBS洗板5次, 37 ℃避光TMB显色底物显色10 min, 2 mol/L H2SO4终止显色,15 min内全自动酶标仪测定OD450nm值。
1.2.3精密度试验 按上述实验确定的最佳检测条件对同一份IgM,IgG阳性及以阴性混合血清重复检测20次,计算A450值的变异系数(CV 值) ,CV 值等于A450值的标准差除以均值。
1.2.4灵敏度试验 按上述实验确定的最佳抗原浓度和最佳酶标记羊抗人IgM和IgG抗体稀释度为检测检测条件分别对IgM阳性和IgG混合血清各一份作1∶50、1∶100、1∶200、1∶400倍比稀释进行检测。
1.2.5抑制试验 采用抗体抑制试验:取IgM和IgG阳性混合血清各20 μL,加5 μL rSAG1 (0.5 mg/ mL) 5 μL rHXGPRT(0.5 mg/ mL)和5 μL rAK(0.5 mg/ mL),另取20 μL 的阳性混合血清,加15 μL 的PBS 作为对照,37 ℃孵育1 h后,按上述实验确定的最佳检测条件对其进行检测。抑制率= (对照A450值- 抑制后A450值) /对照。
1.2.6临界值的计算 临界值(cut off value):按上述实验确定的最佳检测条件检测30例弓形虫抗体阴性的正常血清样本,以正常血清OD450nm值的均数加两倍标准差为正常值上限,OD值高于上限为阳性,OD值低于上限为阴性。
1.2.7(rSAG1+rHXGPRT+rAK)-ELISA法血清抗体的检测 按上述实验确定的最佳检测条件分别检测经Zeus Toxo-ELISA试剂盒筛选的66例弓形虫IgM阳性血清、70例弓形虫IgG阳性血清和30例弓形虫抗体阴性血清,设阳性对照、阴性对照、空白对照各两孔。
1.2.8分析指标χ2检验结果;敏感性(%)为对Zeus Toxo-ELISA试剂盒筛选出的弓形虫抗体阳性血清的检出率;特异性(%)为正常人的阴性率;总符合率为两种方法检测结果一致的标本数/检测标本总数×100。
2 结 果
2.1重组抗原的纯度及浓度 弓形虫SAG1,HXGPRT和AK三种融合基因表达产物经Ni2+亲和层析法纯化后,我们获得了较纯的重组融合蛋白:rSAG1,rHXGPRT和rAK。用捷达凝胶成像系统软件分析SDS-PAGE电泳结果,表明3种重组蛋白抗原纯度均可达90%以上;改良的Bradford法测定重组蛋白含量分别为rSAGl:1.83 mg/mL ;rHXGPRT:3.51 mg/mL;rAK:2.16 mg/mL。各重组蛋白抗原均与阳性抗血清有免疫反应性,已经Western-blot试验得到验证[9-11]。
2.2最佳条件 正交叉试验结果显示间接ELISA法3种重组抗原混合(rSAG1+rHXGPRT+rAK)检测弓形虫IgM最佳条件:各单一抗原浓度分别为5 μg/mL ;血清稀释度为1∶100;辣根过氧化物酶标记的羊抗人IgM抗体的稀释度为1∶4 000;正交叉试验结果显示间接ELISA法3种重组抗原混合(rSAG1+rHXGPRT+rAK)检测弓形虫IgG最佳条件:各单一抗原浓度分别为5 μg/mL;血清稀释度为1∶50;辣根过氧化物酶标记的羊抗人IgG抗体的稀释度为1∶4 000。
2.3精密度试验 同一份弓形虫IgM阳性及阴性混合血清重复检测20次,阳性血清A450值的变异系数(CV) 值为12.3%,阴性血清A450值的变异系数(CV) 值为10.2%。同一份弓形虫IgG阳性及阴性混合血清重复检测20次,阳性血清A450值的变异系数(CV) 值为14.5%,阴性血清A450值的变异系数(CV) 值为11.9%。
2.4灵敏度试验 弓形虫混合血清阳性结果稀释度:IgM为1∶50至1∶200。IgG在1∶50至1∶400之间。
2.5抑制试验 IgM:对照组A450均值为0.86,抑制组A450均值为0.23,特异性抑制率为73.3%。IgG:对照组A450均值为1.25,抑制组A450均值为0.33,特异性抑制率为73.6%。
2.6Cut off值的确定 30例进口试剂盒检测IgM为阴性的人血清OD450nm平均值为0.23,标准差为0.11,临界值为0.45,测定血清OD450nm值≥0.45,判断为阳性,测定血清OD450nm值<0.45为阴性。30例进口试剂盒检测IgG为阴性的人血清OD450nm平均值为0.31,标准差为0.10,临界值为0.51,测定血清OD450nm值≥0.51,判断为阳性,测定血清OD450nm值<0.51为阴性。
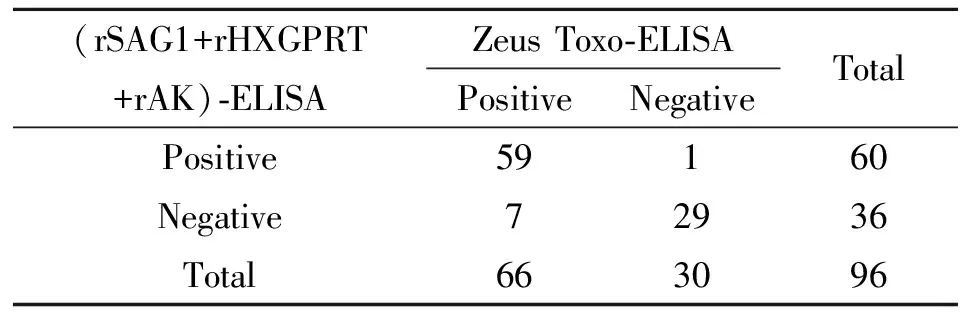
2.8IgM检测结果比较 (rSAG1+rHXGPRT+rAK)-ELISA与Zeus Toxo-ELISA试剂盒检测IgM结果比较:66例IgM阳性血清中,59例阳性,7例假阴性。30例阴性血清中29例为阴性,有1例假阳性。χ2值为3.12,P>0.05,两法检测结果差异无显著性,见表1。
表1(rSAG1+rHXGPRT+rAK)-ELISA法与ZeusToxo-ELISA试剂检测IgM结果比较
Tab.1Comparisonof(rSAG1+rHXGPRT+rAK)-ELISAandZeusToxo-ELISAindetectionofIgMantibodiestoT.gondii
(rSAG1+rHXGPRT+rAK)-ELISAZeus Toxo-ELISAPositiveNegativeTotalPositive59160Negative72936Total663096
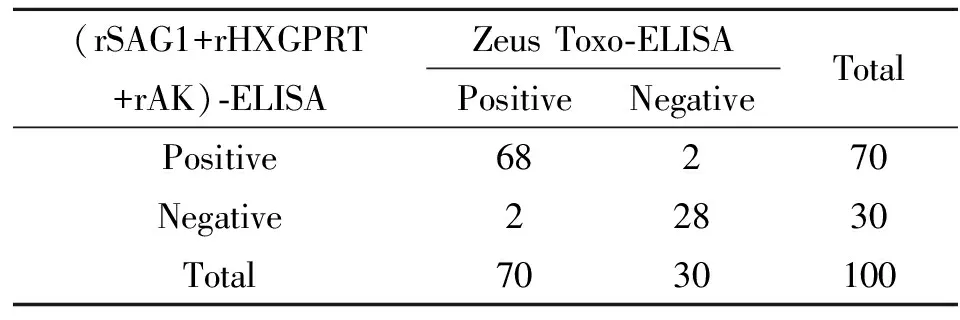
2.9IgG检测结果比较 (rSAG1+rHXGPRT+rAK)-ELISA法与Zeus Toxo- ELISA试剂盒检测IgG比较结果:70例IgG阳性血清中,68例为阳性,2例为假阴性。30例阴性样本中28例为阴性,2例假阳性。χ2值为0.25,P>0.05,两法检测方法结果无显著性差异,见表2。
表2(rSAG1+rHXGPRT+rAK)-ELISA法与ZeusToxo-ELISA试剂检测IgG结果比较
Tab.2Comparisonof(rSAG1+rHXGPRT+rAK)-ELISAandZeusToxo-ELISAindetectionofIgGantibodiestoT.gondii
(rSAG1+rHXGPRT+rAK)-ELISAZeus Toxo-ELISAPositiveNegativeTotalPositive68270Negative22830Total7030100
2.10敏感性、特异性、总符合率和约登指数 以Toxo-ELISA试剂检测结果为标准,(rSAG1+rHXGPRT+rAK)-ELISA法检测66例IgM阳性、30例阴性、70例IgG阳性血清结果:66例IgM阳性血清,出现7例假阴性,敏感性为89.4%;30例阴性血清,出现1例假阳性,特异性为96.7%,总符合率为91.7%,约登指数为0.861;70例IgG阳性血清,结果出现2例假阴性,敏感性为97.1%;30例阴性血清,出现2例假阳性,特异性为93.3%,总符合率为96.0%,约登指数为0.904。结果见表3。
3 讨 论
临床上客观评价弓形虫免疫学诊断试剂较为困难,原因是缺少病原体检测阳性的“金标准”。目前弓形虫感染的诊断主要采用ELISA法检测病人血清中的特异性IgM和IgG抗体,以及DNA诊断。前者的市售试剂盒主要分为国产和进口两类。一般认为进口试剂质量较好,但价格昂贵、成本较高,增加了患者的经济负担。国产试剂质量尚缺少全面的评价[8,17-19]。据报道国产试剂ELISA法所用抗原大都是全虫蛋白的粗制抗原[20-21],粗制抗原的制备多采用弓形虫RH株速殖子全虫抗原,在制备过程中需要利用动物传代或细胞培养,不仅成本较高,实验要求条件严格,而且有实验室感染的危险。另外,制备的抗原室间和批间差异较大,难以标准化,所以不同商家不同批号试剂检测结果的符合率不尽人意。

表3 (rSAG1+rHXGPRT+rAK)-ELISA检测166例血清结果
SAG1是弓形虫的表面抗原,其氨基酸序列相对保守,几乎存在于所有的弓形虫虫株中,对应的IgG抗体在急性期和慢性期都有较高的滴度,但不适于缓殖子引起的隐性感染检测,也难以区分急、慢性弓形虫病[22]。HXGPRT(次黄嘌呤-黄嘌呤-鸟嘌呤磷酸核糖转移酶)和AK(腺苷激酶)是弓形虫核苷酸补救合成途径的关键酶,这两种酶存在于弓形虫生活史的各个时期,包括隐性感染的缓殖子阶段和显性感染的速殖子阶段。以往的研究中已证明了rHXGPRT和rAK的抗原性和免疫特异性[10-11], rHXGPRT和rAK作为弓形虫免疫诊断抗原有较高的价值。本次研究采用弓形虫rSAG1 rHXGPRT和rAK 3种重组蛋白作为抗原的“鸡尾酒”式组合检测,并用进口试剂筛查的同一批次血清,对弓形虫IgM和IgG抗体进行了平行检测。结果,检测IgM的敏感性和特异性分别为89.4%和96.7%,高于Jalallou N[23]和谈永飞[24]等只用rSAG1一种抗原的检测;检测IgG敏感性和特异性分别97.1%和93.3%,与进口试剂盒总符合率为96.0%,高于司进等[25]只用rSAG1一种抗原的检测结果。组合检测试剂弥补了单一rSAG1抗原漏检抗缓殖子抗体的不足。由于三种重组抗原提高了抗原纯度,因此也增强了检测的敏感性和特异性。本研究的间接ELISA法rSAG1、rHXGPRT和rAK 3种抗原混合对IgM和IgG两种抗体的检测结果和Aubert D等[26]用多个重组抗原混合效果相符,均表明混合重组抗原比单一重组抗原检测弓形虫IgM和IgG效果更好。
本次研究显示3种重组抗原rSAG1、rHXGPRT和rAK混合的间接ELISA法检测弓形虫IgM和IgG抗体具有较高的敏感性、特异性,与进口Toxo-ELISA试剂的检测结果相比较总符合率高,试剂易于标准化,减少了实验动物的使用,为临床弓形虫病的检测试剂的国产化奠定基础。
参考文献:
[1]Wu GL. Human parasitology[M]. 4thed. Beijing: People's Medical Publishing House, 2013: 161-177. (in Chinese)
吴观陵.人体寄生虫学[M].4版.北京:人民卫生出版社,2013:161-177.
[2]Keith A, Jean D.Toxoplasmagondii: a protozoan for the nineties[J]. Infect Immun, 1993, 61(4): 1169-1172.
[3]Yu ES. China toxoplasmosis[M]. Hong Kong: Asian Medical Publishing House, 2001: 1-45. (in Chinese)
于恩庶. 中国弓形虫病[M]. 香港: 亚洲医药出版社,2001:1-45.
[4]Kimbita EN, Xuan X, Huang X, et al. Serodiagnosis ofToxoplasmagondiiinfection in cats by enzyme linked immunosorbent assay using recombinant SAG1[J]. Vet Parasitol, 2001, 102(1-2): 35-44. DOI: 10.1016/S0304-4017(01)00522-2
[5]Xu H, Cui JT, Ni AP, et al. Seroepidemiology survey ofToxoplasmagondiiinfection in hospitalized patients in Peking Union Medical College Hospital during 2008-2010[J]. Int J Med Parasit Dis, 2011, 38(3): 170-172. DOI: 10.3760/cma.j.issn1673-4122.2011.03.010 (in Chinese)
许惠,崔京涛,倪安平,等. 2008-2010年北京协和医院住院患者弓形虫的流行病学调查[J]. 国际医学寄生虫病杂志,2011,38(3): 170-172. DOI:10.3760/cma.j.issn1673-4122.2011.03.010
[6]Qin C, Wang HX. Dectection ofToxoplasmagondiiDNA in blood from infected rabbits by PCR[J]. Chin J Practical Med, 2009, 36(22): 13-14. DOI: 10.3760/ cma.j.issn1674-4756.2009.22.008 (in Chinese)
秦川,王洪兴. PCR法检测弓形虫感染家兔血液中弓形虫基因片段[J]. 中国实用医刊,2009,36(22): 13-14. DOI: 10.3760/ cma.j.issn1674-4756.2009.22.008
[7]Ling Y, Li H, Feng CY, et al. The clinical application of protein chip forToxoplasmagondiidetection[J]. Clin Med Engineer, 2010, 17(8): 81-82. DOI: 10.3936/j.issn.1674-4659.2010.08.081 (in Chinese)
凌云,李华,冯春颜,等. 蛋白芯片法检测弓形虫的临床应用[J]. 临床医学工程,2010,17(8): 81-82. DOI:10.3936/j.issn.1674-4659.2010.08.081
[8]Jiang SF, Zhang SY, Pan CE, et al. Evaluation of five commercial available kits for detecting antibodies ofToxoplasmagondii[J]. Chin J Zoonoses, 2003, 19(1): 97-99. DOI:10.3969/j.issn.1002-2694.2003.01.030(in Chinese)
蒋守富,张述义,潘彩娥,等. 5种市售弓形虫抗体检测试剂盒的评价[J]. 中国人兽共患病杂志,2003,19(1): 97-99. DOI:10.3969/j.issn.1002-2694.2003.01.030
[9]Du J, Shen JL, Wang XL, et a1. Molecular cloning and expression ofT.gondiisurface antigen SAGl gene inE.coli[J]. J Clin Transfus Lab Med, 2004, 6(1): 4-7. DOI:10.3969/j.issn.1671-2587.2004.01.002(in Chinese)
都建,沈继龙,汪学龙,等. 弓形虫表面抗原SAG1基因的克隆及在大肠杆菌中的表达[J]. 临床输血与检验,2004,6(1): 4-7. DOI:10.3969/j.issn.1671-2587.2004.01.002
[10]Li X, Yu L, Luo QL, et al. Cloning and expression of hypoxanthine-xanthine-guanine phosphoribosyltransferase gene ofToxoplasmagondii[J]. J Clin Transfus Lab Med, 2007, 9(2): 97-100. DOI:10.3969/j.issn.1671-2587.2007.02.001(in Chinese)
李霞,余莉,罗庆礼,等. 弓形虫次黄嘌呤-黄嘌呤-鸟嘌呤磷酸核糖转移酶基因的克隆与原核表达[J]. 临床输血与检验,2007,9(2): 97-100. DOI:10.3969/j.issn.1671-2587.2007.02.001
[11]Li X, Yu L, Luo QL, et a1.Cloning and expression of adenosine kinase gene fromToxoplasmagondiiand preparation of its polyclonal antibodies[J]. Chin J Zoonoses, 2008, 24(6): 495-499. DOI: 10.3969/j.issn.1002-2694.2008.06.003(in Chinese)
李霞,余莉,罗庆礼,等. 弓形虫腺苷激酶基因的克隆、表达及多抗血清的制备[J]. 中国人兽共患病学报,2008,24(6): 495-499. DOI:10.3969/j.issn.1002-2694.2008.06.003
[12]Yu L, Li X, Gao YF, et al. siRNA mediate suppression of hypoxanthine-xanthine-guanine phosphoribosyltransferase expression inToxoplasmagondii[J]. Acta Universitatis Medicinalis Anhui, 2008, 43(4): 376-380. DOI:10.3969/j.issn.1000-1492.2008.04.005(in Chinese)
余莉,李霞,郜玉峰,等. siRNA抑制弓形虫次黄嘌呤-黄嘌呤-鸟嘌呤磷酸核糖转移酶的表达[J]. 安徽医科大学学报,2008,43(4): 376-380. DOI:10.3969/j.issn.1000-1492.2008.04.005
[13]Yu L, Gao YF, Qiao ZP, et al.Toxoplasmagondii: siRNA can mediate the suppression of adenosine kinase expression[J]. Exp Parasitol, 2008, 118(1): 96-102.DOI: 10.1016/j.exppara.2007.07.007
[14]Yu L, Li X, Gao YF, et al. siRNAs specific to key enzymes in the purine salvage pathway retard growth ofToxoplasmagondii[J]. Chin J Zoonoses, 2009, 25(1): 9-12. DOI:10.3969/j.issn.1002-2694.2009.01.003(in Chinese)
余莉,李霞,郜玉峰,等. siRNA干扰嘌呤补救合成途径的关键酶对弓形虫增殖的抑制作用[J]. 中国人兽共患病学报,2009,25(1): 9-12. DOI:10.3969/j.issn.1002-2694.2009.01.003
[15]Yu L, Gao YF, Li X, et al. Double-stranded RNA specific to adenosine kinase and hypoxanthine-xanthine-guanine-phosphoribosyltransferase retards growth ofToxoplasmagondii[J]. Parasitol Res, 2009, 104(2): 377-383. DOI: 10.1007/s00436-008-1208-9
[16]Wu JX, Shen JL, Luo QL, et al. Primary application of three combinated recombinant antigens to the diagnosis of suspected infection with toxoplasmosis in pregnancies [J]. J Clin Transfus Lab Med, 2008, 10(3): 239-241. DOI:10.3969/j.issn.1671-2587.2008.03.015(in Chinese)
吴君霞,沈继龙,罗庆礼,等. 重组抗原联合用于弓形虫病IgG免疫诊断的研究[J]. 临床输血与检验,2008,10(3): 239-241. DOI:10.3969/j.issn.1671-2587.2008.03.015
[17]Wang WP, Xu SQ, Xia JB. Evaluation of a kind of inner kit for detecting IgG antibody ofToxoplasmagondii[J]. Central Chin Med J, 2007, 31(3): 229-231. (in Chinese)
王维鹏,徐淑琴,夏剑波. 一种国产弓形虫IgG ELISA试剂盒的评价[J]. 华中医学杂志,2007,31(3): 229-231.
[18]Sun XD, Wang XZ, Yang S, et al. Evaluation of a kind of kit for detecting IgM antibody ofToxoplasmagondii[J]. Chin J Zoonoses, 2008, 24(10): 978-981. DOI:10.3969/j.issn.1002-2694.2008.10.023(in Chinese)
孙晓东,王学忠,杨素,等. 一种检测弓形虫IgM抗体试剂盒的评价[J]. 中国人兽共患病学报,2008,24(10): 978-981. DOI:10.3969/j.issn.1002-2694.2008.10.023
[19]He YY, Jiang SF, Ma XB, et al. Evaluation of sixteen kinds of kits inner and abroad available for detecting antibodies ofToxoplasmagondii[J]. Sci Travel Med, 2008, 14(3): 43-45. DOI:10.3969/j.issn.1006-7159.2008.03.022(in Chinese)
何艳燕,蒋守富,马杏宝,等. 国内外16种弓形虫诊断试剂盒的评估[J]. 旅行医学科学,2008,14(3): 43-45. DOI:10.3969/j.issn.1006-7159.2008.03.022
[20]Deng W, Jiang M. An indirect ELISA method of Toxo-IgG[J]. J Tainshan Med Col, 2004, 25(4): 266-269. DOI:10.3969/j.issn.1004-7115.2004.04.006(in Chinese)
邓文,姜敏. 弓形虫(TOXO)IgG抗体ELISA诊断试剂盒的研制[J]. 泰山医学院学报,2004,25(4): 266-269. DOI: 10.3969/j.issn.1004-7115.2004.04.00610.3969/j.issn.1002-266X.2004.02.006
[21]Qu X, Tang HW, Deng E, et al. Development of the reagent to diagnose TOXO-IgM[J]. Shandong Med J, 2004, 44(2): 12-14. (in Chinese)
曲迅,汤汉文,邓文,等. 弓形虫-IgM诊断试剂的研制[J]. 山东医药,2004,44(2): 12-14.
[22]Marcolino PT, Silva DAO, Leser PG, et al. Molecular markers in acute and chronic phases of human toxoplasmosis: determination of immunoglobulin G avidity by Western blotting[J]. Clin Diagn Lab Immunol, 2000, 7(3): 384-389. DOI: 10.1128/CDLI.7.3.384-389.2000
[23]Jalallou N, Bandehpour M, Khazan H, et al. Evaluation of recombinant SAG1 protein for detection ofToxoplasmagondiispecific immunoglobulin M by ELISA test[J]. Iran J Parasitol, 2012, 7(4): 17-21.
[24]Tan YJ, Yin X, Tang JM, et al. Detection of IgM antibody with recombinant antigen rSAG1 for Toxoplasmosis diagnosis[J]. Chin J Schisto Ctrl, 2004, 16(2): 133-136. DOI:10.3969/j.issn.1005-6661.2004.02.013(in Chinese)
谈永飞,印鑫,汤俊明,等.应用重组抗原(rSAG1)检测IgM抗体抗体诊断弓形虫病的研究[J]. 中国血吸虫病防治杂志,2004,16(2): 133-136. DOI:10.3969/j.issn.1005-6661.2004.02.013
[25]Si J, Tang JM, Xu M, et al. Detection of IgG antibody toToxoplasmagondiiwith rSAG1 for immunodiagnosis of Toxoplasmosis[J]. Chin J Microbiol Immunol, 2004, 24(3): 245-246. (in Chinese)
司进,汤俊明,徐明,等.重组主要表面抗原1 用于弓形体病IgG 免疫诊断的研究[J]. 中华微生物学和免疫学杂志,2004,24(3): 245-246.
[26]Aubert D, Maine GT, Villena I, et al. Recombinant antigens to detectToxoplasmagondii-specific immunoglobulin G and Immunoglobulin M in Human Sera by enzyme immunoassay[J]. J Clin Microbiol, 2000, 38: 1144-1150.
