印楝素作用分子靶标的研究
2014-04-08冉雪琴王嘉福
徐 霖,冉雪琴,王嘉福
(1.贵阳学院生物与环境工程学院, 贵州 贵阳 550005; 2.贵州大学动物科学学院, 贵州 贵阳 550025; 3.贵州大学农业生物工程省重点实验室, 贵州 贵阳 550025)
印楝素杀虫活性具有广谱、高效、低毒、易降解、无残留、无抗药性等优点,且对脊椎动物无危害,是目前最具开发潜力的植物源农药.但其作用机理复杂,作用机制还未清楚,分子机制研究尚处于起步阶段.有研究提示,细胞骨架肌动蛋白是印楝素作用的假想靶标蛋白[1],主要是因为印楝素作用于昆虫有2个最重要的特点:一是昆虫细胞较哺乳动物细胞对印楝素敏感[2],提示印楝素作用的靶蛋白是一种普遍存在但构象不同或者在2种细胞中差异表达的蛋白,有研究发现,虽然结合的氨基酸序列相似但结合后结构完全不同,因此虽然序列几乎没有不同,但印楝素被藏在了哺乳动物细胞的β-肌动蛋白口袋里而不能起作用.二是印楝素作用范围广,作用方式多变,提示印楝素作用蛋白广泛存在,细胞骨架肌动蛋白存在于一切真核细胞胞质空间中,由蛋白质纤维组成的高度动态的三维结构的网架,而且在细胞内广泛分布于细胞质及细胞核.细胞骨架肌动蛋白是否是印楝素作用的靶标分子还需要大量的验证性试验.本研究运用基因芯片技术结合Western蛋白检测技术,进一步研究印楝素作用的分子靶标,为印楝素农药的开发提供理论依据.
1 材料与方法
1.1材料
印楝素A标准品(纯度 95%,100 μg·mL-1),Sigma公司产品;果蝇S2细胞(购于武汉大学细胞典藏中心).
1.2试剂
胎牛血清(杭州四季青);Schneider昆虫细胞培养基粉剂(武汉创新生物);MTT试剂盒(南京凯基);二甲基亚砜(Amresco公司);蛋白裂解液(ShineGene); PVDF膜(Millipore公司);一抗Mouse Anti-βactin (GenScript );预染蛋白marker (Fermentas);HRP二抗(GenScript);内参一抗Goat Anti-GAPDH (GenScript);其他普通化学试剂(上海化学试剂厂分析级试剂).
1.3主要仪器
二氧化碳培养箱 (上海博讯实业有限公司医疗设备厂);倒置显微镜 (南京江南光电股份有限公司); 超净工作台(苏州净化设备有限公司);连续波长分光光度计 (美国Bio-Rad);96孔板、酶标板、玻璃匀浆器(宁波新芝DY89-1);高速离心机(湖南湘仪H1650-W);垂直板电泳转移装置(上海天能);电泳仪(北京君意JY300C);多用脱色摇床(苏州捷美SYC-2101).
1.4细胞培养
果蝇S2细胞于25~28 ℃条件下培养(无需CO2);过滤除菌细胞培养液原液在使用前添加10%灭活胎牛血清,3 d传代1次.
1.5细胞增殖检测[3]
取果蝇S2细胞,细胞计数器计数,保证细胞质量浓度为 4×104个·孔-1,接种于96孔培养板,每孔180 μL.边缘孔设立为不加细胞只加培养液的空白对照孔, 并设立阴性对照组(有细胞但不加药物),置入细胞培养箱,培养 24 h待细胞进入对数生长期,加入不同质量浓度印楝素使终质量浓度分别为0.01,0.1,0.5,1.0,2.0 mg·L-1培养,每个处理设3个重复,分别于24,48,72,96 h,每孔加入 MTT ( 5g·L-1)溶液20 μL,继续培养 4 h后中止培养 ,离心去上清,加入 150 μL二甲基亚砜溶液 ,室温下振荡器振荡 10 min,自动酶标仪比色 (波长 490 nm).测定吸光值 (A),并计算细胞存活率和细胞抑制率.
1.6基因芯片检测
经印楝素处理细胞及总RNA交由Affymetrix公司进行基因芯片检测,分别选择Affymetrix公司的Gene-Chip Drosophila®Genome 2.0 Array,包含18 500 条果蝇(Drosophila melanogaster)的基因.
1.7western蛋白检测
按常规方法完成SDS-PAGE和电转膜操作,封闭液封闭.一抗温育1.5 h,TBST清洗3次,每次5 min,HRP二抗温育1.5 h,TBST清洗4次,每次5 min.经发光、显影、定影,拍照.
1.8数据统计学分析
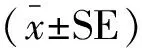
2 结果与分析
2.1印楝素处理果蝇的细胞形态变化
在光学显微镜下,果蝇S2细胞在培养瓶中呈半粘附状态,细胞均匀分布,细胞透明,边缘清晰,梭形细胞多.当用印楝素处理细胞24 h后,细胞与瓶壁之间的粘附松散,分布开始不均匀,梭形细胞少见,个别细胞体积肥大,细胞之间的联系松散,一些细胞边缘不清楚并开始皱缩,细胞透明度降低;当印楝素处理32 h后,空白组细胞梭形细胞继续增多,但药物处理组细胞几乎无梭形细胞,中期细胞明显增多.表明印楝素作用后,细胞分裂活动较弱,大部分细胞停留在分裂中期之前(图1) .
2.2印楝素处理果蝇细胞增殖检测
参考相关文献报道[3],并结合本研究小组试验[4],选用0.5 mg·L-1质量浓度印楝素对处于对数生长期的果蝇S2细胞进行处理,并每24 h检测毒理作用,各时间段细胞存活率及抑制率统计如表1所示.

图1 印楝素(0.5 mg·L-1)处理前后果蝇S2细胞图
表1存活率、抑制率统计
Table1Thestatisticofinhibitoryandsurvivalrate
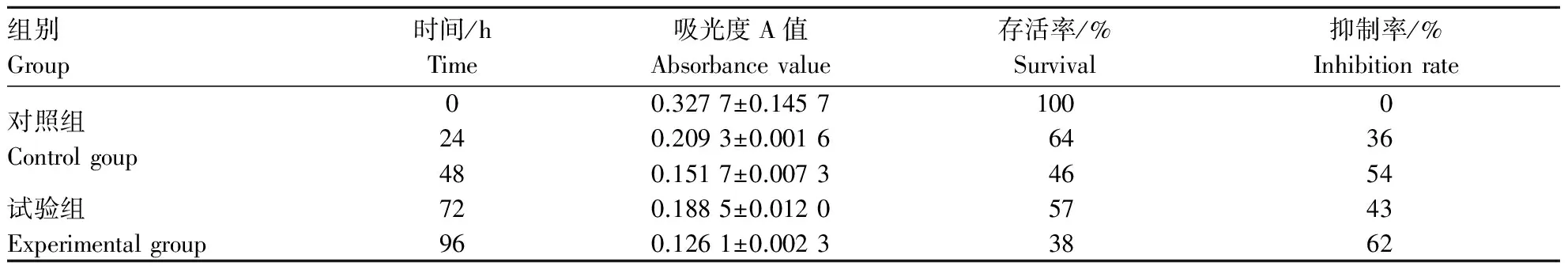
组别Group时间/hTime吸光度A值Absorbancevalue存活率/%Survival抑制率/%Inhibitionrate对照组Controlgoup00.3277±0.14571000试验组Experimentalgroup240.2093±0.00166436480.1517±0.00734654720.1885±0.01205743960.1261±0.00233862
2.3果蝇基因芯片检测
0.5 mg·L-1印楝素处理24 h并收集细胞进行基因芯片检测,检测到细胞骨架肌动蛋白以及细胞骨架肌动蛋白相关蛋白因子Act57B,Act42A,Arp14D,Arp53D,Actr13E,Act5C,Act87E均表达下调;而调控蛋白因子TSR,CNC均表达上调(表2).

表2 差异表达的细胞骨架肌动蛋白、相关蛋白及调控蛋白因子
2.4Western蛋白检测
0.5 mg·mL-1印楝素处理24,32 h并收集细胞,以GAPDH为内参,对Actin蛋白进行Western检测.检测到药物处理24 h后,印楝素处理组的β-actin表达量为对照组的93.42%;药物处理32 h后,处理组的β-actin为对照组的91.46%.药物处理后,Actin蛋白表达有较显著下调(如表3,图2).

表3 药物处理24 h及32 h actin蛋白检测结果
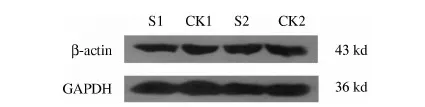
图2 SDS-PAGE胶电泳图谱
3 结论及讨论
有报道认为,印楝素A调节昆虫生长发育可能是通过调节神经蛋白/肽的释放而引起蜕皮的暂时延迟或抑制蜕皮作用[5],但放射标记试验表明,印楝素不能突破血脑屏障,但可积累分布在脑神经分泌系统纤维的周缘,对其合成或释放脑神经分泌颗粒具抑制作用.有报道认为,印楝素A在体外能抑制β-微管蛋白的聚合[6],但ANURADHA等[1]通过其他试验证实该结论存在局限性,并且印楝素作用于细胞肌动蛋白β-actin的效果要比作用于微管蛋白要明显.进一步还发现CycE,Cdc25等细胞周期蛋白和调控因子的过度表达可以修复印楝素诱导的表型异常和减少印楝素A所致的果蝇死亡.这说明印楝素A主要作用于细胞骨架肌动蛋白,引起果蝇发育异常和细胞凋亡等细胞缺陷.PRAVIN KUMAR等[7]也报道印楝素能够直接作用于细胞肌动蛋白,使肌动蛋白发生解聚,并且作用位点与细胞松弛素很接近.
细胞骨架肌动蛋白在许多细胞生命活动中扮演着非常重要的角色,包括在细胞迁移、决定细胞形状以及物质运输等.除了以上功能,肌动蛋白还参与基因转录调控:(1)参与核RNA运输、加工[8~9];(2)参与染色质集缩构建染色体的过程[10]; (3)细胞核肌动蛋白与染色质结构调整[11]; (4)在基因转录活动中亦有作用[12~13].通过基因芯片技术检测到Actin蛋白及其相关蛋白因子均表达下调,如actin 57B, actin 42A, actin5C, actin87E, actin-related13E,actin-related protein14E, actin-related protein 53D等,它们下调倍数不高,但无一例外表达下调;另外,也检测到beta-Spec(beta-Spectrin),shot(kakapo),fwd(four wheel drive)分别上调1.54478,1.81449,1.6119,它们负调控微管的聚合或解聚,调节细胞骨架微管组装;cnc(cap and collar) 主要功能是细胞骨架微管的极性建立及保持,上调2.12108.肌动蛋白的这些特征及检测到的肌动蛋白及肌动蛋白相关蛋白的因子均表达下调进一步从分子学角度论证了肌动蛋白极有可能是印楝素的靶标蛋白.
参考文献:
[1]ARITAKU L A., RAMASWAMY S, ANNADURA I. Actin cytoskeleton as a putative target of the neem limonoid Azadirachtin A[J]. Insect Bioc hemistry and Molecular Biology,2007(37):627-634
[2]REMBOLD H, ANNADURAI, R S. Azadirachtin inhibits proliferation of Sf9 cells in monolayer culture[J]. 1993(48) :495-499.
[3]张志祥,徐汉虹.利用MTT法以茼蒿素类似物对昆虫细胞毒力筛选及测定[J].华南农业大学学报,2000(21):29-32
[4]徐 霖,杨明飞.运用MTT比色法检测印楝素对果蝇S2细胞的毒力作用[J]. 河南农业大学学报,2012,46(1):72-75
[5]SMITH S L, MITCHELL M J.Effect of azadirachtin on insect cytochrome P-450 dependent ecdysone 20-monoxygenase activity[J]. Biochem Biophys Res Commun, 1998,154:559-563.
[6]SALEHZADEHA, AKHKHA A, CUSHLEY W, et al. The antimitotic effect of the neem terpenoid azadirachtin on cultured insect cells[J]. Insect Biochemistry and Molecular Biology, 2003,33:681- 689.
[7]PRAVIN KUMAR R, MANOJ M N, KUSH A.In silico approach of azadirachtin binding with actins[J]. Insect Biochemistry and Molecular Biology, 2007,37(6): 635-640.
[8]SHUMAKER D K,KUCZMARSKI E R,GOLDMAN R D.lamins and actin are major players in essential nuclear functions[J].Curr Opin Cell Biol,2003, 15:358-366.
[9]NAKAYASU H, UEDA K. Ultrastructural localizatio n of actin in nuclear matrices from mouse leukemia.L5178Y cells[J]. Cell Struct Funct ,1985, 10:305-309.
[10]KINGSTON R E, NARLIKAR G J. ATP-dependent remodeling and acetylation as regulators of chromatin fluidity[J]. Genes Dev, 1999, 13:2339-2352.
[11]COTE J, QUINN J, WOKMAN J L. Stimulation of GAL4 derivative binding to nucleosomal DNA by the yeast SWI/SNF complex[J]. Science 1994, 265:53-60.
[12]MANLEY J L, FIRE A, CANO A, et al.DNA-dependent transcription of adenovirus genes in a soluble whole-cell extract[J]. Proc Natl Acad Sci U S A, 1980, 77:3855-3859.
[13]SAUMAN I, BERRY S J.An actin infrastructure is as sociated with eukaryotic chromosomes: structural and functional significance[J]. Eur J Cell Biol,1994(64):348-356.
