高浓度营养液对黄瓜和番茄下胚轴徒长的抑制作用
2014-04-08高晓旭张志刚董春娟尚庆茂
高晓旭, 张志刚, 段 颖, 董春娟, 尚庆茂
(中国农业科学院蔬菜花卉研究所, 农业部园艺作物生物学与种质创制重点实验室,北京 100081)
黄瓜和番茄是我国主栽蔬菜种类,且多以育苗移栽为主。黄瓜和番茄育苗过程中,由于播种密度大,幼苗株间距小,当遭遇高温、高湿、弱光等不良环境,极易导致幼苗茎和下胚轴过度伸长,形成徒长苗。徒长苗既不适于机械化作业,而且耐逆性、抗病性差,定植后成活率低,严重影响后期丰产性[1-2]。为了控制幼苗徒长,国内外研究了植物生长调节剂、机械刺激、补光、温度调节、水分控制等多种调控方法,取得了一定应用效果[3-6]。然而,控制幼苗徒长是一个多因素综合作用的过程,实际操作中调控不当的情况多有发生。如植物生长调节剂受蔬菜种类、幼苗发育阶段和环境因子的影响较大,容易造成调控失效,或因控制过度致使幼苗定植后难以恢复生长[4];补光和温度调节等方法增加能耗,并且需要较长处理周期才能见效;机械刺激调控法需要特定工具和劳力,也容易对幼苗造成机械损伤[7]。因此,有必要进一步研究开发操作简易、成本低、处理周期短、效果稳定的幼苗徒长制御方法。Hoagland营养液是国际公认的完全营养液,国内外也常用于黄瓜、番茄育苗。目前尚未见到利用营养液浓度调控黄瓜和番茄幼苗下胚轴徒长的相关报道。本试验设计系列浓度的Hoagland营养液,研究营养液浓度对黄瓜和番茄幼苗下胚轴细胞长度和生长速率的影响,并探讨下胚轴细胞伸长与内源激素含量的相互关系,可望为有效制御黄瓜和番茄幼苗下胚轴徒长提供理论与实践依据。
1 材料与方法
1.1 试验材料
1.2 试验设计
试验以Hoagland营养液标准配方为基础浓度(1.0C),即每升Hoagland标准营养液含Ca(NO3)2·4H2O 945 mg,KNO3607 mg,NH4H2PO4115 mg,MgSO4241 mg,再通过成比例增减上述各组分的用量,形成0.5C、2.5C、5.0C、7.5C、10.0C和12.5C 6个不同浓度的营养液处理。微量元素全部采用Arnon营养液配方,即每升Hoagland标准营养液中含微量元素EDTA-2NaFe 14.5 mg,H3BO31.43 mg,MnSO4·H2O 0.81 mg,ZnSO4·7H2O 0.11 mg,CuSO4·5H2O 0.04 mg,(NH4)6Mo7O24·4H2O 0.01 mg。幼苗出苗后,立即灌施不同浓度的营养液,并测定各处理基质的电导率EC值分别为0.46、2.08、3.58、6.73、8.08、9.68 dS/m,与营养液浓度呈线性相关(r=0.9938)。
首次灌施量为基质饱和含水量的3倍,此后每隔2 d灌施1次至基质饱和含水量的2倍。以灌施0.5C Hoagland营养液为对照,其余浓度为处理组,每处理3次重复,每重复60株,完全随机区组排列。具体操作方法为:1)待黄瓜子叶平展时(播种后13 d)和番茄子叶平展时(播种后16 d),取材并测定不同营养液下生长的幼苗形态指标;选取生长一致的幼苗,分别切取下胚轴、子叶和根系,用于细胞形态观察和内源激素含量测定。2)待黄瓜第一片真叶平展时(播种后18 d)和番茄第一片真叶平展时(播种后20 d),对各处理幼苗进行生长恢复处理,先采用4倍于基质饱和含水量的0.5C营养液充分灌施,此后每日以2倍于基质饱和含水量的0.5C营养液灌施。待黄瓜幼苗恢复处理8 d,以及番茄幼苗恢复处理11 d,进行幼苗株高、茎粗、地上部干鲜重、根体积以及根干鲜重等形态指标测定。
1.3 测定方法
1.3.1 根际EC值的测定 风干基质与去离子水以1 ∶2(v/v)的比例浸提,用DDSJ-308A 电导仪直接测定滤液的EC值。
1.3.2 幼苗形态指标的测定 幼苗鲜重和干重采用称重法测定。每处理每重复随机取样3株,将幼苗根系冲洗干净后用吸水纸擦干,茎叶和根分别称鲜重后放入烧杯中,105℃杀青30 min,80℃烘干并称干重。下胚轴长度、子叶长度采用直尺测量。下胚轴含水量(WC,%)=(植物鲜重-植物干重)/(植物鲜重)×100;下胚轴绝对生长速率(AGR, cm/d)=下胚轴长度的绝对生长量/时间。
1.3.3 幼苗内源激素含量的测定 每处理每重复中选取大小相近的幼苗,分别取子叶、下胚轴和根0.2 g,迅速用液氮冻存样品。IAA、GA3、ZR、ABA在中国农业大学作物化学控制中心采用间接酶联免疫吸附(ELISA)法[8]测定,酶标仪为Thermo Multiskan MK3型。
1.3.4 细胞形态学观测 采用石蜡切片—显微观测法:幼苗经去离子水洗净后,下胚轴中部切取5 mm,FAA固定,常规石蜡制片,番红—固绿对染,切片厚度为10 μm,5%明胶粘片,阿拉伯树胶封片,蔡司Axioskop 40型显微镜下拍照并统计细胞长度。
1.4 数据统计与分析
对原始数据进行标准化或归一化处理后,用Excel和DPS(Data Processing System)软件进行数据统计、分析及作图。
2 结果与分析
2.1 高浓度营养液对黄瓜和番茄幼苗生长的影响
高浓度营养液灌施后,黄瓜和番茄幼苗生长均受到明显抑制(图1A、B),特别是5.0C以上的处理,幼苗生长几乎完全停滞。随着根际EC值的升高,黄瓜和番茄的下胚轴长度、绝对生长速率和含水量均呈下降趋势(表1)。在10.0C时下胚轴长度仅为0.5C时的52%和42%,绝对生长速率下降了58%和48%。在高浓度营养液持续灌施处理结束后,对黄瓜和番茄幼苗进行0.5C营养液恢复处理8 d和11 d,观察幼苗恢复生长状况并测定幼苗生长指标(图1C、D,表2)。试验表明,0.5C营养液对5.0C和7.5C处理的幼苗的地上部和地下部均有恢复生长的作用,且幼苗株高/茎粗比明显优于对照和其它处理,避免了幼苗徒长。恢复处理对2.5C处理幼苗促生效果明显,但同时也造成地上部的徒长;恢复处理对10.0C和12.5C处理幼苗地上部的茎伸长促生效果不明显,仍保持恢复处理前的抑制效果,以黄瓜为例,株高仅为对照的35%和27%(表2)。

图1 不同浓度营养液对黄瓜和番茄生长的影响Fig.1 Effects of different strength nutrient solution on growth of cucumber and tomato seedlings
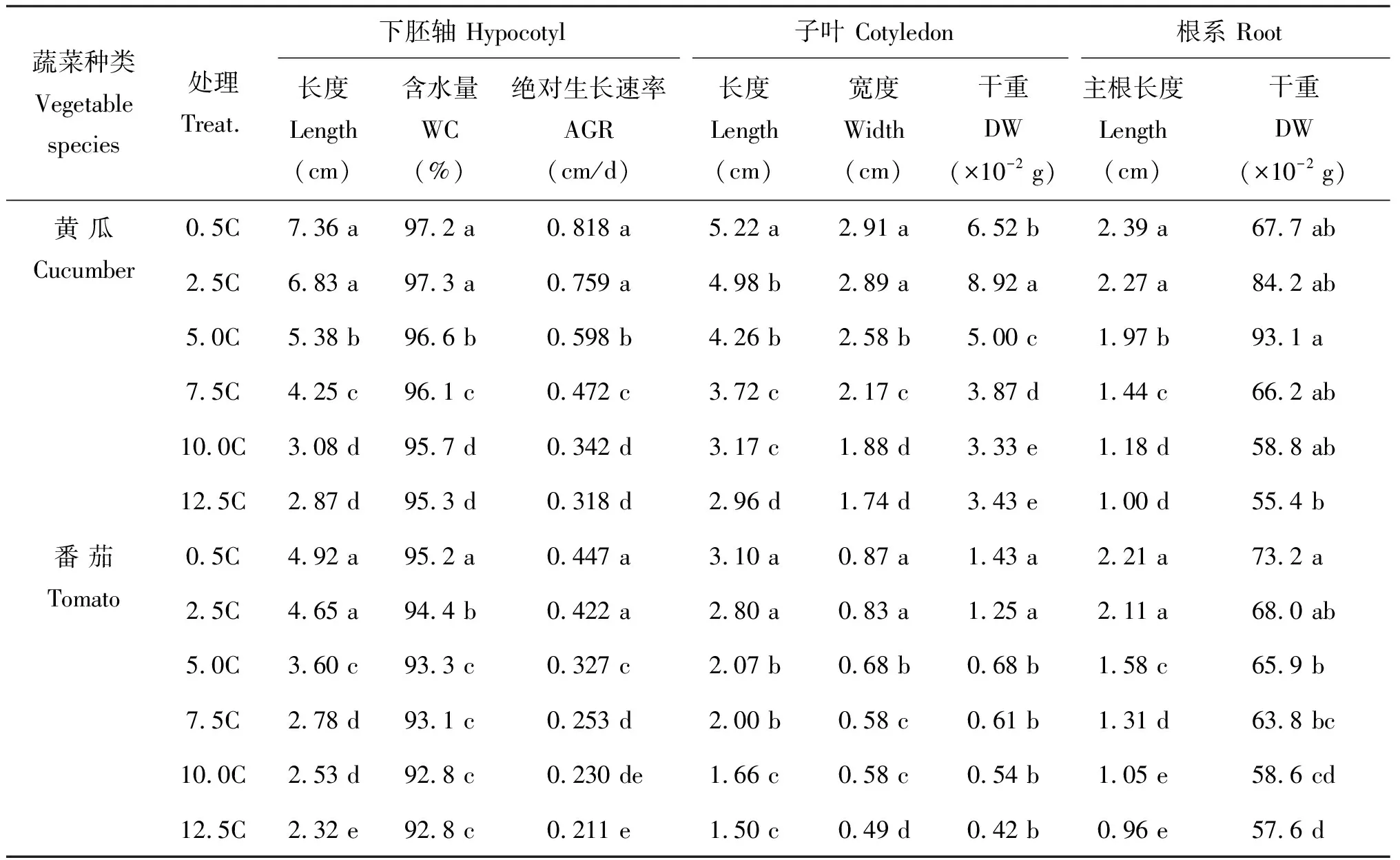
表1 不同浓度营养液对黄瓜和番茄幼苗生长参数的影响
2.2 高浓度营养液对黄瓜和番茄幼苗下胚轴细胞形态的影响
为了进一步确定下胚轴伸长速率下降的原因,对黄瓜和番茄幼苗的下胚轴细胞进行形态学观察和统计。如图2所示,随着营养液浓度的升高,下胚轴皮层薄壁细胞的轴向长度逐渐减小,径向长度呈现先增加再减小的趋势。表3表明,皮层薄壁细胞轴/径向生长的长度比值显著降低,当营养液浓度大于5.0C以上,各处理与0.5C处理相比达到显著差异,在10.0C时皮层薄壁细胞长度缩短至0.5C的49%和48%。

图2 不同浓度营养液对番茄幼苗下胚轴皮层细胞形态的影响Fig.2 Effects of different strength nutrient solution on cortical cell in hypocotyls of tomato seedlings
2.3 高浓度营养液对黄瓜和番茄幼苗内源激素含量的影响及相关性分析
幼苗下胚轴生长过程受到内源激素的调控,分别测定了子叶平展期的黄瓜和番茄下胚轴脱落酸(ABA)、生长素(IAA)、赤霉素(GA3)和玉米素(ZR)4种内源激素的含量。表4所示,与0.5C相比,5.0C处理使黄瓜和番茄ABA含量在各组织中整体升高,GA3和ZR含量整体降低。特别是在下胚轴中,ABA含量分别在黄瓜和番茄中升高了1.5和2.0倍,而GA3含量却在黄瓜和番茄中降低了50%和44%。在12.5C处理下,黄瓜和番茄下胚轴的ABA含量升高了2.0和3.0倍,而ZR含量分别下降了43%和64%。IAA含量在黄瓜和番茄中的变化趋势不同,在黄瓜中,当灌施营养液浓度升高,IAA含量呈现先升高再回落的趋势;在番茄中,当灌施营养液浓度大于5.0C时,下胚轴IAA含量均显著高于0.5C处理下的IAA含量,总体上呈现升高趋势。
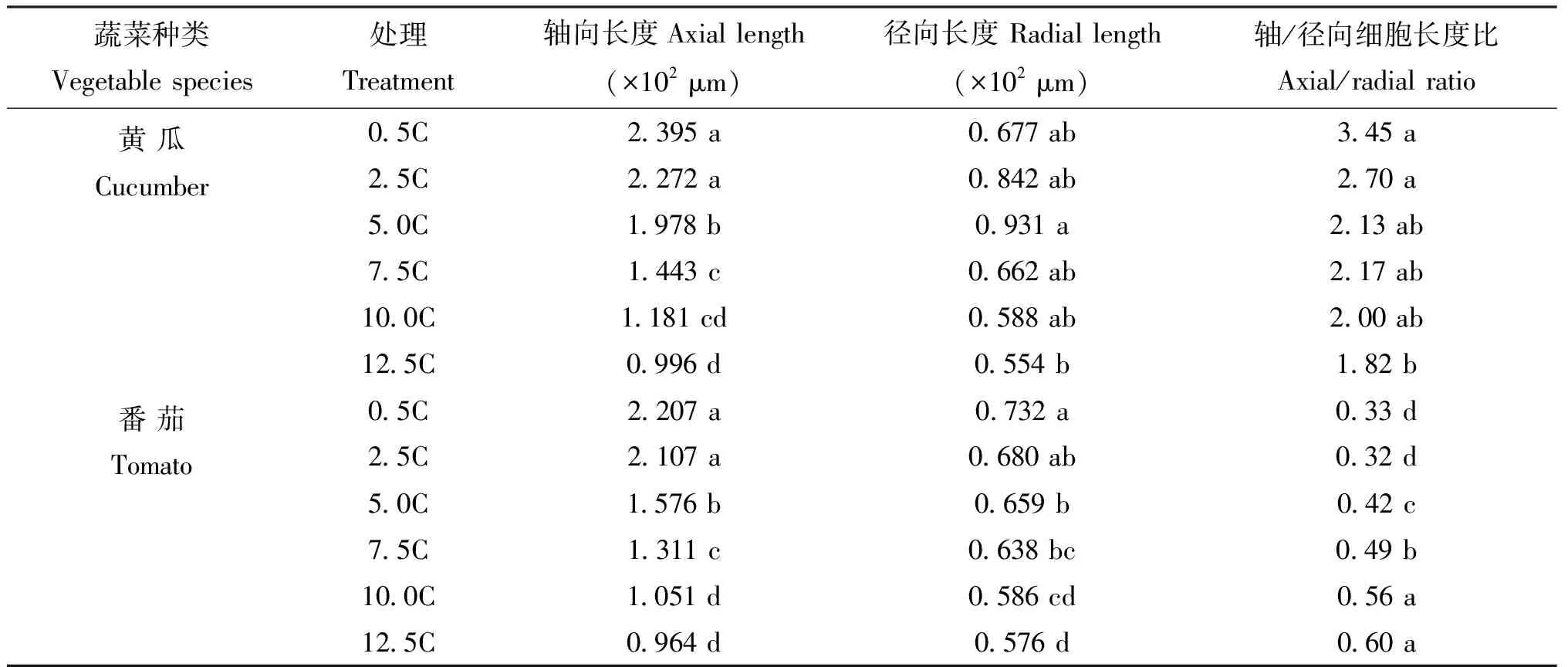
表3 不同浓度营养液对黄瓜和番茄幼苗下胚轴细胞长度的影响
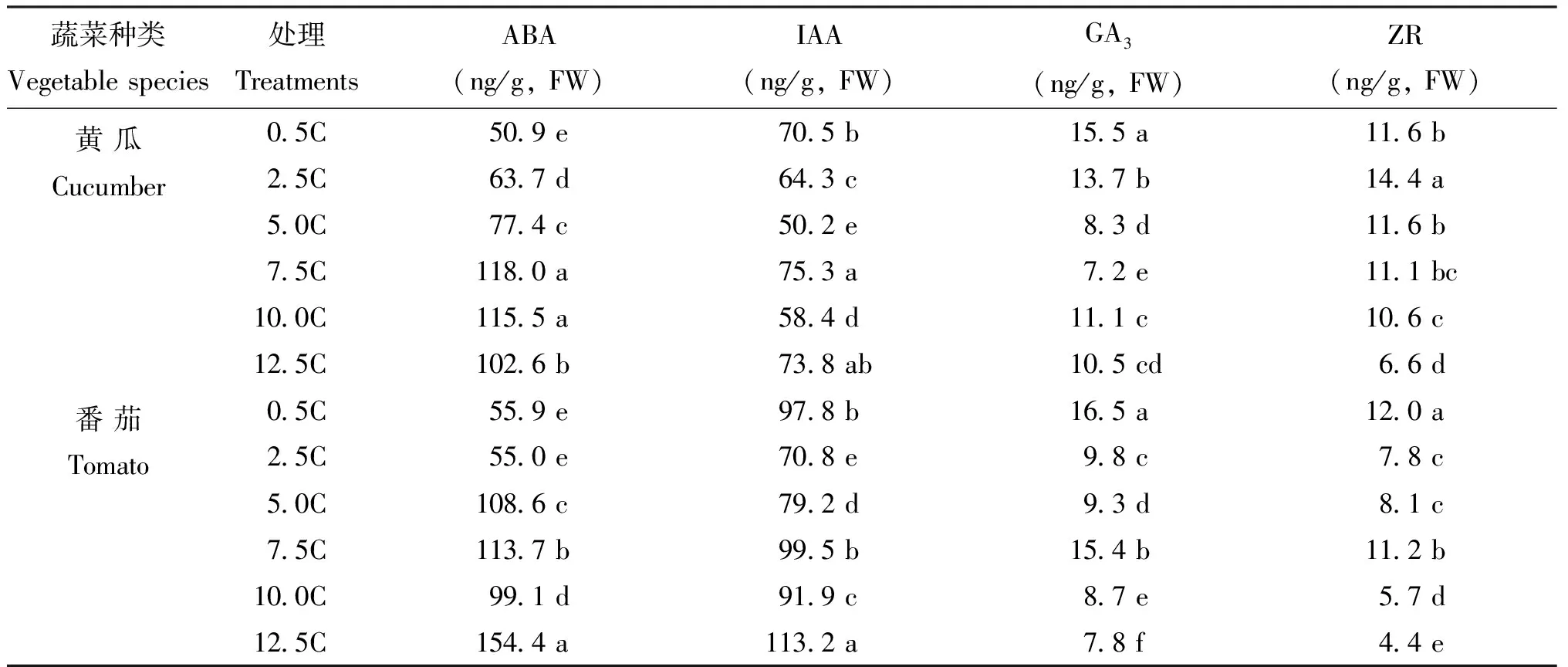
表4 不同浓度营养液对黄瓜和番茄幼苗下胚轴激素含量的影响
对幼苗下胚轴、子叶和根系的激素含量与下胚轴长度作相关分析(表5)。可以看出,ABA含量对下胚轴长度的影响最大,在黄瓜中相关系数达到-0.91、-0.91和-0.91,在番茄中相关系数达到-0.87、-0.85和-0.93,均呈显著相关;而幼苗各组织IAA、GA3、ZR含量与下胚轴长度之间都没有达到显著相关。对IAA/ABA、GA3/ABA和ZR/ABA与下胚轴长度作相关分析,发现除子叶外,下胚轴和根系的GA3/ABA和ZR/ABA 均与下胚轴长度呈显著(或极显著)正相关,这说明幼苗各组织的脱落酸含量对下胚轴长度起到决定性作用。
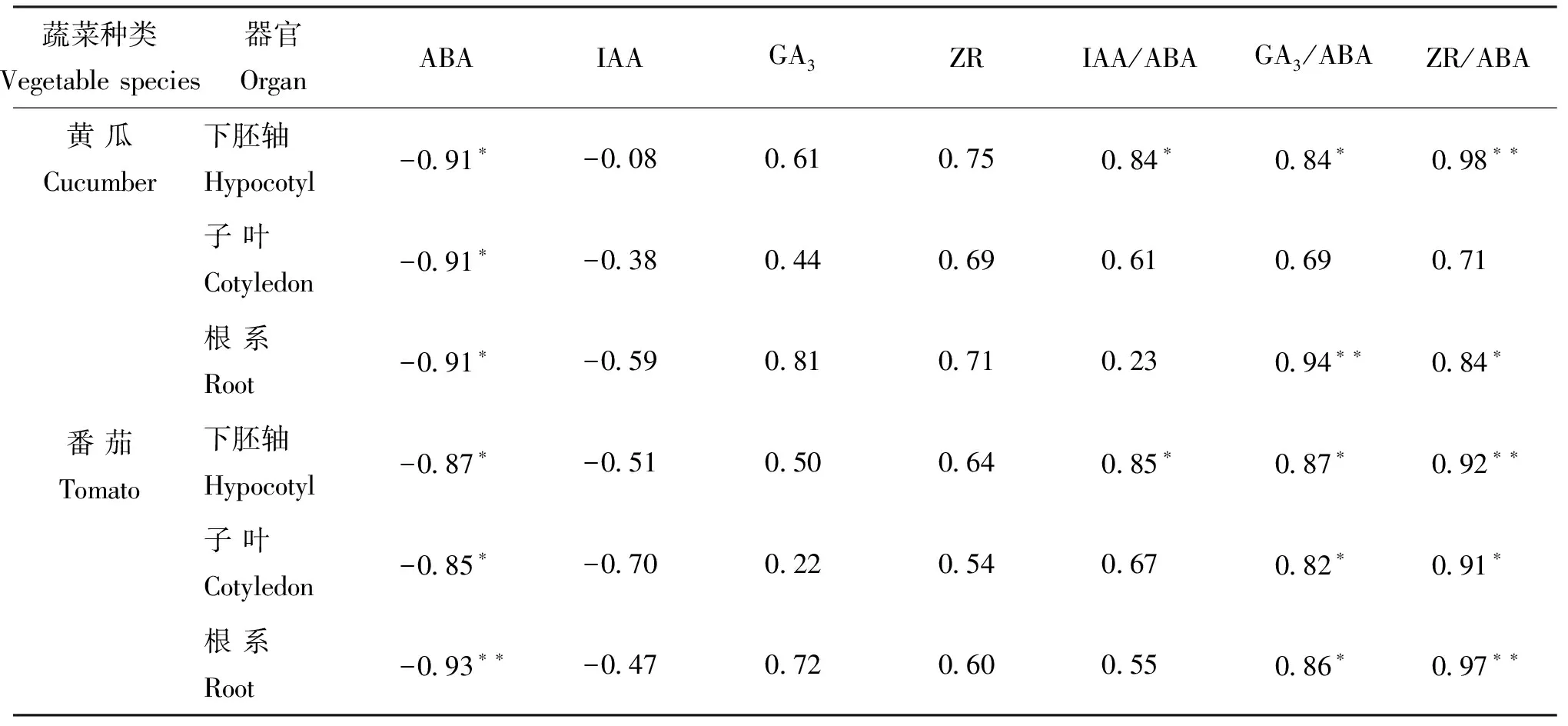
表5 黄瓜和番茄下胚轴长度与其激素含量相关性分析
3 讨论与结论
研究如何制御黄瓜和番茄幼苗下胚轴徒长具有重要的实践意义。研究表明,根际可溶性盐含量升高会造成离子胁迫和渗透胁迫,影响幼苗生长[9]。近年来,在番茄等研究中发现,通过灌施较高浓度的KCl或NaCl溶液,能有效抑制幼苗下胚轴徒长[10-11],但由于单盐毒害,严重妨碍植株正常生理代谢和生长发育[12-13]。本试验所采用Hoagland营养液含有全部植物生长发育必需的营养元素,且各元素之间保持良好的平衡关系,可有效避免单盐毒害。试验结果显示,高浓度营养液提高了黄瓜和番茄幼苗生长基质电导率,使幼苗下胚轴长度和绝对生长速率降低,有效控制了幼苗徒长。当营养液浓度恢复至正常时,幼苗生长状况得到了不同程度的恢复,且对幼苗株型调控较佳的组合为先用5.0C和7.5C的营养液浇施,再用0.5C的营养液浇施。该组合对幼苗的地上部和地下部均有恢复生长的作用,且幼苗株高/茎粗比明显优于对照和其它处理,一定程度上避免了幼苗徒长的发生,具有很强的生产实践价值。
关于根际可溶性盐如何抑制幼苗生长的作用机制,一些研究认为,根际EC值升高使细胞渗透势发生变化,改变植物内源激素含量[14-16],通过影响细胞壁的可塑性和细胞微管排列方向,从而调控细胞生长[17]。本试验中,高浓度营养液灌施使幼苗基质EC值升高,降低了幼苗下胚轴GA3和ZR含量,提高了ABA含量。进一步分析各种激素含量与幼苗下胚轴长度的相关性,发现只有ABA含量与下胚轴长度达到极显著相关水平,说明ABA含量在高浓度营养液抑制幼苗下胚轴生长的过程中起到决定性作用。ABA可通过降低纤维素合成酶、果胶酯酶、细胞膨胀素等基因的表达,从而抑制细胞初生壁的松弛和扩张[18]。ABA也能对生长素和赤霉素等促细胞伸长的激素产生拮抗效应,并通过调节微管(microtubule,MT)分布方向来影响细胞骨架[19],导致下胚轴细胞的细胞壁可塑性和细胞膨压降低,下胚轴皮层细胞的伸长生长速率减缓,最终表现为下胚轴生长受到抑制。与GA3、ZR和ABA三种激素的变化方式不同,生长素(IAA)含量在不同浓度营养液处理下呈现区位性变化特征,这可能是由于在下胚轴长度的调控过程中,IAA与GA3、 ZR等其他激素存在相互依赖或拮抗的复杂关系[20]。
本研究表明, 高浓度营养液通过改变幼苗内源激素的动态平衡,特别是促进ABA的合成和积累,从而抑制幼苗下胚轴细胞伸长生长。灌施高浓度营养液对黄瓜、番茄幼苗下胚轴伸长的抑制作用可以通过降低营养液浓度而得到解除,这种防治幼苗徒长的操作方法简便易行,具有潜在的应用前景,但在不同品种蔬菜的幼苗生长过程中,最优化的营养液施用浓度及其影响机制尚需进一步研究。
参考文献:
[1] 明村豪, 蒋芳玲, 胡宏敏, 等. 幼苗徒长程度对黄瓜植株生长发育及产量品质的影响[J]. 中国蔬菜, 2011, (4):29-34.
Ming C H, Jiang F L, Hu H Metal. Effects of different leggy extent seedlings on cucumber growth, yield and quality[J]. China Vegetables, 2011, (4):29-34.
[2] 王学文, 王玉珏, 付秋实, 等. 弱光逆境对番茄幼苗形态、生理特征及叶片超微结构的影响[J]. 华北农学报, 2009, 24(5):144-149.
Wang X W, Wang Y Y, Fu Q Setal. Effects of low light stress on morphological trait, physiological characters and leaf ultrastructure of tomato(LycopersiconesculentumL.)seedlings[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(5):144-149.
[3] 徐磊, 蒋芳玲, 吴震, 等. 基质含水量和光照度对不结球白菜生长及品质的影响[J]. 江苏农业学报, 2009, 25(4):865-870.
Xu L, Jiang F L, Wu Zetal. Effects of substrate water content and light intensity on growth and quality of non-heading Chinese cabbage[J]. Jiangsu Journal of Agricultural Science, 2009, 25(4):865-870.
[4] Garner L C, Björkman T. Using impedance for mechanical conditioning of tomato transplants to control excessive stem elongation[J]. Hort Science, 1997, 32(2):227-229.
[5] 郭永芳, 林多, 陈宁, 杨延杰. BR与CCC对夏秋季穴盘番茄苗质的影响[J]. 中国农学通报, 2010, 26(2):105-108.
Guo Y F, Lin D, Chen N, Yang Y J. Effects of BR and CCC on tomato plug-seedling quality in summer and autumn[J]. Chinese Agricultural Science Bulletin, 2010, 26(2):105-108.
[6] 尹敬芳, 陈凤玉, 李建强, 等. 烯效唑浸种处理对番茄幼苗生长及其生理性状的影响[J]. 中国农业大学学报, 2004, 9(2):8-11.
Yin J F, Chen F Y, Li J Qetal. Effects of seed soaking with uniconazole on the growth and physiological characters of tomato seedlings[J]. Journal of China Agricultural University, 2004, 9(2):8-11.
[7] Garner L C, Björkman T. Mechanical conditioning for controlling excessive elongation in tomato transplants:sensitivity to dose, frequency, and timing of brushing[J]. Journal of American Society for Horticultural Science, 1996, 121(5):894-900.
[8] 李宗霆, 周燮. 植物激素及其免疫检测技术[M]. 南京:江苏科学技术出版社, 1996.
Li Z T, Zhou X. Plant hormone and immunoassay technique[M]. Nanjing:Jiangsu Science and Technology Press, 1996.
[9] Zhu J K. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology, 2002, 53:247-273.
[10] Albacete A, Ghanem M E, Martínez Andújar Cetal. Hormonal changes in relation to biomass partitioning and shoot growth impairment in salinized tomato (SolanumlycopersicumL.) plants[J]. Journal of Experimental Botany, 2008, 59(15):4119-4131.
[11] Lovelli S, Scopa A, Michele Petal. Abscisic acid root and leaf concentration in relation to biomass partitioning in salinized tomato plants[J]. Journal of Plant Physiology, 2012, 169(3):226-233.
[12] 吕杰, 王秀峰, 魏珉, 等. 不同盐处理对黄瓜幼苗生长及生理特性的影响[J]. 植物营养与肥料学报, 2007, 13(6):1123-1128.
Lv J, Wang X F, Wei Metal. Effect of different salt treatments on growth and physiological characteristics of cucumber seedlings[J]. Plant Nutrition and Fertilizer Science, 2007, 13(6):1123-1128.
[13] 张海军, 张娜, 杨荣超, 等. NaCl胁迫对茄子幼苗生长和K+、Na+、Ca2+分布的影响及耐盐机制[J].中国农业大学学报, 2013, 18(4):77-83.
Zhang H J, Zhang N, Yang R Cetal. Growth, ion distribution and salt-tolerance mechanism of eggplant seedlings under salt stress[J]. Journal of China Agriculture University, 2013, 18(4):77-83.
[14] Pérez-Alfocea F, Albacete A, Ghanem M E, Dodd A I. Hormonal regulation of source-sink relations to maintain crop productivity under salinity:a case study of root-to-shoot signaling in tomato[J]. Functional Plant Biology, 2010, 37(7):592-603.
[15] 卢巧梅, 张兰, 陈天文, 等. 液相色谱-串联质谱分析盐胁迫下植物激素的含量变化[J]. 中国科学(B辑:化学), 2009, 39(8):785-792.
Lu Q M, Zhang L, Chen T Wetal. Content change of endogenous plant hormones under salt stress by liquid chromatography-tandem mass spectrometry[J]. Science in China, Series B:Chemistry, 2009, 39(8):785-792.
[16] Teruaki T, Zhu J K, Kazuo Setal. Comparative genomics in salt tolerance between Arabidopsis and Arabidopsis-related halophyte salt cress using Arabidopsis microarray[J]. Plant Physiology, 2004, 135(3):1697-1709.
[17] Wu Y J, Jeong B R, Fry S C, Boyer J S. Change in XET activities, cell wall extensibility and hypocotyl elongation of soybean seedlings at low water potential[J]. Planta, 2005, 220(4):593-601.
[18] Gimeno-Gilles C, Lelièvre E, Viau Letal. ABA-mediated inhibition of germination is related to the inhibition of genes encoding cell-wall biosynthetic and architecture:modifying enzymes and structural proteins inMedicagotruncatulaembryo axis[J]. Molecular Plant, 2009, 2(1):108-119.
[19] Shibaoka H. Plant hormone-induced changes in the orientation of cortical microtubules:alterations in the cross-linking between microtubules and the plasma membrane[J]. Annual Review of Plant Biology, 1994, 45(1):527-544.
[20] Pernisová M, Klíma P, Horák Jetal. Cytokinins modulate auxin-induced organogenesis in plants via regulation of the auxin efflux[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9):3609-3614.
