模拟人工湿地中硫酸盐氯霉素处理对细菌数量、湿地酶活性和生化作用的影响
2014-04-08孙雪姣徐婷婷叶海冬都李萍章晓凝张崇邦
孙雪姣, 徐婷婷, 叶海冬, 都李萍, 应 杰, 章晓凝, 李 鑫, 张崇邦
(浙江省台州学院生命科学学院, 浙江椒江 318000)
细菌群落在调节碳、氮和磷循环,以及污染物在人工湿地中的滞留和去除中发挥着重要的作用[1-2]。因而几乎从人工湿地技术开始兴起之时,细菌便被看作是该技术的支撑基石[3]。
在一些特殊的废水如医疗废水中,许多微生物抑制剂如杀虫剂和杀细菌剂与其它污染物共存[4],因此在废水处理过程中由于抑制剂的作用导致细菌等微生物丧失是不可避免的。同时在人工湿地基质中,一些酶如葡萄糖苷酶、转化酶、纤维素酶、蛋白酶、脲酶和磷酸酶主要来自于细菌的分泌[5]。另外,一些物质转化过程如污染物的降解与转化(氨化、硝化、反硝化、厌氧氨氧化等)也主要是由细菌驱动的[6-7]。所以细菌丧失可能会对人工湿地基质中的酶活性以及一些重要的物质转化过程产生影响。然而到目前为止,由于在人工湿地中微生物群落之间的相互作用相当复杂,所以细菌丧失最优先地影响哪些酶的活性或物质转化过程尚不清楚。
目前,通过利用一些窄谱性抗生素如链霉素等有选择性地从环境中去除某一类微生物已成为估测具体微生物群功能的一个重要研究手段[8]。例如Beare等[9]发现当硫酸链霉素应用于土壤后,凋落物的降解速率有明显的下降。Austin等[10]将三氯甲基吡啶应用于土壤中,结果发现土壤的硝化作用有效地降低了。总之选择性抑制是一种研究微生物群在土壤等环境中发挥具体功能的重要手段。
为了估测人工湿地中细菌在调节酶活性和生化过程中的作用,本研究构建了30个垂直流模拟人工湿地系统,以硫酸盐链霉素作为细菌抑制剂,调查人工湿地中,哪些酶活性或生化作用随硫酸链霉素浓度的增加而优先被抑制,进而为了解细菌在人工湿地废水净化过程中所发挥的作用提供依据。
1 材料与方法
1.1 研究地区水热条件

1.2 湿地构造和运行方式
本文的湿地类型为垂直流模拟人工湿地系统,每个模拟湿地单元用PVC管构建,每个单元具体维数为直径为0.16 m,高为1.2 m,容积为0.02 m3。填料自上而下分别包括细砂层(1—2 mm)、粗砂层(6—12 mm)和鹅卵石层(50—120 mm)三层,其中细砂层的铺设高度为0.40 m,粗砂层为0.30 m,鹅卵石层为0.20 m。细砂层上部保留30 cm以便灌水。另外在细砂层30 cm处安装侧壁管(直径 = 6.5 cm)1个,以便样品采集。湿地栽培植物为香附子 (CyperusrotundusL.)。
废水为养猪场排出液,灌溉方式为间歇式进水,废水载荷量为0.01 m3/单元湿地,废水的滞留时间为7 d,排空时间为0.5 d。湿地运行期间,每天均要检查植物生长情况和水量情况,如有其它植物入侵或水面高度由于蒸发降低,应随时剔除植物和补充水量。
1.3 硫酸链霉素抑菌处理
以未处理的湿地为对照(0 mg/kg),设置硫酸链霉素5个浓度处理,分别为1.0、 1.5、 2.0、 2.5、 3.0 mg/kg填料,每个浓度均重复5个湿地单元。
1.4 样品采集与测定
在每个湿地中,从侧壁管收集细砂样品(500g),马上过2 mm筛。每份筛好的样品装入塑料袋内,做好标记,运回实验室,保存于4℃保鲜柜中。
1.4.1 细菌数量分析 不同处理浓度下细菌数量的测定采用稀释平板法[12]。首先将每个沙子样品用无菌生理盐水(0.85%的NaCl溶液)稀释到10-6,制成沙子悬液。然后将10-6沙子悬液接种到牛肉膏-蛋白胨平板培养基中,并倒置培养在37℃的恒温培养箱中。24h培养结束后,对平板上的细菌菌落进行计数,最后换算成每克沙子中的细菌个数。
1.4.2 酶活性分析 CMC纤维素酶、蔗糖酶、β-葡糖糖苷酶、蛋白酶、脲酶、硝酸还原酶和酸性磷酸酶活性的测定分别采用蒽酮比色、磷钼酸比色、P-硝基酚比色、Folin-Ciocalteu’s酚比色、奈氏比色、 磺胺-萘基乙二胺盐酸盐比色和P-硝基苯磷酸钠比色法进行。具体测定步骤详见许光辉和郑洪元推荐的方法[12]。
1.4.3 生化作用指标分析 生化作用包括纤维素降解作用、氨化作用、硝化作用、反硝化作用、有机磷降解作用和无机磷转化作用。纤维素降解作用采用埋布片法测定,其它指标的测定主要采用室内土壤培养法[11]。
试验数据均采用SPSS 11.5统计软件进行分析。
2 结果与分析
2.1 硫酸链霉素处理浓度对湿地细菌数量和酶活性的影响
为了验证硫酸链霉素处理对湿地细菌的抑制作用,首先测定了各处理浓度湿地中的细菌数量。从图1可以看出,随着链霉素浓度的增大,细菌数量的平均值(即盒子的中线)显著下降(P<0.05),表明链霉素处理对细菌有明显的抑制效果。
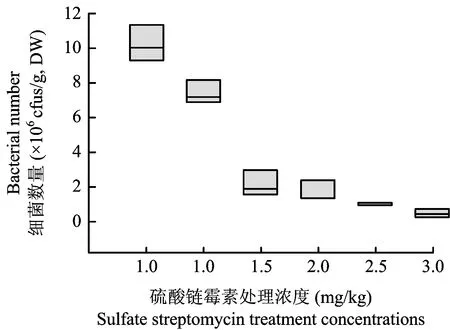
图1 硫酸链霉素处理浓度与细菌数量的关系Fig.1 The relationships between sulfate streptomycin treatment concentration and bacterial number

图2 硫酸链霉素处理浓度与纤维素分解酶、葡萄糖苷酶和蛋白酶活性的关系Fig.2 Relationships between sulfate streptomycin treatment concentrations and cellulose, glucosidase and protease activities
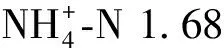
2.2 硫酸链霉素处理浓度对湿地主要生化反应的影响

2.3 湿地酶活性和生化作用的主成分分析
主成分分析(PCA)是一种降维统计方法,以所有原始参数为自变量,进行多元线性回归分析,将所得到的因变量称作主成分,如此进行多次回归分析后,可以得到若干个主成分,但每个主成分所反映的原始参数的综合信息量各不相同。一般将反映信息量(即贡献率)最大的主成分称作第一组分(PC1),其次称作第二组分(PC2)。因而为了进一步了解上述7种酶活性总体变化对硫酸盐链霉素处理浓度的区分能力,对7种酶活性活性数据进行了主成分分析,结果(图5)表明,沿着横坐标轴的正方向(PC1在反映酶活性总体变化方面的贡献率为38.2%),7种酶活性在主成分PC1上的分值载荷将6个处理明显地分为两组, 有硫酸盐链霉素处理的湿地(5个处理梯度)归为一组,而没进行硫酸盐链霉素处理的湿地则独立成另一组。不同浓度硫酸盐链霉素处理的湿地之间没有分开。主成分矩阵表明,上述这种归类的产生主要与酸性磷酸酶活性有关(r= 0.885), 其次是蔗糖酶活性(r=-0.726)和硝酸盐还原酶活性(r=0.721)。
类似于酶活性的分析,对6种生化作用也进行了主成分分析(图6)。在PCA的分析结果中,前两个主成分对生化作用总体变化的贡献率分别为45.5%和18.6%。不同于酶活性的PCA,沿着横坐标轴的正方向主成分PC1上的分值载荷将6个处理明显地分为三组:硫酸盐链霉素处理浓度3.0 mg/kg的湿地归为一组,处理浓度1.0、 1.5、 2.0和2.5 mg/kg的湿地归为另一组,而没进行硫酸盐链霉素处理的湿地则独立一组。主成分矩阵表明上述这种归类的产生主要与反硝化作用(r=0.926)和硝化作用(r=0.815)的变化有关,其次是有机磷降解作用(r=-0.795)和氨化作用(r=0.689)。
3 讨论
类似于土壤,人工湿地填料中的酶也是一种生物催化剂,其主要功能是加速人工湿地有机与无机化合物的降解和转化[12]。酶主要来自于土壤微生物、动物细胞和植物根系的分泌以及生物细胞自溶后的释放[13]。纤维素分解酶、葡萄糖苷酶和蛋白酶主要催化纤维素、葡萄糖苷和蛋白质的降解,而脲酶、硝酸盐还原酶和酸性磷酸酶主要催化尿素、硝酸盐和有机磷化合物的转化和降解[12]。在本研究中,随着链霉素浓度逐渐提高,细菌数量受到抑制,脲酶、硝酸盐还原酶和酸性磷酸酶活性显著下降,纤维素分解酶、蛋白酶和葡萄糖苷酶活性无明显变化,表明脲酶、硝酸盐还原酶和酸性磷酸酶的来源和数量主要由细菌所控制,纤维素分解酶、蛋白酶和葡萄糖苷酶可能由于其是非细菌来源[14],对细菌数量的改变没有反应。
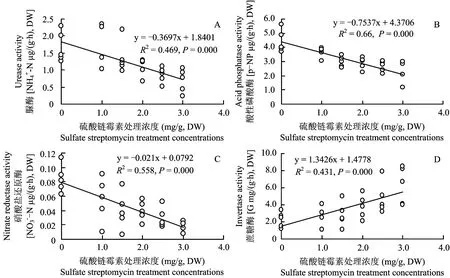
图3 硫酸链霉素处理浓度与脲酶、硝酸盐还原酶、酸性磷酸酶和蔗糖酶活性的关系Fig.3 Relationships between sulfate streptomycin treatment concentration and invertase, urase, acid phosphatase and nitrate reductase activities
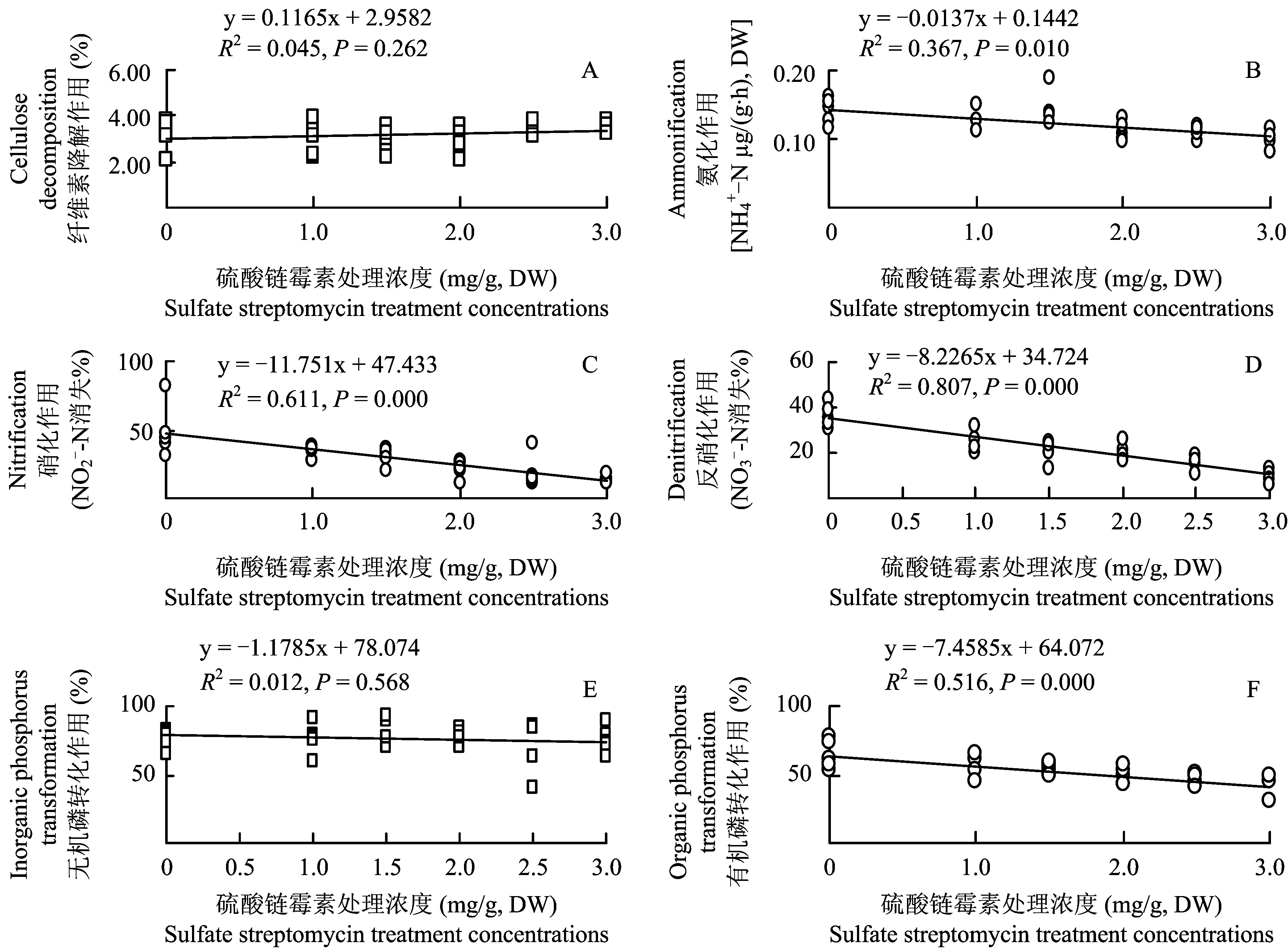
图4 硫酸链霉素处理浓度与生化作用的关系Fig.4 Relationships between sulfate streptomycin treatment concentration and biochemical transformations
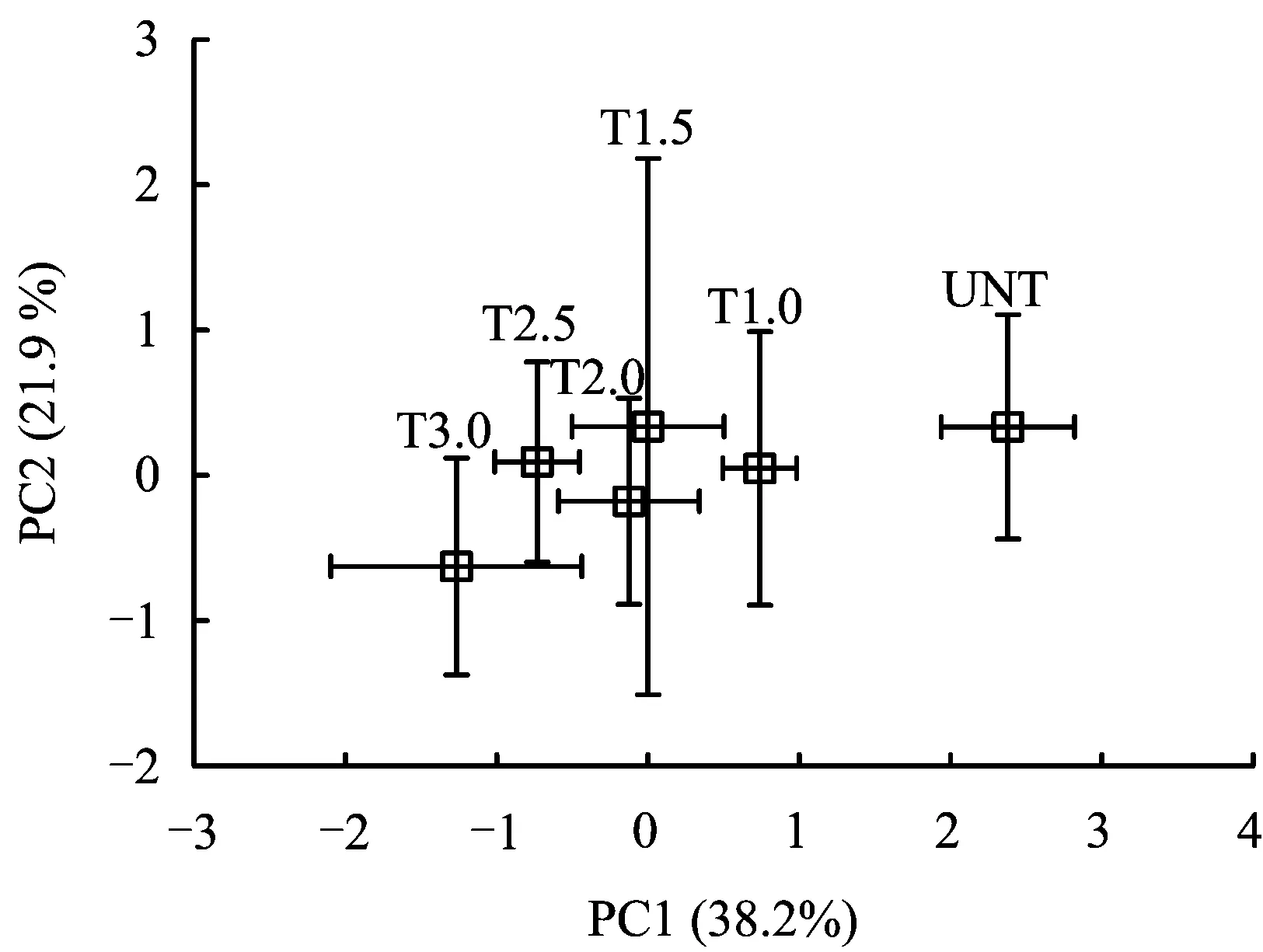
图5 硫酸链霉素处理浓度对酶活性总体变化影响的主成分分析Fig.5 Principal components analysis against effects of sulfate streptomycin treatment concentration on the total changes in enzyme activities
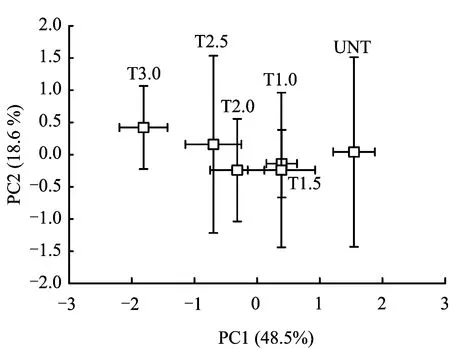
图6 硫酸链霉素处理浓度对生化作用总体变化影响的主成分分析Fig.6 Principal components analysis against effects of sulfate streptomycin treatment concentration on the total changes in biochemical transformations
蔗糖酶(也称转化酶)的作用是催化蔗糖分解成葡萄糖和果糖,主要来源于植物和真菌,其次是细菌[15]。在本研究中,一个非常有趣的发现是,随着细菌数量的减少,蔗糖酶活性显著提高。可能是随着细菌数量逐渐被抑制,细菌对蔗糖的利用强度相应减弱,湿地填料中的蔗糖浓度有所提高,导致蔗糖酶活性得以提高。由于蔗糖酶主要来源之一是真菌,随着细菌数量逐渐抑制,细菌和真菌之间的竞争减弱,有利于真菌的生长繁殖,最终使填料中的蔗糖酶活性提高。
物质循环与能量流动是通过微生物驱动的一系列生化作用来实现的,所以研究湿地中细菌与各生化作用的关系对于进一步认识细菌在污染物净化中的作用具有一定意义[11]。在本研究中,对纤维素降解作用、氨化作用、硝化作用、反硝化作用、无机磷转化作用和有机磷降解作用进行了测定, 结果显示,纤维素降解作用和无机磷转化作用没有随着硫酸链霉素处理浓度发生明显改变,最有可能的原因是由于纤维素属于难降解的大分子有机物,其降解主要由真菌和原生动物来完成[12]。而无机磷转化作用的主要功能是将难溶的无机磷化合物转化为可溶解的无机磷化合物,该过程虽然也与细菌(如溶磷细菌)等微生物分泌有机酸的量有关,但与植物分泌的有机酸以及土壤中的腐殖酸含量关系更加密切[11]。正如我们预期的那样,细菌生长被抑制导致氨化作用、硝化作用、反硝化作用和有机磷降解作用的下降,表明细菌在人工湿地的氮和有机磷净化过程中确实发挥着重要作用。
另外,主成分分析表明,酶活性的总体变化仅仅区分了链霉素处理和未处理的湿地单元,并没有显著区分不同浓度链霉素处理湿地。然而生化作用不仅有效地区分了不同浓度链霉素处理和未处理的湿地单元,而且更重要的是也区分了经不同浓度链霉素处理的湿地单元。以往的研究主张将土壤酶活性作为反映环境变化的最敏感指标[16-17],但本研究结果却表明土壤生化作用的总体变化在区分链霉素处理湿地单元时更敏感。
4 结论
本研究突出了细菌在人工湿地氮和有机磷净化方面的重要性,因为细菌的逐渐抑制导致了与氮和磷循环有关的酶以及生化作用显著减低。土壤生化作用的总体变化在区分链霉素处理浓度时要比酶活性敏感,这一规律是否具有普遍性还需进一步验证。
参考文献:
[1] Hartman W H, Richardson C J, Vilgalys R, Bruland G L. Environmental and anthropogenic controls over bacterial communities in wetland soils[J]. Proceedings of the National Academy of Sciences, 2008, 105:17842-17847.
[2] Vymazal J. Constructed wetlands for wastewater treatment:Five decades of experience[J]. Environmental Science and Technology, 2011, 45:61-69.
[3] Hatano K, Frederick D J, Moore J A. Microbial ecology of constructed wetlands used for treating pulp-mill wastewater[J]. Water Science and Technology, 1999, 29 (4):233-239.
[4] Nurk K, Truu J, Truu M, Mander U. Microbial characteristics and nitrogen transformation in planted soil filter for domestic wastewater treatment[J]. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2005, 40:1201-1214.
[5] Zhang C B, Wang J, Liu W Letal. Effects of plant diversity on microbial biomass and community metabolic profiles in a full-scale constructed wetland[J]. Ecological Engineering, 2010, 36:62-68.
[6] Stottmeister U, Wieβner A, Kuschk Petal. Effects of plants and microorganisms in constructed wetlands for wastewater treatment[J]. Biotechnology Advances, 2003, 22:93-117.
[7] Faulwetter J L, Gagnon V, Sundberg Cetal. Microbial processes influencing performance of treatment wetlands:A review[J]. Ecological Engineering, 2009, 35:987-1004.
[8] Ingham E R, Coleman D C. Effects of streptomycin, cycloheximide, fungizone, captan, carbofuran, cygon, and PCNB on soil microorganisms[J]. Microbial Ecology, 1984, 10:345-358.
[9] Beare M H, Parmelee R W, Hendrix P F, Cheng W. Microbial and faunal interactions and effects on litter nitrogen and decomposition in agroecosystems[J]. Ecological Monographs, 1992, 62:569-91.
[10] Austin A T, Sala O E, Jackson R B. Inhibition of nitrification alters carbon turnover in the Patagonian steppe[J]. Ecosystems, 2006, 9:1257-1265.
[11] 中国科学院南京土壤研究所微生物室. 土壤微生物研究法[M]. 北京:科学出版社, 1985.
Microbiological Research Room of Nanjing Soil Research Institute of Chinese Academy of Sciences. Research methods of soil microbiology[M]. Beijing:Science Press, 1985.
[12] 许光辉, 郑洪元.. 土壤微生物分析方法手册[M]. 北京:农业出版社, 1986.
Xu G H, Zheng H Y. Manual of analyzing methods of soil microbiology[M]. Beijing:Agricultural Press. 1986.
[13] Geisseler D, Horwath W R. Regulation of extracellular protease activity in soil in response to different sources and concentrations of nitrogen and carbon[J]. Soil Biology and Biochemistry, 2008, 40:3040-3048.
[14] Dashtban M, Maki M, Leung K Tetal. Cellulase activities in biomass conversion:measurement methods and comparison[J]. Critical Reviews in Biotechnology, 2010, 30:302-309.
[15] Stemmer M, Gerzabek M H, Kandeler E. Invertase and xylanase activity of bulk soil and particle-size fractions during maize straw decomposition[J]. Soil Biology and Biochemistry, 1999, 31:9-18.
[16] Izquierdo I, Caravaca F, Alguacil M Metal. Use of microbiological indicators for evaluating success in soil restoration after revegetation of a mining area under subtropical conditions[J]. Applied Soil Ecology, 2005, 30:3-10.
[17] Zhang C B, Huang L N, Luan T Getal. Structure and function of microbial community during the early stages of revegetation near Shaoguan Pb/Zn Smelter, Guangdong, P.R. China[J]. Geoderma, 2006, 136:555-565.
