猪巨细胞病毒TaqMan荧光定量PCR检测的建立
2014-04-08拜廷阳赵德明吴志明闫若潜刘淑敏赵明军刘梅芬
拜廷阳,赵德明,吴志明,闫若潜,刘淑敏,赵明军,刘梅芬
巨细胞病毒(Cytomegalovirus, CMV)是一类在自然界普遍存在而又有严格种属特异性的病毒,属β疱疹病毒亚科,致猪发病的为猪巨细胞病毒(Porcine Cytomegalovirus,PCMV),是一种条件性传染病。该病毒首次从英格兰分离,是继伪狂犬病毒之后发现的第2个猪疱疹病毒[1]。患猪特征性临诊症状为食欲废绝,母猪繁殖障碍,表现为流产、死产、木乃伊胎、产弱仔等;仔猪有明显的眼炎、鼻炎和肺炎症状,生长发育不良,增重差。本病毒分布广泛,大多数常规条件下饲养的猪群均存在PCMV感染,而且抗体阳性率都很高,但一般为亚临床型。自从1955年Done首次报道该病以来,在英国、日本、德国、美国和澳大利亚等地区猪群的血清抗体阳性率大于90%。在感染猪群中,血清抗体阳性率高达98%;近年来,猪群中PCMV感染呈现上升趋势,且多与猪蓝耳病等混合感染,大大加剧患猪的病死率[2]。在日本1972年就有本病病理学方面的报道[3]。随着器管移植技术的发展,PCMV作为猪源病毒,对异种移植构成的潜在威胁也引起了相应重视[4-6]。
建立PCMV的快速诊断对该病的早期诊断、防治及公共卫生等具有重要的意义。传统的病毒分离方法需进行体外细胞培养增殖并观察细胞病变,但由于PCMV在体外增殖较困难,所需时间长,费时费力,难以推广应用。因此建立猪巨细胞病毒快速、敏感、定量、特异的诊断方法非常必要。迄今为至,尚无利用FQ-PCR检测PCMV感染的相关报道。特对建立PCMV TaqMan FQ-PCR检测进行试验,现将结果报告如下。
1 材料与方法
1.1主要试剂及仪器 KingFisher全自动核酸提取仪为美国Thermo Fisher公司产品;ABI 7000荧光定量PCR 仪为美国应用生物技术公司产品;梯度PCR仪为德国Biometra公司产品;分光光度计(UV-2450)为日本岛冿公司产品;凝胶成像分析系统为美国Alpha Innotech公司产品。DNA回收试剂盒及质粒小量提取试剂盒等均购自大连(宝)生物工程有限公司;磁珠法核酸全自动提取试剂盒购自Ambion生物科技公司;pGEM-T Easy载体购自Promega公司 。
1.2质粒、菌毒株及检测样品 重组质粒pGEM-T/PCMV由河南省动物疫病预防控制中心实验室保存。猪圆环病毒2型(PCV2)、猪细小病毒(PPV) 、猪伪狂犬病毒(PRV)、高致病性猪蓝耳病病毒(HP-PRRSV)、猪链球菌(SS)由河南省动物疫病防控制中心实验室提供。ST 传代细胞源猪瘟(CSFV)活疫苗毒株为产品。检测样品采自河南省部分猪场,诊断为临床疑似PCMV感染后采集的15份病死猪扁桃体样品,样品加入适量PBS液匀浆后离心提取上清液和PCV2、PPV、PRV、PRRSV、CSFV的培养液态样品,按照文献报道的方法[7]利用Kingfisher全自动核酸提取仪、采用磁珠法进行DNA和RNA的提取。
1.3引物与TaqMan探针的设计与合成 根据GenBank中DNA聚合酶基因保守序列,利用Primer Express 3.0软件设计1对特异引物对P1/P2(P1:5′-TGG CAC TGA TAC TTG ACA AGC -3′/P2(5′-CTC CCG TGA AGC CGT AAA A-3′) 和TaqMan 探针(FAM-5′- CAG CTT GCC CTC AAG GTG ACG TG -3′-TAMRA)。引物和探针由大连(宝)生物工程有限公司合成。
1.4引物和探针浓度的筛选 用矩阵法对FQ-PCR的循环参数、引物和探针浓度以及所选引物与探针的组合等进行筛选优化,以得到最佳的荧光定量PCR反应条件。
1.5敏感性试验及标准曲线的建立 用含pGEM-T/PCMV重组质粒的溶液作标准品,10倍系列稀释成1.0×1010~1.0×100拷贝/μL,共11个稀释度,以不同浓度的重组质粒为模板进行FQ-PCR敏感性试验。以起始模板数的对数为X轴,以FQ-PCR循环次数Ct值为Y轴作回归曲线,建立PCMV检测的标准曲线。
1.6特异性试验 采用pGEM-T/PCMV重组质粒作模板进行实时荧光定量特异性实验,按照文献报道[8]的方法利用Kinfisher全自动核酸仪、采用磁珠法进行PCV2、PPV 、PRV、PRRSV、SS、CSFV的总DNA和RNA提取,并采用河南省动物疫病预防控制中心已建立成功的RT-PCR方法对RNA病毒进行全长反转录,然后对反转录得到的cDNA和提取的总DNA进行FQ-PCR检测,并设空白对照以检验本方法的特异性。
1.7稳定性和重复性试验 用FQ-PCR法对模板质粒DNA 含量分别为1.0×108,1.0×106和1.0×104拷贝/μL的3个浓度样品分别进行6次重复检测,以检验该检测方法的稳定性和重复性。
1.8与常规PCR检测灵敏度的比较 以pGEM-T/PCMV重组质粒为标准品,10倍系列稀释成1.0×1010~1.0×100拷贝/μL,以其为模板进行FQ-PCR,同时利用河南省动物疫病预防控制中心已建立成功的PCMV常规PCR检测方法进行对照检测,以比较2种方法检测灵敏度。
1.9临床应用性试验 提取临床表现为食欲下降、精神沉郁,皮肤发红、眼睑水肿或严重的结膜炎,喷嚏、咳嗽、流泪、鼻腔分泌物增多,下颌水肿等疑似PCMV感染的病死仔猪的15份扁桃体样品总DNA,以pGEM-T/PCMV为阳性对照、无菌双蒸水为阴性对照进行FQ-PCR扩增;同时进行常规PCR检测,以验证二者的符合率。
1.10病毒在不同内脏器管分布检测 选取6头PCMV FQ-PCR检测结果为阳性的猪,采用建立的FQ-PCR方法对来自同一头猪的血清和扁桃体、肺脏、气管、腹股沟淋巴结、肠系膜淋巴结、脾脏、肾脏、肝脏、膀胱、胃、心脏、小肠等内脏器管进行PCMV病毒含量检测,以比较PCMV在猪体不同器官的含量分布。
2 结 果
2.1pGEM-T/PCMV重组质粒DNA浓度的测定 提取的pGEM-T/PCMV重组质粒DNA经分光光度计测定,其100倍稀释的OD260平均值为0.046,OD280平均值为0.024 6,OD260/ OD280平均值为1.870。参照文献的方法[8],计算所提质粒DNA溶液的浓度为6.18×1010拷贝/μL。由于所克隆基因在PCMV中为单一拷贝,故用此质粒DNA作为标准品制作标准曲线。
2.2FQ-PCR反应条件的确定 采用矩阵法优选引物和探针的最佳浓度,结果表明,采用终浓度为5 μmol/L的引物浓度和2.5 μmol/L的探针浓度对质粒标准品进行检测,可获得较小的反应循环数(Ct值)和较大的荧光信号(△Rn)。FQ-PCR循环条件优化结果表明,双温循环及60 ℃的退火温度为最佳的循环条件。确定的FQ-PCR反应总体积为25 μL,其中10×ExTaqBuffer 2.5 μL(Mg2+浓度为2.0 mmol/L),dNTPs 2 μL,ExTaq酶 0.25 μL,上下游引物各0.5 μL(10 μmol/L),探针0.25 μL(10 μmol/L),模板1 μL,ddH2O 18.00 μL,混合均匀,置ABI 7 000荧光定量PCR仪上进行自动化扩增反应。反应程序为:94 ℃预变性4 min;然后94 ℃变性15 s,60 ℃退火延伸40 s,共进行40个循环。在每个循环延伸结束时进行荧光信号检测,荧光模式设为FAM/TAMRA双标记模式。
2.3标准曲线及FQ-PCR的灵敏度 以10倍系列稀释的标准pGEM-T/PCMV重组质粒 (1.0×1010~1.0×100拷贝/μL)为模板进行FQ-PCR,当重组质粒浓度稀释为1.0×100拷贝/μL时,荧光曲线的最高△Rn值在2 000左右,Ct值为29.87,表明该方法检测时的灵敏度为1.0×100拷贝/μL(图1)。根据检测结果所计算出的标准曲线见图2,曲线相关系数为0.998,斜率为-2.54,截距为38.39,从而可以得出拷贝数(X)与Ct值之间的线性关系表达式为:Ct=-2.54×logX+38.39。将由仪器读取的Ct值代入上述表达式即可算出初始拷贝数。

图110倍梯度稀释的PCMV重组质粒的FQ-PCR检测结果
1~11:对应的重组质粒模板浓度依次分别为1.0×1010,1.0×109,1.0×108,1.0×107,1.0×106,1.0×105,1.0×104,1.0×103,1.0×102,1.0×101和1.0×100拷贝/μL;N. 阴性对照
Fig.1DetectionresultsoftherecombinantpGEM-T/PCMVwith10foldserialdilutionsbytheFQ-PCRassay
Curves from No.1 to No.11 indicate FQ-PCR results of the recombinant pGEM-T/PCMVplasmid concentrations of 1.0×1010, 1.0×109, 1.0×108, 1.0×107, 1.0×106, 1.0×105, 1.0×104, 1.0×103, 1.0×102, 1.0×101, and 1.0×100copies/μL, respectively. Carve N is the negative control.
2.4FQ-PCR的特异性 特异性实验结果表明,以pGEM-T/PCMV重组质粒为阳性对照有荧光响应,而6个对照病原体、阴性对照无荧光响应(图3),说明所建立的PCMV FQ-PCR检测方法具有好的特异性。
2.5FQ-PCR的稳定性和重复性 以3个浓度的pGEM-T/PCMV重组质粒为标准品进行了6次重复测定,其结果如图4所示。通过计算及统计分析得知,起始浓度为1.0×108,1.0×106,1.0×104拷贝/μL的pGEM-T/PCMV重组质粒标准品的最终实际测得值分别为1.001×108,1.002×106,0.999×104拷贝/μL,表明此方法具有良好的稳定性和重复性。

图2 根据图1的结果建立的标准曲线
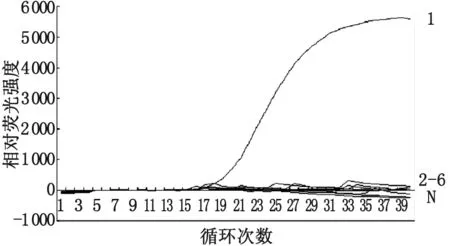
图3FQ-PCR方法的特异性
1: 阳性对照; 2~6: PCV2、PPV 、PRV、PRRSV、SS、CSFV;N: 阴性对照
Fig.3SpecificitytestresultsoftheFQ-PCRmethod
Curves of No.1 indicate the FQ-PCR results of recombinant pGEM-T/PCMV plasmid with concentrations of 1.0×107copies/μL, respectively.
Curves from No.2 to No.6 indicate the FQ-PCR results of the controls including the PCV2, PPV, PRV, PRRSV, SS, and CSFV, respectively.
Carve N indicates the FQ-PCR results of the negative control.

图4FQ-PCR的稳定性和重复性试验
1~3: 自左向右分别以浓度为1.0×108,
1.0×106,1.0×104拷贝/μL的pGEM-T/PCMV重组质粒为模板FQ-PCR方法重复扩增6次的结果
Fig.4AccuracyandrepetitionassayresultsoftheFQ-PCRmethod
Curve from No.1 to No.4 indicated the repetition 6 times results of the recombinant pGEM-T/PCMV plasmid with the concentrations of 1.0×108, 1.0×106and 1.0×104copies/μL, respectively.
2.6FQ-PCR与常规PCR检测灵敏度的比较 采用常规PCR方法检测时,检测的极限灵敏度为1.0×102个拷贝/μL;FQ-PCR的检测灵敏度为1个拷贝/μL(图1);表明 FQ-PCR方法的检测灵敏度是常规PCR检测方法的100倍。
2.7FQ-PCR与常规PCR对临床样品检测结果的比较 将疑似PCMV感染扁桃体组织样品和pGEM-T/PCMV阳性重组质粒,分别采用所建立的FQ-PCR和常规PCR进行检测。结果二种检测方法均检出9份阳性样品,对pGEM-T/PCMV阳性重组质粒的检测结果为阳性,二种方法检测结果完全相符(图5,图6)。

图5疑似PCMV感染扁桃体组织样品常规PCR检测结果电泳图
M:100 bp DNA标准分子量对照;P: 阳性对照(pGEM-T/PCMV);N:阴性对照;1~15:临床疑似PCMV感染猪扁桃体病料
Fig.5RoutinePCRamplificationofthe15clinicsuspiciousPCMVinfectedtonsiltissues
M: 100 bp DNA marker;P and N: PCR results of the positive and negative control, respectively;
Lane 1-15: 15 clinic suspicious PCMV infected tonsil tissue samples, respectively.
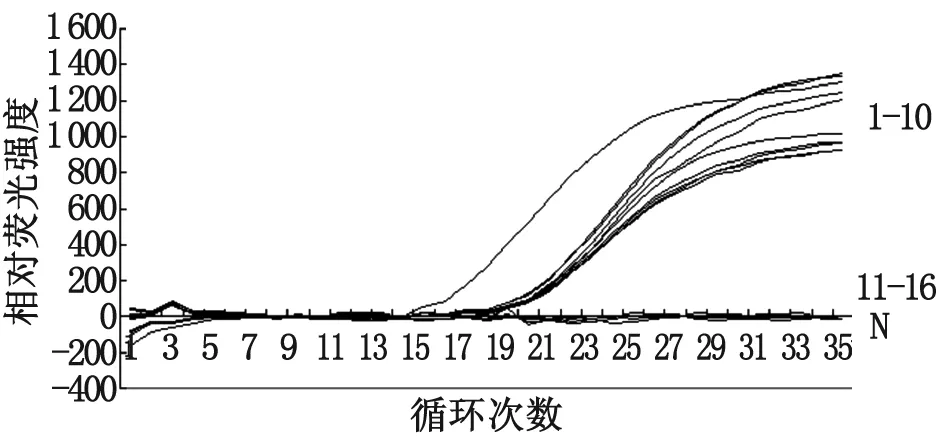
图6FQ-PCR检测临床疑似样品部分应用试验
1:pGEM-T/PCMV;2~10:PCMV阳性样品的FQ-PCR扩增曲线;11~16:PCMV阴性样品的FQ-PCR扩增曲线;N:空白对照样品
Fig.6ApplicationofFQ-PCRassaybydetectionoftheclinicsuspiciousPCMVinfectedtonsiltissue
1: Curves of the recombinant pGEM-T/PCMV plasmid;
2-10: Curves of the 9 positive samples of the 15 clinic suspicious PCMV infected samples;
11-16: Curves of the 6 negative samples of the 15 clinic suspicious PCMV infected samples;
N: Blank negative sample control
2.8病毒在不同内脏器管分布 对6头PCMV检测结果为阳性猪的血清和不同内脏器官中PCMV病毒含量的定量检测排序结果完全一致,其中PCMV含量最高的器官为猪扁桃体,最低的为小肠;按照病毒含量从高到低的顺序依次为:扁桃体、肺脏、肾脏、胃、心脏、腹股沟淋巴结、肝脏、膀胱、肠系膜淋巴结、气管、血清、脾脏、小肠。
3 讨 论
目前,国内外有关PCMV感染状况的研究较少,开展PCMV病原学快速诊断方法研究,可掌握PCMV在我国猪群中的感染状况,了解PCMV近年来对猪群健康的危害,从而及早采取有效防控措施防控该病的流行和发生。另外,在异种器官移植方面,猪是异种移植器官供体的最佳候选者[9],近年来, 国外关于PCMV的报道主要集中在其对异种移植的影响方面, 研究发现β疱疹病毒包括人疱疹病毒6型、7型(HHV-6、HHV-7)及CMV能够在器官移植后引起器官移植受者产生机会感染, 由此产生一系列症状和疾病, 统称为人巨细胞病毒疾病。目前虽然没有PCMV在体内传染给人类的直接证明, 但已有研究表明PCMV在体外能在人成纤维细胞中增殖[10],因此PCMV可能由带毒猪器官随器官移植传染给人,成为人体器官移植的重要传染病[11-13]。本研究进一步证明同为疱疹病毒科的PCMV可能是异种移植中潜在的动物传染源。鉴于PCMV在猪体内的高阳性率, 对于人类, PCMV也可能成为一种潜在的风险源。
PCMV的详细基因组结构尚不清楚,仅见有DNA聚合酶(DPOL)、gB、MCP等几个基因的研究。DPOL是PCMV能正确和高效复制所需的基本因子之一,是PCMV血清型特异性的单拷贝基因,选取DPOL基因为靶基因设计PCR引物,可确保PCMV PCR检测的特异性。本研究所建立的FQ-PCR方法以PCMV的DPOL基因为模板设计探针和引物,在特异性方面具有双重保证,因此具有较常规PCR更高的特异性。特异性试验和敏感性试验表明,FQ-PCR对不同浓度的pGEM-T/PCMV重组质粒呈现阳性反应,可检测到1拷贝/μL的病毒,而对6个对照病原菌均呈现阴性反应,说明本研究所建立的FQ-PCR方法具有很高的特异性和灵敏度。另外,对同一样品重复多次检测均可得到一致的Ct值和荧光强度,表明所建立的FQ-PCR方法具有很高的稳定性和重复性。利用FQ-PCR方法进一步对15份临床疑似PCMV感染病死仔猪扁桃体组织样品进行了检测,其检测结果与常规PCR方法的检测结果完全一致,说明该方法可成功用于PCMV快速诊断和临床应用检测。
迄今为止,国内外已有多名学者报道建立了针对PCMV的常规PCR检测方法[14-17],但尚未有PCMV荧光定量PCR检测方法的报道。本研究首次建立了PCMV荧光定量PCR诊断方法,与常规PCR方法相比,该方法诊断更加迅速,整个反应可在1~2 h内完成,而且不需要电泳,从而大大降低了对环境的污染,且其检测灵敏度是常规PCR方法的100倍,并能实现对样品的实时定量检测。因此, FQ-PCR方法对于PCMV的早期快速检测诊断、防控、净化及研究PCMV与其它病原体的混合感染及相互作用等方面具有意义。
本研究对来自6头PCMV检测结果为阳性猪的血清和不同内脏器官中的PCMV含量进行了定量研究,尽管6头猪的同一器官中PCMV病毒含量不尽相同,但不同内脏器官中PCMV病毒含量排序结果完全一致,即扁桃体、肺脏、肾脏较高,肠系膜淋巴结、气管、血清、脾脏、小肠较低。这为PCMV的检测、诊断、分离等研究提供了依据。
参考文献:
[1]Done JT. An “inclusion body” rhinitis of pigs[J]. Vet Rec, 1955, 67: 525-527.
[2]Tajima T, Hironao T, Kajikawa T, et al. Application of enzyme-linked immunosorbent assay for the seroepizootiological survey of antibodies against porcine cytomegalovirus[J]. Vet Med Sci, 1993, 55(3): 421-424.
[3]L’Ecuyer C, Corner AH, Randall GCB. Porcine cytomegalic inclusion disease: Transplacental transmission[C]. In Proc Congr Int Pig Vet Soc, 1972, 2: 99.
[4]Fishman JA, Patience C. Xenotransplantation: infectious risk revisited[J]. Am J Transplant, 2004, 4(9): 1383-1390.
[5]Mackenzie DA, Hullett DA, Sollinger HW, et al. Xenogeneic transplantation of porcine islets: an overview[J]. Transplantation, 2003, 76(6): 887-891.
[6]Ekser B, Rigotti P, Gridelli B, et al. Xenotransplantation of solid organs in the pig-to-primate model[J]. Transpl Immunol, 2009, 21(2): 87-92. DOI: 10.1016/j.trim.2008.10.005
[7]Yan RQ, An CX, Liu SM, et al. Establishment and application of duplex RT-PCR assay for detection of transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J]. Chin Ani Husb Vet Med, 2012, 39(9):38-42. (in Chinese)
闫若潜, 安春霞, 刘淑敏, 等. 猪传染性胃肠炎与流行性腹泻病毒二重RT-PCR检测方法的建立及应用[J]. 中国畜牧兽医, 2012,39(9): 38-42.
[8]Song ZJ, Song CX, Yang ZQ, et al. Development of real-time TaqMan-quantitative RT-PCR assay for detection of porcine reproductive and respiratory syndrome virus[J]. Vet Sci Chin, 2006, 36(2):98-102. DOI: 10. 3969/j.issn.1673-4696.2006.02.004(in Chinese)
宋志军, 宋长绪, 杨增岐, 等. 猪生殖与呼吸综合征病毒TaqMan荧光定量RT-PCR检测方法的建立[J]. 中国兽医科学, 2006,36(02):98-102.
[9]Garkavenko O, Dieckhoff B, Wynyard S, et al. Absence of transmission of potentially xenotic viruses in a prospective pig to primate islet xenotransplantation study[J]. Med Virol, 2008, 80(11): 2046-2052. DOI: 10.1002/jmv.21272
[10]Whitteker J, Dudani A, Tackaberry E, et al. Human fibroblasts are permissive for porcine cytomegalovirusinvitro[J]. Transplantation, 2008, 86(1): 155-158. DOI: 10.1097/TP.0b013e31817d4823
[11]Clark DA, Fryer JF, Tucker AW, et al. Porcine cytomegalovirus in pigs being bred for xenograft organs: progress towards control[J]. Xenotransplantation, 2003, 10: 142-148.
[12]Mueller NJ, Ezzelarab M, Buhler L, et al. Monitoring of porcine and baboon cytomegalovirus infection in xenotransplantation[J]. Xenotransplantation, 2009, 16: 535-536. DOI: 10.1111/j.1399-3089.2009.00536.x
[13]Fishman JA. Infection and xenotransplantation. Developing strategies to minimize risk.[J]. Ann N Y Acad Sci, 1998, 862: 52-66.
[14]Hamel AL, Lin L, Sachvie C, et al. PCR assay for detecting porcine cytomegalovirus[J]. Clin Microbiol, 1999, 37: 3767-3768.
[15]Widen BF, Lowings JP, Belak S, et al. Development of a PCR system for porcine cytomegalovirus detection and determination of the putative partial sequence of its DNA polymerase gene[J]. Epidemiol Infect, 1999, 123: 177-180.
[16]Lee CS, Moon HJ, Yang JS, et al. Multiplex PCR for the simultaneous detection of pseudorabies virus porcine cytomegalovirus and porcine circovirus in pigs[J]. J Virol Methods, 2007,139(1): 39-43. DOI: 10.1016/j.jviromet.2006.09.003
[17]Liu HL, Zhu L, Xu ZW, et al. Development and application of a PCR assay for detection of porcine cytomegalovirus[J]. Pro Vet Med, 2011, 32(7): 5-8. DOI: 10.3969/j.issn.1007-5038.2011.07.002 (in Chinese)
刘红亮, 朱玲, 徐志文,等. 猪巨细胞病毒PCR检测方法的建立及应用[J]. 动物医学进展, 2011,32(7):5-8.
