酵母双杂交筛选与CVB3 3A相互作用的人心脏蛋白
2014-04-08张静怡赵颖洁李秀珍何冰清黄孝天
张静怡,赵颖洁,李秀珍,方 舒,何冰清,刘 曦,罗 军,黄孝天
柯萨奇B3病毒归类于小RNA病毒科肠道病毒属,能引起人类病毒性心肌炎、无菌性脑膜炎、胰腺炎,甚至新生儿死亡等多种疾病。肠道病毒基因组为单股正链RNA,长约7.5 kb,两端为非编码区,中间为连续开放读码框,编码一个多聚蛋白。多聚蛋白经酶切后形成病毒的结构蛋白和非结构蛋白,3A是CVB3主要的非结构蛋白,具有十分重要的功能。特应用酵母双杂交技术,以CVB3 3A为诱饵蛋白,从人心脏cDNA文库中获得7种不同的阳性基因,力图在分子水平上探索3A蛋白的功能。
1 材料与方法
1.1菌株和质粒大肠埃希菌 DH5α由本实验室保存,酿酒酵母菌株AH109,预转化的人心脏cDNA文库Y187、pGBKT7质粒、均购于Clontech公司。
1.2主要试剂 Hifi DNA聚合酶(TransGen,北京),各种限制性内切酶、X-α-gal、鲑精DNA均购于Clontech公司,缺陷培养基、酸化玻璃微珠购于Sigma公司。
1.3诱饵质粒pGBKT7-3A的构建 根据GenBank中CVB3型3A基因序列( GI: 323432),利用Primer Premier 5.0 软件自行设计一对引物。P1:5′ GGAATTCACGCTTGAGGCACTGTTC 3′ ,P2:5′ AACTGCAGTATAAGCACCTTGAAAA
CCC3′。以病毒cDNA为模板,PCR扩增目的基因,将pGBKT7载体和PCR产物片段用PstⅠ和EcoRⅠ进行双酶切,然后用T4 DNA连接酶16℃连接过夜,转入DH5α感受态细胞中,提取质粒后酶切鉴定,并对所得候选阳性质粒进行DNA测序分析。
1.4融合蛋白表达检测 采用乙酸锂法将诱饵质粒转化至AH109感受态中,提取DNA-BD-c-Myc-3A融合蛋白,通过Western Blot验证融合蛋白的表达。
1.5人心脏cDNA文库含量滴定 按文献所述进行[1]。
1.6酵母双杂交 按照Clontech公司Yeast protocols handbook将诱饵菌落与人心脏cDNA文库菌Y187[pGADT7-cDNA Library]配合,计算筛库效率。AH109具有4个报告基因HIS3、ADE2、MEL1(表达α-半乳糖苷酶,可分解无色的X-α-Gal为蓝色产物)和lacZ。AH109正常生长时这4个基因不表达,若具有相互作用的诱饵蛋白和捕获蛋白在AH109中共同表达时,则可导致报告基因HIS3、ADE2、MEL1和lacZ的激活。而MEL1表达的α-半乳糖苷酶能使底物X-α-Gal分解,产生颜色变化。
1.7阳性克隆的初步分析
1.7.1阳性候选克隆归类和DNA序列分析 酚氯仿异戊醇法抽提阳性酵母菌中的pGADT7-AD质粒。以抽提的质粒DNA为模板,用pGADT7载体引物扩增cDNA插入片段,并用Alu I酶切PCR产物,根据琼脂糖凝胶电泳分析酶切带型对阳性克隆进行归类。将归类后的阳性质粒电击转化至大肠埃希菌DH5α中,采用GAL4 AD和3′AD测序引物对每类阳性克隆的pGADT7-AD质粒进行测序鉴定。测序结果的相似性分析通过NCBI网站的BLAST程序比对完成(http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi)。
1.7.2回返配合实验 将AH109[pGADT7-AD]与Y187[pGBKT7-3A]接种于同一只装有0.5 mL 2X YPDA的1.5 mL 微量离心管。同时设立对照:AH109[pGADT7-AD](Y187[pGBKT7](阴性对照),AH109[pGBKT7-53]( Y187[pTD1-1](阳性对照)。高速旋涡离心管1 min以完全分散菌悬液,30 ℃ 200 r/min 振荡培养24 h。将配合菌分别铺于SD/-Leu/-Trp/-His/-Ade营养缺陷型平板,30℃倒置培养3~5 d。
2 结 果
2.1诱饵质粒pGBKT7-3A的构建及鉴定 抽取质粒经双酶切鉴定,片段大小相符,见图1。测序分析结果显示阅读框无误,表明质粒构建成功。
2.2诱饵蛋白在酵母中的表达 c-Myc抗体检测DNA-BD-c-Myc-3A融合蛋白,在相应分子质量处可以检测到特异性条带,表明含诱饵质粒的酵母菌中有融合蛋白的表达,见图2。
2.3人心脏cDNA文库含量滴定 经滴定,人心脏cDNA文库菌Y187菌落数为4.3×107cfu/mL。
2.4酵母双杂交实际筛库含量和筛库效率 根据公式计算,实际筛库菌落数为2.28×108cfu,筛库效率为24.1%。超过筛库下限效率2%,表示两种酵母菌配合功能正常,适合酵母双杂交试验。
2.5阳性候选克隆归类和DNA序列测定分析 对从人心脏cDNA文库中筛选与3A相互作用的阳性候选克隆进行初步分析,通过测序分析及BLAST比对,合并序列完全相同的克隆,并剔除载体的阅读框与目的基因不匹配的克隆,最后共获得7个不同类别的基因:RyR2 、SPCS2 、TMED4、COX1、COX3、MYH7和SDHD,见表1。
2.6回返配合实验 AH109[pGADT7-AD]×Y187[pGBKT7-3A]配合组与阳性对照结果相同,在SD/-Trp/-Leu/-His/-Ade/X-a-Gal平板上仍能良好生长,且分泌的α-半乳糖苷酶分解底物X-a-Gal产生蓝色,使菌落变蓝,见图3。
3 讨 论
随着酵母双杂交技术的广泛应用,利用其筛选与病毒蛋白相互作用的宿主蛋白成为寻找抗病毒作用靶点的新途径。例如内质网膜蛋白3(reticulon 3,RTN3)与新型肠道病毒71型(enteroviruses type 71,EV71)2C蛋白N-端的膜结合区相互作用后,然后再与病毒dsRNA结合形成病毒复制复合体,对病毒在体内的复制具有重要作用[2]。肠道病毒的复制依赖三型肌醇磷脂4位激酶β(phosphatidylinositol4-kinase class III beta PI4KIIIβ),通过降低其活性可以抑制病毒复制。肠道病毒3A蛋白与PI4KIIIβ结合形成复合物,同时再与ACBD3(Golgi adaptor acyl coenzyme A (acyl-CoA) binding domain protein 3)相互作用。Greninger等通过突变破坏3A/ACBD3/PI4KIIIβ复合物的作用位点,抑制PI4KIIIβ的活性,进一步减少宿主体内病毒的复制[3-4]。

图1重组质粒pGBKT7-3A的酶切鉴定
1: 经EcoR I和PstI双酶切的空质粒pGBKT7; 2: 经EcoR I和PstI双酶切的重组质粒pGBKT7-3A; 3:EcoR I和PstI双酶切的3A基因
Fig.1IdentificationofrecombinantplasmidpGBKT7-3A
1: Plasmid pGBKT7 digested byEcoR I andPstI;
2: Recombinant plasmid pGBKT7- 3A gene digested byEcoR I andPstI;
3: PCR product of 3A gene digested byEcoRI andPstI.

图2DNA-BD-cMyc3A融合蛋白检测
1: AH109[pGBKT7-3A]; 2: AH109[pGBKT7]
Fig.2DetectionofDNA-BD-cMyc3Afusionprotein
1: AH109[pGBKT7-3A]; 2: AH109[pGBKT7].

图3与CVB33A相互作用的酵母双杂交阳性候选克隆
1:Y187[pGADT7-RyR2]×AH109[pGBKT7-3A];
2:Y187[pGADT7-SPCS2]×AH109[pGBKT7-3A];
3:Y187[pGADT7-TMED4]×AH109[pGBKT7-3A];
4:Y187[pGADT7-COX1]×AH109[pGBKT7-3A];
5:Y187[pGADT7-COX3]×AH109[pGBKT7-3A];
6:Y187[pGADT7-MYH7/SDHD]×AH109[pGBKT7-3A];
阴性对照: AH109[pGBKT7]×Y187[pGADT7]; 阳性对照: AH109[pGBKT7-53]×Y187[pTD1-1].
Fig.3CandidatepositiveclonesinteractingwithCVB33Ainyeasttwo-hybridsystem
1: Y187[pGADT7-RyR2]AH109[pGBKT7-3A];
2:Y187[pGADT7-SPCS2]AH109[pGBKT7-3A];
3: Y187[pGADT7-TMED4]AH109[pGBKT7-3A];
4:Y187[pGADT7-COX1]AH109[pGBKT7-3A];
5: Y187[pGADT7-COX3]AH109[pGBKT7-3A];
6:Y187[pGADT7-MYH7/SDHD]AH109[pGBKT7-3A];
Negative control: AH109[pGBKT7]Y187[pGADT7];
Positive control: AH109[pGBKT7-53]Y187[pTD1-1].
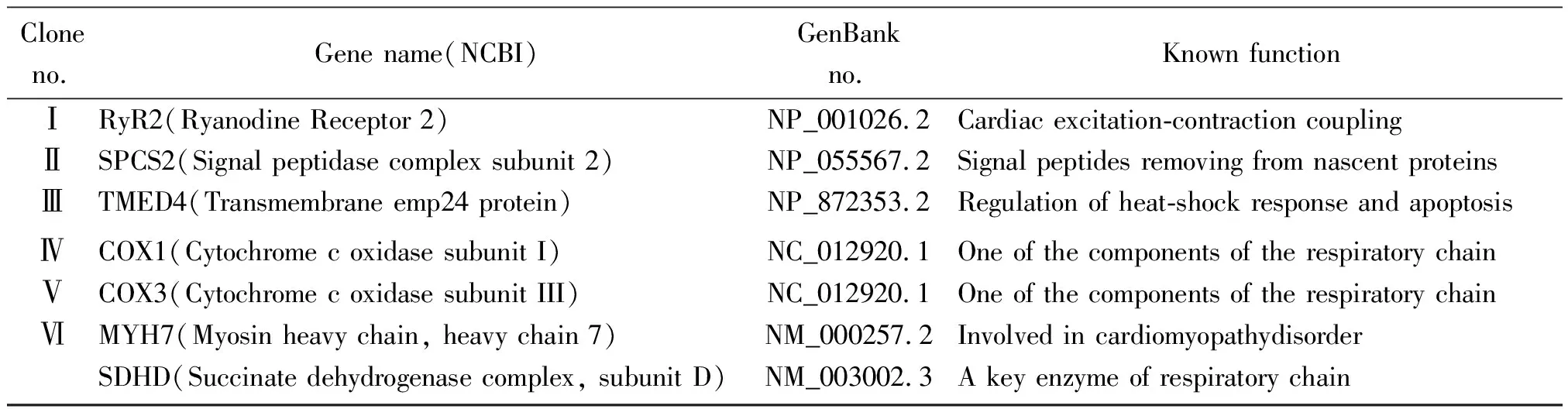
表1 与CVB3 3A相互作用的酵母双杂交阳性候选克隆分类
本研究以CVB3 3A为诱饵蛋白,经大规模配合实验,从人心脏cDNA文库中筛选到7个相互作用蛋白:RyR2 、SPCS2 、TMED4、COX1、COX3、MYH7和 SDHD。RyR2主要分布于心肌细胞,是由 4 个 560kD 的单体构成的同源四聚体的大分子信号复合物,四个单体围成一个中央有孔的能够调节Ca2+进出的钙离子通道,在心肌收缩-舒张偶联中扮演着关键的作用。研究发现,RyR2功能异常是心力衰竭、房颤等许多心脏疾病的发病原因[5-6]。此外,Blayney等认为RyR2基因突变是新生儿猝死综合征的主要原因[7]。SPC(Succinate dehydrogenase complex)由5个亚单位组成,SPCS2是其重要组成部分。SPC是宿主细胞内质网内膜上由亚单位组成的蛋白酶复合体,其作用是将进入内质网的蛋白前体切去信号肽,使其能够成为成熟的蛋白质,在病原体蛋白的转运和成熟过程起重要作用[8]。TMED4又称内质网应激蛋白25(endoplasmic reticulum stress-response protein 25,ERS25),是一类新型蛋白,ERS25主要存在于内质网内,对促进内质网向高尔基体的蛋白转运具有重要作用[9-10]。线粒体是细胞氧化磷酸化反应的场所,心肌细胞缺血时线粒体结构破坏和功能障碍出现的最早。COX是线粒体内膜呼吸链的关键酶,其活力影响线粒体的氧化磷酸化过程。在CVB3感染过程中, 病毒的吸附、穿入及扩散会对细胞膜、线粒体膜造成直接损伤,引起线粒体内膜上Ca2+- ATP 酶的活性下降、线粒体钙化。研究发现,益气活血中药复方可以通过增加受感染心肌细胞的COX1、COX2基因的活性,提高线粒体的缺氧应激水平,抑制CVB3 感染后细胞凋亡的发生,从而达到保护心肌细胞、治疗病毒性心肌炎的目的。所以,COX1、COX2基因表达量增加有助于治疗CVB3感染引起的病毒性心肌炎[11]。
令人困惑的是,经BLAST分析,我们发现筛选出的第6个阳性基因序列是由部分的肌球蛋白重链(myosin heavy chain,MYH7)基因序列和SDHD全长序列组成的串联基因。MYH7主要在心脏中表达,其突变可能引起先天性心肌病,对心脏功能的正常发挥必不可少[12]。SDH是线粒体的标志酶,其酶活性可以作为直接反映心肌细胞缺氧变化的一个重要指标,SDHD的突变还与散发性副神经节(paraganglioma,PGL)的发病有关[13]。我们筛出的这个阳性基因到底是一个新的基因还是两个基因串联则需要进一步通过实验证实。
参考文献:
[1]Liu F, Yu K, Luo Y, et al. Screening of cellular proteins that interact with CVB3 VP1 by yeast two-hybrid system[J]. Chin J Zoonoses, 2009, 25(10): 991-995. (in Chinese)
[2]Tang WF, Yang SY, Wu BW, et al. Reticulon 3 binds the 2C protein of enterovirus 71 and is required for viral replication[J]. J Biol Chem, 2007, 282(8): 5888-5898. DOI: 10.1074/jbc.M611145200
[3]Greninger AL, Knudsen GM, Betegon M, et al. The 3A protein from multiple picornaviruses utilizes the Golgi adaptor protein ACBD3 to recruit PI4KIIIβ[J]. J Virol, 2012, 86(7): 3605-3616. DOI: 10.1128/JVI.06778-11
[4]Greninger AL, Knudsen GM, Betegon M, et al. ACBD3 interaction with TBC1 domain 22 protein is differentially affected by enteroviral and kobuviral 3A protein binding[J]. MBio, 2013, 4(2): e00098-13. DOI: 10.1128/mBio.00098-13
[5]Kushnir A, Marks AR. The ryanodine receptor in cardiac physiology and disease[J]. Adv Pharmacol, 2010, 59(10): 1-30. DOI: 10.1016/S1054-3589(10)59001-X
[6]Ono M, Yano M, Hino A, et al. Dissociation of calmodulin from cardiac ryanodine receptor causes aberrant Ca2+release in heart failure[J]. Cardiovasc Res, 2010, 87(4): 609-617. DOI: 10.1093/cvr/cvq108
[7]Blayney LM, Lai FA. Ryanodine receptor-mediated arrhythmias and sudden cardiac death[J]. Pharmacol Ther, 2009, 123(2): 151-177. DOI: 10.1016/j.pharmthera
[8]Tuteja R, Pradhan A, Sharma S.Plasmodiumfalciparumsignal peptidase is regulated by phosphorylation and required for intra-erythrocytic growth[J]. Mol Biochem Parasitol, 2008, 157(2): 137-147.
[9]Anantharaman V, Aravind L. The GOLD domain, a novel protein module involved in Golgi function and secretion[J]. Genome Biol,2002,3(5):0023.DOI:10.1186/gb-2002-3-5-research0023
[10]Hwang SO, Boswell SA, Seo JS, et al. Novel oxidative stress-responsive gene ERS25 functions as a regulator of the heat-shock and cell death response[J]. J Biol Chem, 2008, 283(19): 13063-13069. DOI: 10.1074/jbc.M709656200
[11]Zhang M, Cao H, Che H, et al. The expression of cytochrome c oxidase subunit I and cytochrome coxidase subunit II in Mouse myocardial T cell model induced by CVB3 that treated with the supplementing Qi and activating blood circulation Chinese herbal compound[J]. Basic Med J Traditional Chin Medi, 2010, 16(12): 1110-1112. (in Chinese)
[12]Esposito T, Sampaolo S, Limongelli G, et al. Digenic mutational inheritance of the integrin alpha 7 and the myosin heavy chain 7B genes causes congenital myopathy with left ventricular non-compact cardiomyopathy[J]. Orphanet J Rare Dis, 2013, 8(1): 91. DOI: 10.1186/1750-1172-8-91
[13]Xekouki P, Pacak K, Almeida M, et al. Succinate dehydrogenase (SDH) D subunit (SDHD) inactivation in a growth-hormone-producing pituitary tumor: a new association for SDH?[J]. J Clin Endocrinol Metab, 2012, 97(3): E357-E366. DOI: 10.1210/jc.2011-1179
