硫化锌精矿富氧浸出的动力学研究
2014-04-01吕国志赵爱春张廷安古岩谢刚张莹张国权刘燕
吕国志,赵爱春,张廷安,古岩,谢刚,张莹,张国权,刘燕
(1. 东北大学 材料与冶金学院,辽宁 沈阳,110819;2. 太原科技大学 材料科学与工程学院,山西 太原,030024;3. 昆明冶金研究院,云南 昆明,650051)
锌在自然界中主要以硫化矿的形式存在。目前,世界上主要炼锌方法是湿法炼锌,80%以上的原生锌锭是通过湿法炼锌的工艺方法生产出来的[1-2]。硫化锌精矿是炼锌的主要矿物资源[3-4]。传统的湿法炼锌工艺是火法和湿法工艺的结合,即先将锌精矿焙烧后制成氧化锌,再放入反应器中浸出[5-7],在焙烧过程中会产生大量的烟气(主要成分是SO2),对环境造成污染,因而,硫化锌精矿的全湿法浸出技术引起了人们的普遍关注。硫化锌精矿氧压浸出的基本反应式为
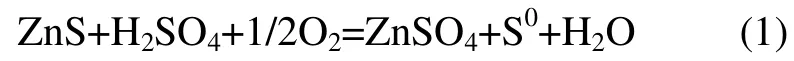
与传统的湿法炼锌工艺相比,该工艺具有浸出条件简单,工艺流程短,产生“三废”少,生产成本低,锌浸出率高等一系列优点[8-11]。
对于锌精矿的氧压浸出过程方面,国外学者研究较多。Liang 等[12]认为铁离子对促进闪锌矿的浸出作用明显。Jan 等[13]指出闪锌矿的浸出是一个非均匀的表面反应,浸出过程的限制性环节为中间产物H2S 在闪锌矿表面的氧化。Corriou 等[14]通过研究合成闪锌矿在硫酸溶液中加压浸出的热力学与动力学,证明闪锌矿的溶解受H2S 氧化控制。本文以硫化锌精矿为研究对象,对其富氧浸出过程的动力学进行研究。
1 实验理论依据
硫化锌精矿富氧浸出属于多相反应,如(2)所示。这一反应有固体(ZnS),水溶物种(H+)与O2(g)参加,但不能把这一反应视为固-液-气三相反应。事实上气体O2是先溶解于溶液中:

而后以溶液中溶解的O2的形式参加反应,因此,硫化矿的富氧浸出仍应视为固-液两相反应[15-16]。
固-液相反应动力学的研究有多种方法[17-18],本文采用“多相反应的收缩核动力学模型”来研究硫化锌精矿富氧浸出过程的动力学。Habashi[19]系统介绍了这一模型的推导与应用方法。
在一固体反应物B(s)与一水溶物种A(aq)反应生成的产物也是水溶物种P(aq),即
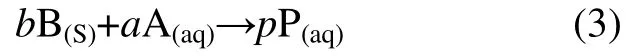
这一反应的速率为
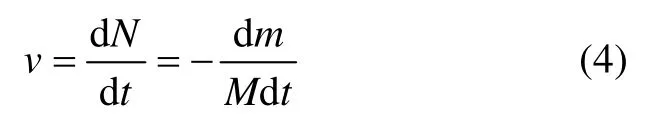
式中:v 为反应速率,mol/s;N 为固体反应物的物质的量,mol;t 为反应时间,s;m 为固体反应物的质量,g;M 为固体反应物的相对分子质量,g/mol。
按照质量作用定律,这一反应的速率为

式中:k 为反应的速率常数;s 为固体反应物的表面积(对于颗粒状物质,表面积与其粒度有关),m2;c 为水溶物种反应物A(aq)的浓度,mol/L;n 为反应级数。
联合式(4)与(5)并求解,得浸出率α 与时间的关系式为

式中:α 为固体反应物的反应率,浸出过程则为浸出率;t 为浸出时间,min;k 为反应速率常数;ρ 为固体反应物的密度,g/cm3;ro为固体反应物颗粒的初始半径,cm。
式(6)即为生成物为水溶物种的“多相反应的收缩核动力学模型”。这一模型是针对1 种固体反应物(颗粒状)与1 种水溶物种之间的反应,若有多种水溶物种参加反应:
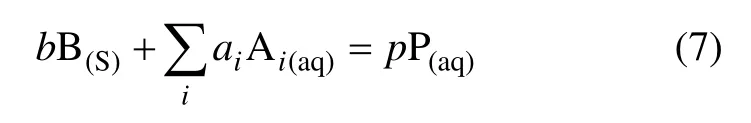
则根据质量作用定律,反应速率为

式中:∏代表连乘;ci为每种水溶物种反应物的浓度,mol/L;ni为每种水溶物种反应物的反应级数(并非其计量系数),Σ ni则为反应的级数。
按照同一推导方法可推导出1 种固体反应物与多种水溶物种反应物反应并生成产物为水溶物种时的“收缩核动力学模型”为

对于式(1)所表示闪锌矿的富氧浸出这一动力学模型具体化为

式中:c(O2(aq))为水溶液中氧的浓度,mol/L;c 为水溶液中酸浓度,mol/L。
根据亨利定律:

即:
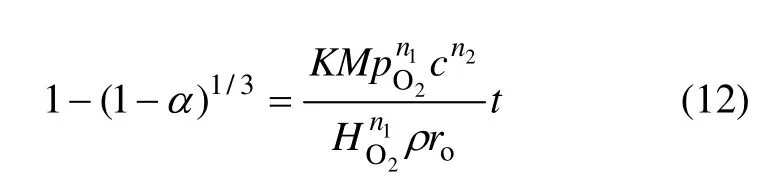
式中:HO2为亨利定律常数;k 为温度;ro为固体反应物粒度;c为酸浓度;pO2为氧分压;t为时间。
在研究一种因素时,其他因素保持恒定。式(6)与式(9)是在特别设定的条件下推导出来的[20],这些条件是:
1) 温度和水溶液中反应物种的浓度在浸出过程中保持恒定;
2) ro为一具体的常数。
因此,在进行动力学实验时,可以应用“收缩核模型”对实验结果进行处理[21]。在遵守“收缩核模型”条件的情况下,对于一个浸出过程,据式(12)有
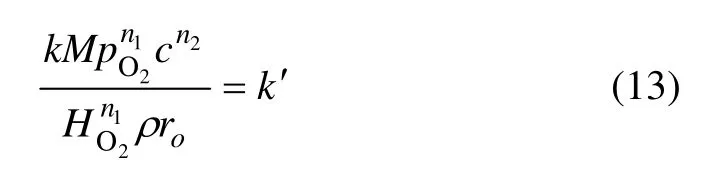
式中:k′为表观速率常数,则有

将式中左边部分用f 表示,即
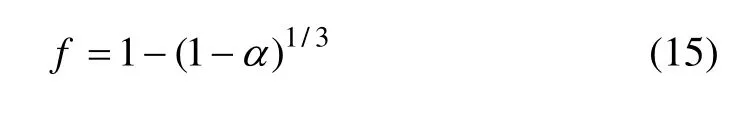
本实验的动力学研究是在满足下列条件下进行的:
1) 液体反应物或气体反应物浓度在反应过程中保持恒定。本实验中采用很大的液固比(1 L 浸出液中加入10 g 矿样),因此,在反应过程中消耗了的反应物可以忽略不计,反应物的浓度可以近似地认为是恒定的,压力也保持恒定;
2) 反应的固体是单粒级的颗粒;
3) 在反应过程中,温度与搅拌速度保持恒定。
2 实验结果与讨论
2.1 粒度对闪锌矿精矿富氧浸出动力学的影响
在温度为150 ℃,添加表面活性剂及初始酸度为50 g/L(该耗酸量为理论耗酸量的15~20 倍),氧气压力为1.0 MPa 的条件下,进行粒度对锌精矿中Zn 浸出率的影响实验。结果如图1 所示。
从图1 可见:矿样粒度对Zn 浸出率的影响显著。在粒度小于50 μm 时,Zn 浸出率可明显提高。
将图1 按照式(14)的形式进行处理得到图2。图2中各直线的斜率即为表观速率常数ks′。从图2 可以看出:随着粒度的减小,反应速率是增大。这是因为液-固反应初期扩散是控制步骤,粒度减小增加了单位质量内液固接触面积,加快了扩散速度,使反应速率提高。
图3 所示为表观速率常数ks′与粒度倒数的拟合曲线。从图3 可以得到锌精矿矿样粒度对闪锌矿浸出率的动力学方程为
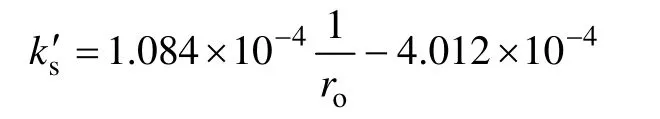
2.2 浸出温度对闪锌矿精矿富氧浸出过程的影响
反应速率与温度有关。阿仑尼乌斯(Arrhenius)公式表达了恒浓度下基元反应的速率与反应体系温度的关系:

图1 矿样粒度对Zn 浸出率的影响Fig.1 Effect of particle size on leaching rate of Zn

图2 f 与粒度关系图Fig.2 Relationship between f and particle size
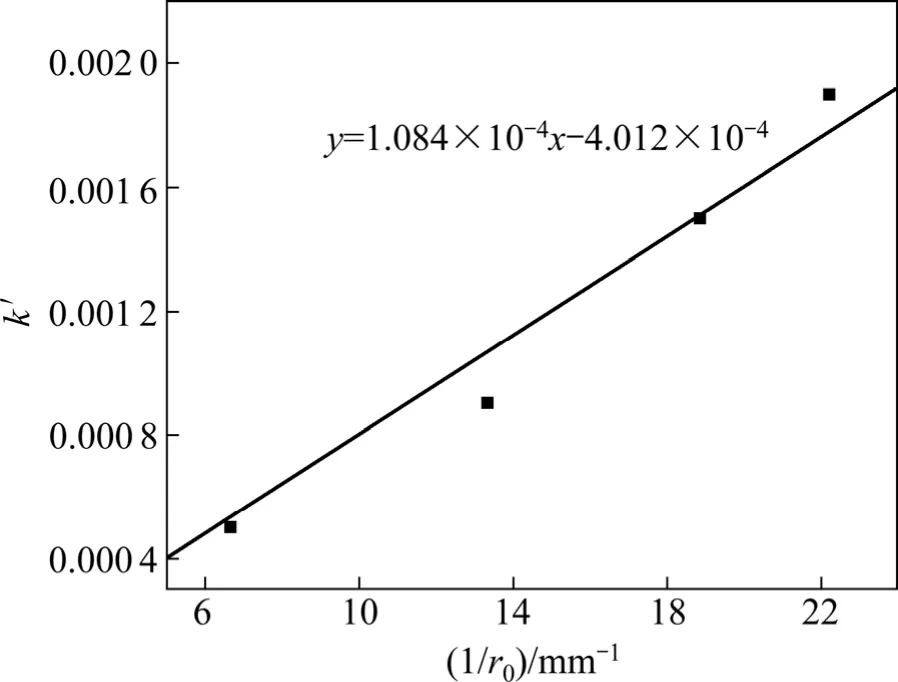
图3 ks′与1/ro 之间的关系Fig.3 Relationship between ks′ and 1/ro
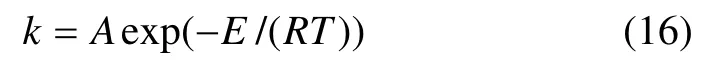
式中:k 为反应的速率常数;A 为指前因子;R 为气体常数;E 为反应活化能,J/mol。
对式(16)取对数得:
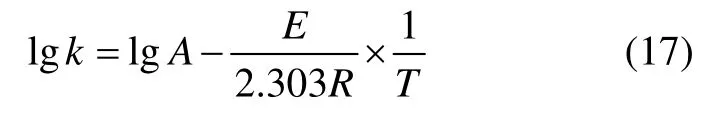
得

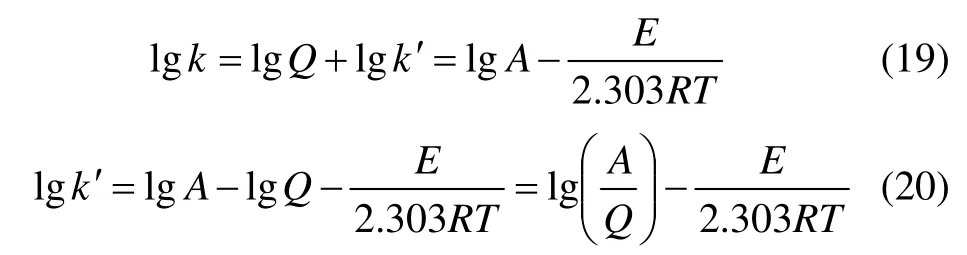
以lgk′对1/T 作图得到直线,由其斜率可求出反应活化能E。在同等条件下,温度对锌浸出性能影响结果如图4 所示。
从图4 可明显看出:随着温度的增加,Zn 浸出率不断增大,即升高温度有利于浸出反应的进行。
将图4 所示结果用式(14)处理,结果如图5 所示。图5 中各直线的斜率即为不同温度下反应的速率常数kT′。
从图4 和5 可见:随着温度的增加,反应速率增大,Zn 浸出率增大。因此,在本实验体系内,温度为主要影响因素。
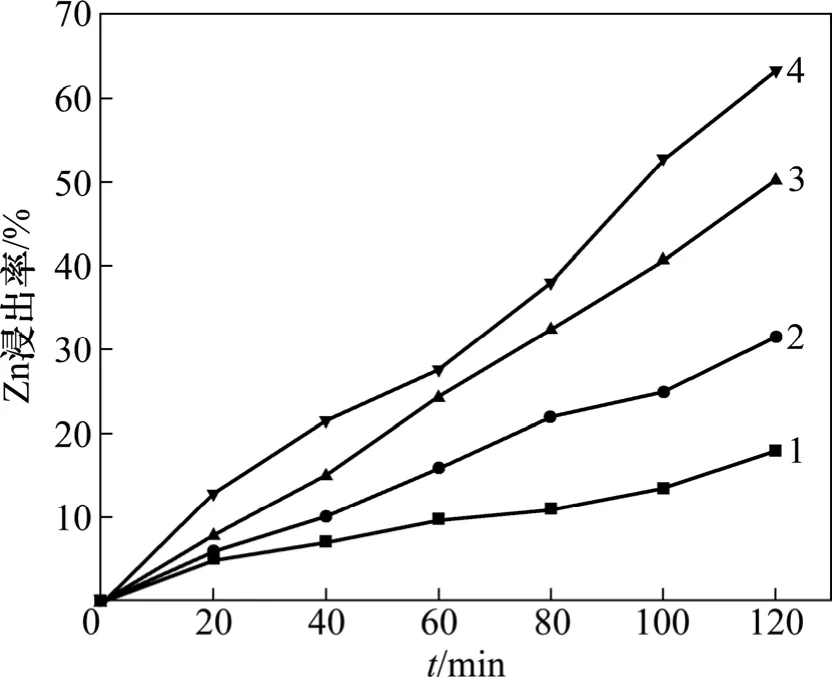
图4 浸出温度对Zn 的浸出率的影响Fig.4 Effect of temperature on leaching rate of Zn

图5 f 与温度关系图Fig.5 Relationship between f and temperature
以不同温度下反应的kT′对温度的倒数作图,可得到Arrhenius 线,如图6 所示。
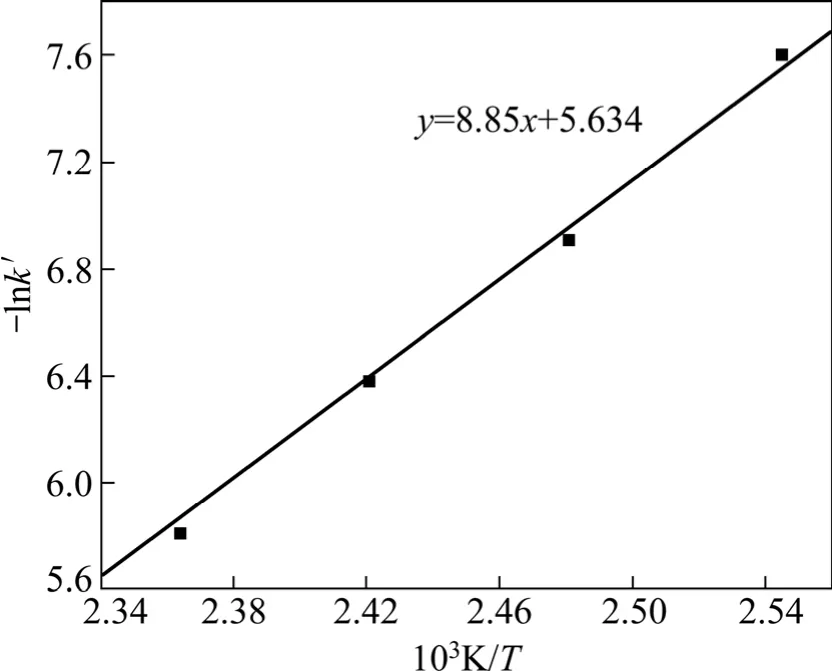
图6 Arrehenius 线图Fig.6 Figure of Arrehenius curve
2.3 初始酸度对闪锌矿精矿富氧浸出过程的影响
在同等条件下进行酸度对Zn 浸出率的影响实验。图7 所示为溶液中H2SO4浓度对Zn 浸出率的影响。
从图7 可知:随着H2SO4浓度逐渐增加,锌的浸出速率逐渐降低。为了得到酸度对表观平衡常数的影响,以式(14)的形式处理图7,得到f 与酸度关系图,结果如图8 所示。
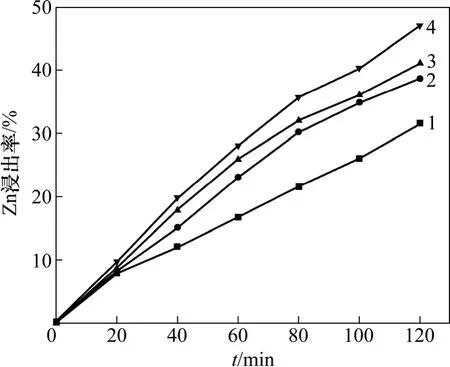
图7 硫酸浓度对锌浸出速率的影响Fig.7 Effect of initial sulfuric acid concentration on leaching rate of Zn

图8 f 与酸度关系图Fig.8 Relationship between f and initial acidity concentration
以不同H2SO4浓度下的表观速率常数取对数对酸浓度取对数作图,得到图9。
图9 表明:lnkc′与c(H2SO4)的关系为一直线,由直线斜率可求得反应的表观级数为-0.462。
由图9 得到H2SO4浓度对Zn 的浸出率影响的动力学方程为

式中:c(H2SO4)为硫酸浓度。
在正常情况下,浸出过程中随着H2SO4浓度增加,Zn 浸出速率应该逐渐增大,但图7 所示结果却恰恰相反。关于这一反常现象,Jan 等[13]只是提及,但没有进一步进行实验研究。他们认为:当实验用酸量大于理论酸耗量2 倍后,就会出现该现象,即浸出过程中随着H2SO4浓度增加,Zn 浸出速率逐步降低。从反应机理上分析,他们认为ZnS 的浸出反应是由下列反应构成:
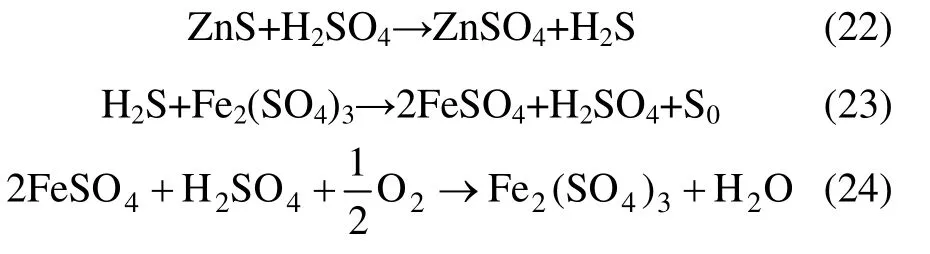
当实验用酸量大于理论酸耗量2 倍后,使反应(23)向左方进行,从而产生更多的H2S,而H2S 的产生对Zn 的浸出是起抑制作用的,所以出现随着H2SO4浓度增加,锌浸出速率逐步降低的现象。
2.4 氧分压对闪锌矿精矿富氧浸出过程的影响
在温度为150 ℃,其他条件相同的条件下,实验得到氧分压p 对浸出过程的影响规律,如图10 所示。

图10 氧分压对Zn 的浸出率的影响Fig.10 Effect of oxygen partial pressure on Zn leaching rate
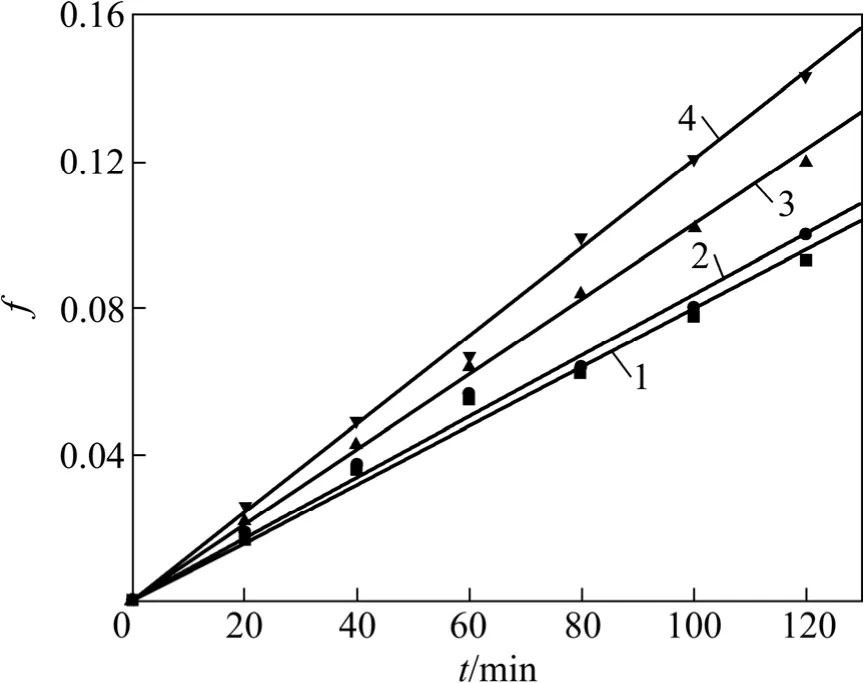
图11 f 与氧分压关系Fig.11 Relationship between f and oxygen partial pressure
将图10 按照式(14)的形式进行处理得到图11。图11 中各直线的斜率即为表观速率常数kp′。
对图12 所示曲线进行线性回归,即可得到氧分压对Zn 的浸出率的动力学方程为
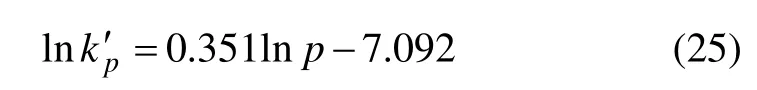
4 结论
1) 在合成闪锌矿氧压酸浸过程中,矿样粒度对金属浸出效果的影响很大,随着矿物粒度的减小,金属(Zn,Fe)浸出率升高。浸出过程速率与矿粒的初始半径ro成反比关系。
2) 合成闪锌矿浸出过程中,浸出过程由表面化学反应所控制,遵循“未反应核减缩型”的表面化学反应控制的动力学规律,其反应活化能为E=73.58 kJ/mol。
3) 初酸浓度对Zn 浸出反应的表观反应级数为-0.462。当浸出液中H2SO4用酸量大于理论酸耗量2倍时,出现随着H2SO4浓度增加,锌浸出速率逐步降低的现象。
4) 在实验所采用的参数范围内,得到精矿粒度、温度、压力、初酸浓度等单因素对Zn 浸出率的动力学方程。
氧分压方程:lnk′p=0.351lnp-7.092;
初酸浓度方程: ln kc′=-0.462lnc-6.183;
[1] 王海北, 蒋开喜, 施友富, 等. 硫化锌精矿加压酸浸新工艺研究[J]. 有色金属(冶炼部分), 2004(5): 2-5.WANG Haibei, JIANG Kaixi, SHI Youfu, et al. Study on new technology of acid pressure leaching for treating zinc sulphides[J]. Nonferrous Metals, 2004(5): 2-5.
[2] 刘洪萍. 锌湿法冶金工艺概述[J]. 金属世界, 2009(5): 53-57.LIU Hongping. Overview on hydrometallurgical zinc process[J].Metal World, 2009(5): 53-57.
[3] AKCIL A, CIFTCI H. Metals recovery from multimetal sulphide concentrates (CuFeS2-PbS-ZnS): Combination of thermal process and pressure leaching[J]. Int J Miner Process, 2003,71(1/2/3/4): 233-246.
[4] 胡建东, 许民, 蒋俊洋. 硫化锌精矿的催化氧化酸浸工艺研究[J]. 有色金属(冶炼部分), 2003(5): 21-23.HU Jiandong, XU Min, JIANG Junyang. Study on the leaching of zinc sulfide concentrate by catalyst and oxidation[J].Nonferrous Metals, 2003(5): 21-23.
[5] XU Zhifeng, JIANG Qingzheng, WANG Chengyang.Atmospheric oxygen-rich direct leaching behavior of zinc sulphide concentrate[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(12): 3780-3787.
[6] 王吉坤, 李存兄, 李勇, 等. 高铁闪锌矿高压酸浸过程中ZnS-FeS-H2O 系的电位-pH 图[J]. 有色金属(冶炼部分),2006(2): 2-5.WANG Jikun, LI Cunxiong, LI Yong, et al. The ε-pH figure of ZnS-FeS-H2O system during acid leaching under pressure of high iron sphalerite[J]. Nonferrous Metals (Extractive Metallurgy), 2006(2): 2-5.
[7] 王吉坤, 周廷熙, 吴锦梅. 高铁闪锌矿精矿加压酸浸新工艺研究[J]. 有色金属(冶炼部分), 2004(1): 5-8.WANG Jikun, ZHOU Tingxi, WU Jinmei. Study on high iron containing sphalerite concentrate by acid leaching under pressure[J]. Nonferrous Metals, 2004(1): 5-8.
[8] 高良宾, 赫冀成, 徐红江. 硫化锌精矿高温高压浸出技术[J].有色矿冶, 2007(4): 33-36.GAO Liangbin, HE Jicheng, XU Hongjiang. The technology of zinc sulphide concentrate in high-temperature and high-pressure leaching[J]. Non-Ferrous Mining and Metallurgy, 2007(4):33-36.
[9] Baldwin S A, Demopoulos G P, Papangelakis V G.Mathematical modeling of the zinc pressure leach process[J].Metallurgical and Materials Transactions B: Process Metallurgy and Materials Processing Science, 1995, 26(5): 1035-1047.
[10] Haakana T, Lahtinen M, Takala H, et al. Development and modelling of a novel reactor for direct leaching of zinc sulphide concentrates[J]. Chemical Engineering Science, 2007,62(18/19/20): 5648-5654.
[11] 陈永强, 邱定蕃, 王成彦, 等. 闪锌矿常压富氧浸出[J]. 过程工程学报, 2009, 9(3): 441-448.CHEN Yongqiang, QIU Dingfan, WANG Chengyan, et al.Oxygen-rich leaching of sphalerite concentrate under normal pressure[J]. The Chinese Journal of Process Engineering, 2009,9(3): 441-448.
[12] LIANG Duoqiang, WANG Jikun, WANG Yunhua, et al.Recovery of silver and zinc by acid pressure oxidative leaching of silver-bearing low-grade complex sulfide ores[J].International Journal of Mineral Processing, 2008, 89(1/2/3/4):60-64.
[13] Jan R J, Hepworth M T, Fox V G. A kinetic study on the pressure leaching of sphalerite[J]. Metallurgical and Materials Transactions B: Process Metallurgy, 1976, 7B(3): 353-361.
[14] Corriou J P, Gely R, Viers P. Thermodynamic and kinetic study of the pressure leaching of zinc sulfide in aqueous sulfuric acid[J]. Hydrometallurgy, 1988, 21(1): 85-102.
[15] Souza A D, Pina P S, Leao V A, et al. The leaching kinetics of a zinc sulphide concentrate in acid ferric sulphate[J].Hydrometallurgy, 2007, 89(1/2): 72-81.
[16] Weisener C, Smart R. Kinetics and mechanisms of the leaching of low Fe sphalerite[J]. Geochimica et CosmochimicaActa, 2003,67(5): 823-830.
[17] Weisener, Christopher G, Smart, Roger St C, Gerson, Andrea R.A comparison of the kinetics and mechanism of acid leaching of sphalerite containing low and high concentrations of iron[J].International Journal of Mineral Processing, 2004, 74(1/4):239-249.
[18] 华一新. 冶金过程动力学导论[M]. 北京: 冶金工业出版社,2004: 188-197.HUA Yixin. Dynamics introduction of metallurgical process[M].Beijing: Metallurgical Industry Press, 2004: 188-197.
[19] Habashi F. Discussion of kinetic study on the pressure leaching of sphalerite[J]. Metallurgical Transactions B (Process Metallurgy), 1977, 8B(4): 699-700.
[20] 刘恒, 金作美. ZnS 和ZnS/C 浸出动力学研究[J]. 有色金属,1990, 42(1): 33-41.LIU Heng, JIN Zuomei. Study on dissolution kinetics of ZnS and ZnS/C [J]. Nonferrous Metals, 1990, 42(1): 33-41.
[21] 王吉坤, 周廷熙, 吴锦梅. 高铁闪锌矿精矿加压浸出半工业试验研究[J]. 中国工程科学, 2005, 7(1): 60-64.WANG Jikun, ZHOU Tingxi, WU Jinmei. Semi-industrial tests of pressure leaching on high-iron sphalerite concentrate[J].Engineering Science, 2005, 7(1): 60-64.
