回转炉还原焙烧低品位软锰矿及其尾气资源化利用的动力学研究
2014-04-01冯雅丽周宇照李浩然蔡震雷
冯雅丽,周宇照,李浩然,蔡震雷
(1. 北京科技大学 土木与环境工程学院,北京,100083;2. 中国科学院过程工程研究所 生化工程国家重点实验室,北京,100190)
锰是一种重要的战略物资,被广泛地应用于炼钢、有色冶金、化工等领域。我国锰矿资源丰富,但大多数为中低品位软锰矿,富锰矿较少。随着富锰矿资源的开发利用,锰矿资源日益匮乏是当前我国面临的严峻问题[1-4]。传统的湿法还原及焙烧还原过程是将二氧化锰还原为酸溶性氧化锰,但存在效率低、成本高、污染环境及副反应不易控制等问题[5-6]使低品位软锰矿得不到充分利用。因此,对低品位软锰矿高效合理的利用,尤其是对其还原工艺的绿色创新是我国亟待解决的问题,对缓解我国锰矿资源紧缺、确保锰系产品行业的可持续发展以及西部经济的发展都有十分重要的战略意义[7]。本文作者利用回转炉还原焙烧软锰矿及尾气吸收再浸出装置的新工艺,炉体在工作过程中匀速旋转,实现了良好的热传导以及物料与还原剂的良好接触,还原过程产生的二氧化硫对低品位软锰矿矿浆进行两级吸收还原浸出,实现了二氧化硫尾气的资源化利用,同时在一定程度上避免了对环境造成二次污染。该研究在工艺上进行绿色创新,即在保证低品位软锰矿高效充分利用的同时,实现了反应体系硫资源的循环利用。
1 试验部分
1.1 原料特性
本次试验采用的原料为某低品位软锰矿,其化学多元素分析及X 线衍射分析见表1 和图1。
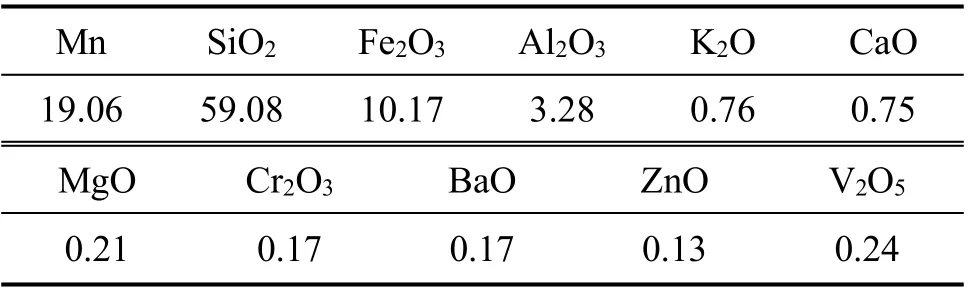
表1 原矿化学多元素分析结果(质量分数)Table 1 Chemical analysis results of multi-elements in raw ore %
1.2 试验装置
试验采用RF-1200 型回转炉。图2 所示为回转炉还原焙烧装置示意图。
1.3 试验方法
矿样经破碎及棒磨至0.4 mm,干燥脱水后称取50 g,加入一定量单质硫及浓硫酸,混合均匀后放入回转炉,将两级软锰矿矿浆接于出气口,在400 ℃下焙烧2 h,调节转子流量计流速为0.2 m3/h,产生气体由吸收瓶吸收,SO2吸收瓶温度为80 ℃。
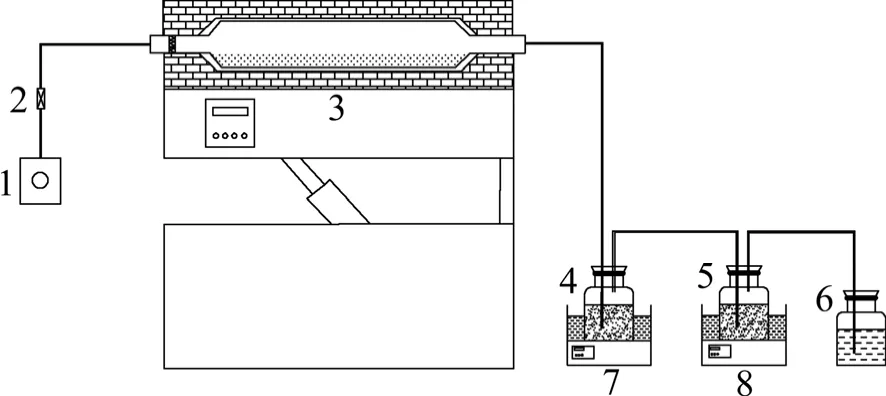
图2 软锰矿还原及尾气资源化利用装置示意图Fig.2 Sketch of manganese reductionandtail-gas resource utilization device
二氧化锰需要被还原成酸溶性的氧化锰才能浸出提取,因此,在酸足量时,锰的还原率可以通过锰的浸出率来表达。
考察不同焙烧条件及浸出条件对锰元素浸出率的影响,通过考察浸出渣中锰元素的含量,计算锰的浸出率[8]:

式中:η 为锰的浸出率,%;ρ 为浸出液质量浓度,g/mL;m 为试样质量,%;α 为试样中锰的质量分数,%;β为浸出样中锰的质量分数;V 为浸出液体积,mL。
1.4 还原焙烧、尾气资源化利用反应原理及流程
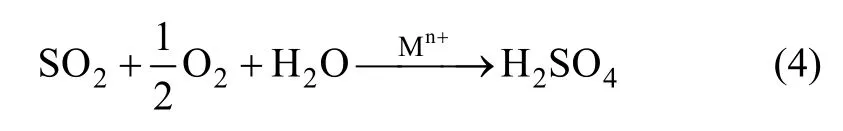
回转炉中软锰矿的还原过程主要是硫与硫酸的还原,发生的化学反应有:


物料中单质硫与浓硫酸将软锰矿中的MnO2还原为Mn2+,在一定程度上能减少硫酸的用量。硫磺作为还原剂,增大了原矿与还原剂的接触面积,提高了反应速率和效率。其中产生的二氧化硫从排气口排出继续浸出软锰矿中的锰元素,作为二次能源循环使用。
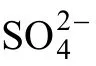
对SO2-Mn-H2O 体系进行分析,对于方式Ⅰ,溶液存在的半反应为

对于方式Ⅱ,溶液中存在的半反应为
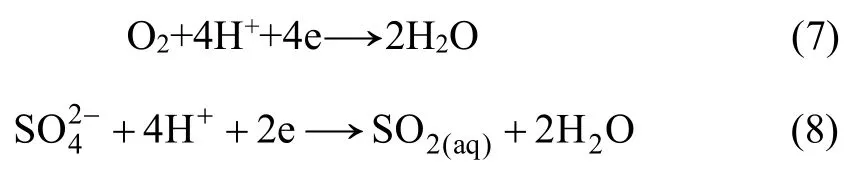
反应开始一段时间后,监测吸收瓶中pH 至反应结束,吸收瓶中pH 在2~3 范围内,于80 ℃时SO2-Mn-H2O 体系的E-pH 如图3 所示。由图3 可知:尽管存在金属离子的催化作用,但体系中MnO2的浓度要远高于O2的浓度,故该反应主要是MnO2与SO2的氧化还原反应。
通过焙烧及吸收,矿物中的Mn,Fe 及重金属元素转化为可溶性的硫酸盐。通过化学分析计算软锰矿中锰元素的还原率,并进一步除杂得到高纯硫酸锰,试验流程如图4 所示。

图3 80 ℃下SO2-Mn-H2O 体系的E-pH 图Fig.3 E-pH image of SO2-Mn-H2O system at 80 ℃
2 试验结果及分析
2.1 低品位软锰矿还原焙烧试验
2.1.1 硫酸用量的影响
将不同用量的浓硫酸分别与50 g 软锰矿进行混合,单质硫用量为5 g,在400 ℃焙烧2 h,将还原产物用水溶液浸出。本试验考察浓硫酸用量对Mn 元素浸出率的影响,结果见图5。
从图5 可以看出:按原矿中锰含量的计算,当硫酸用量为当量的150%(即14.22 g)时,锰还原率基本上不再增加,硫酸用量增加,还原剂与矿物颗粒接触面积增大,从而提高了还原速率与还原效率;还原剂增大到一定用量后达到饱和,Mn 元素还原率最大为98.32%。
2.1.2 还原温度的影响
分别将14.22 g 浓硫酸与5 g 单质硫、50 g 软锰矿混合均匀后焙烧,焙烧时间为2 h,在不同的温度下进行焙烧,然后用水溶液浸出,结果见图6。

图4 软锰矿还原及尾气吸收流程图Fig.4 Flow chartof manganese reduction in pyrolusite and tail gas absorption

图5 硫酸用量对软锰矿中锰还原率的影响Fig.5 Effect of mass fraction of sulfuricacid on manganese reduction efficiency of pyrolusite

图6 焙烧温度对锰还原率的影响Fig.6 Effect of roasting temperature on reduction rate of manganese
由图6 可知:随温度升高,锰还原率逐渐增大,在400 ℃以后基本保持不变,在400 ℃时软锰矿还原率达到96%以上,试验选取的温度不宜过高,防止二氧化锰矿脱氧生成四氧化三锰,导致还原率降低,所以,确定最佳还原温度为400 ℃。
2.1.3 焙烧时间的影响
焙烧时间也是影响软锰矿还原的一个重要因素。为考察焙烧时间对锰还原率的影响,将14.22 g 浓硫酸与5 g 单质硫、50 g 软锰矿混合均匀后,在400 ℃条件下焙烧,试验结果见图7。
由图7 可知:随时间的延长,锰还原率有明显提高,当反应时间达到120 min 时,锰矿还原率达到96%以上;随时间的进一步延长,锰还原率增加缓慢,在还原软锰矿的过程中回转炉稳定旋转,物料受热均匀,反应120 min 达到一个很好的效果;物料随着焙烧时间的增长可能会有损失,导致还原率降低。因此,确定最佳焙烧时间为120 min。

图7 焙烧时间对锰还原率的影响Fig.7 Effect of roasting time on reduction rate of manganese
2.1.4 焙烧产物分析
原矿经回转炉焙烧还原,得到产物经水浸后浸渣的化学多元素分析结果如表2 所示。

表2 浸渣化学多元素分析结果(质量分数)Table 2 Chemical analysis results of multi-elements in leaching residual %
按浸渣中锰含量计算,锰元素还原率(即浸出率)可达到98%以上,与试验结果相吻合。
2.2 尾气资源化利用试验
2.2.1 吸收矿浆液固比对锰浸出率的影响
软锰矿吸收矿浆分别为10 g,通过考察反应的液固比来确定最佳回收效果。当吸收温度为80 ℃,吸收矿浆的液固比从4:1 到10:1 变化时,锰元素还原率与液固比的关系如图8 所示。从图8 可以看出:当液固质量比为6:1 时,二级浸出率都达到98%以上;矿浆液固比太小,二氧化硫气体与液体的接触面积小,浸出效果差,随着液固质量比的增大,矿浆越稀,溶液黏度越小,二氧化硫在矿浆中的扩散速度越快[10-12],有利于反应的进行,但液固比过高时,二氧化硫在一级吸收中溶解过高,导致二级浸出率低。

图8 液固比对锰浸出率的影响Fig.8 Effect of ratio of liquid to solid on leaching rate of manganese
2.2.2 吸收温度对锰浸出率的影响
吸收温度对浸出率有很大影响,矿浆液固比为6:1,浸出时间为120 min,在70,75,80,85 和90 ℃下进行吸收温度试验,试验结果见图9。从图9 可见:在80 ℃时,一、二级锰矿浸出效果最好,当温度在90℃时,一级浸出率达到99%,但二级浸出率相对较差,这是随着浸出温度的增加降低了液体的黏度,增大了二氧化硫气体在液体中的扩散速度,且超过平均活化能的分子数也相应增加[13],在吸收过程中大部分二氧化硫气体被一级吸收瓶吸收,故一级浸出率较高,而二级浸出率相对较低。
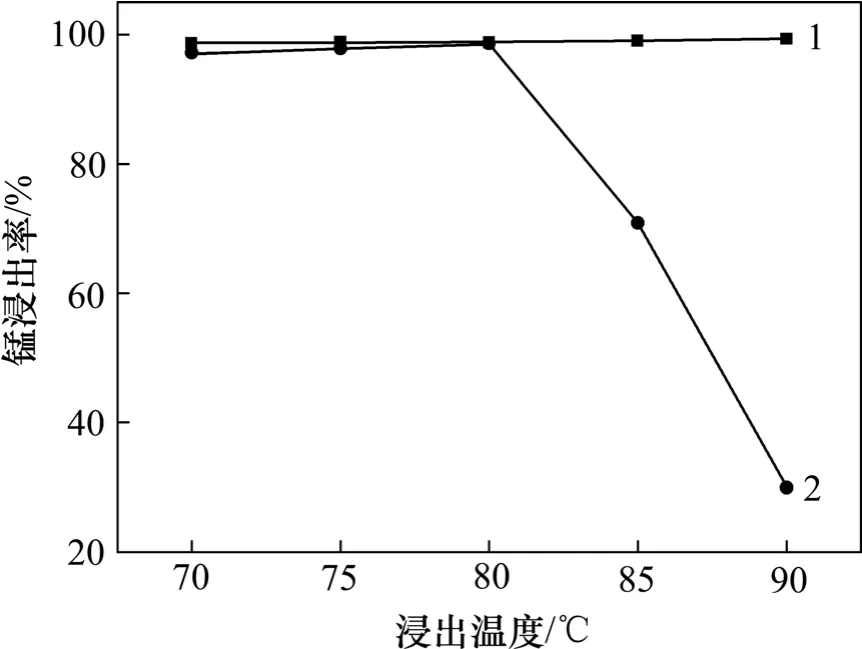
图9 浸出温度对锰浸出率的影响Fig.9 Effect of leaching temperature on leaching rate of manganese
2.2.3 浸出时间对锰浸出率的影响
吸收瓶中矿浆固液比为6:1,吸收温度为80 ℃,测定吸收时间对软锰矿浸出率的影响,根据回转炉中焙烧时间试验测定吸收瓶中软锰矿的浸出率如图10所示。从图10 可见:焙烧与浸出过程在120 min 时都达到一个最佳的效果,所以,确定时间为120 min。
As shown in Fig. 5(h), the measured reflectance peak at 1550 nm (center of the transparency window) is tuned by increasing the delay time between the pump and probe pulses by using the femtosecond laser pump and probe method. The refractive index n of the polycrystalline ITO is given by59:
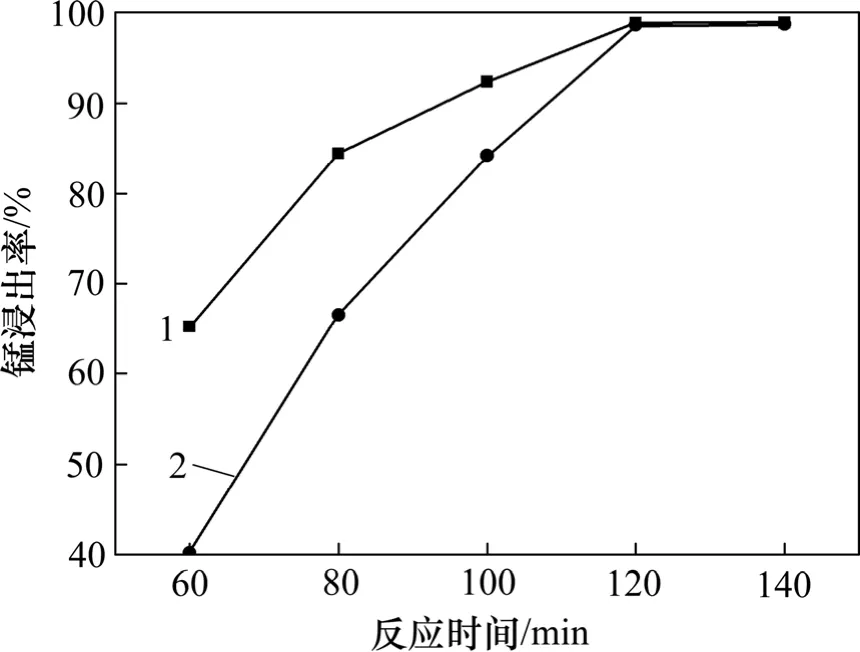
图10 浸出时间对锰浸出率的影响Fig.10 Effect of leaching time on leaching rate of manganese
3 尾气资源化利用的浸出动力学模型
绿色工艺尾气吸收一级装置中二氧化硫气流量稳定,对其建立浸出动力学模型。
根据湿法冶金动力学原理[14]推断,假设洗气瓶中软锰矿的还原属于液膜扩散控制,液固比为6:1,浸出温度分别为60,70,80 和90 ℃时,不同时间下锰元素的浸出率与克金布动力方程为
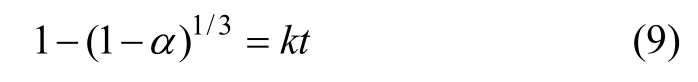
其中:α 为锰的浸出率;k 为化学速率反应常数;t为反应时间。
将不同时间下的浸出率带入式(9)并与浸出时间t作图,计算出与浸出率与k 的关系。
根据Arrhenius 公式



图11 ln k-1/T 曲线关系Fig.11 Relationship between ln k and 1/T
不同温度下软锰矿浸出率随时间变化的动力学方程式为

图12 所示为在353 K 下浸出率与浸出时间的关系。从图12 可以看出,实测所得数据与模型计算数据吻合程度较好,从而进一步证实了锰浸出反应由固膜扩散控制的理论。

图12 还原率与焙烧时间的关系Fig.12 Relationship between reduction efficiency and roasting time
4 结论
1) 采用RF1200 型真空回转炉对低品位软锰矿进行还原焙烧,并对还原焙烧过程中的尾气实现资源化利用。对工艺流程进行绿色创新,即在保证低品位软锰矿高效充分利用的同时,实现了反应体系硫资源的循环利用,为低品位软锰矿的工业化应用提供了参考与依据。
2) 浓硫酸用量为锰含量的1.5 倍,在400 ℃焙烧120 min,回转炉中软锰矿的锰还原率达到98%以上。
3) 当矿浆固液比为6:1、80 ℃下反应120 min 时,锰浸出效果最好,其一、二级锰浸出率均能达到98%以上。
4) 通过动力学分析,锰浸出反应控制属于液膜扩散控制,并计算出表观活化能为16.04 kJ/mol,该反应动力学模型为

[1] 洪世琨. 我国锰矿资源开采现状与可持续发展的研究[J]. 中国锰业,2011,29(3):13-16.HONG Shikun. Status of China Mn-ore in resources exploitation and the sustainable development[J]. China’s Manganese Industry,2011,29(3):13-16.
[2] 严旺生. 中国锰矿资源与富锰渣产业的发展[J]. 中国锰业,2008,26(1):7-11.YAN Wangsheng. The development of Mn resource and rich Mn-slag[J].China’s Manganese Industry,2008,26(1):7-11.
[3] 周凌风. 我国锰资源现状及其加工发展前景[J]. 电池工业,2011,16(1):49-52.ZHOU Lingfeng. Status in quo and processing prospect of manganese resources in China[J].Chinese Battery Industry,2011,16(1):49-52.
[4] 王尔贤. 中国的锰矿资源[J]. 电池工业,2007,12(3):184-187.WANG Erxian. The resources of Chinese manganese ore[J].China Battery Industry,2007,12(3):184-187.
[5] 谢红艳. 从软锰矿中湿法浸出锰的研究进展[J]. 中国锰业,2011,29(1):5-11.XIE Hongyan. Review on research of wet way leaching of manganese from pyrolusite[J]. China’s Manganese Industry,2011,29(1):5-11.
[6] 华毅超, 陈国松, 张红漫, 等. 工业硫酸锰湿法还原生产工艺[J]. 南京工业大学学报,2004,26(5):50-53.HUA Yichao, CHEN Guosong, ZHANG Hongman, et al.Laboratory procedure and pilot-plant scale production of industrial manganese sulfate by wet method reducing technique[J].Journal of Nanjing University of Technology,2004,26(5):50-53.
[7] 李同庆. 低品位软锰矿还原工艺技术与研究进展[J]. 中国锰业,2008,26(2):4-14.LI Tongqing. Technology of low grade pyrolusite ore reduction process and recent advances[J]. China’s Manganese Industry,2008,26(2):4-14.
[8] 李洪桂. 湿法冶金学[M]. 长沙: 中南大学出版社, 2002:92-94.LI Honggui. Hydrometallurgy[M]. Changsha: Central South University Press,2002:92-94.
[9] 朱晓帆, 蒋文举, 苏仕军, 等. 软锰矿浆烟气脱硫反应机理研究[J]. 环境污染治理技术与设备,2002,3(3):44-46.ZHU Xiaofan, JIANG Wenju, SU Shijun, et al. The study of reaction mechanism of desulfurization in flue gas with pyrolusite pulp[J]. Techniques and Equipment for Environmental Pollution Control,2002,3(3):44-46.
[10] 李军旗, 史连军, 金会心, 等. 软锰矿吸收SO2气体制取硫酸锰的实验研究[J]. 贵州工业大学学报,2003,32(5):4-7.LI Junqi, SHI Lianjun, JIN Huixin, et al. Study on producing manganese sulfate with pyrolusite absorbed industry waste-gas SO2[J]. Journal of Guizhou University of Technology, 2003,32(5):4-7.
[11] 任志凌, 朱晓帆, 蒋文举, 等. 软锰矿浆烟气脱硫动力学研究[J]. 环境污染治理技术与设备,2006,7(6):89-91.REN Zhiling, ZHU Xiaofan, JIANG Wenju, et al. Study on kinetics of flue gas desulfurization with pyrolusite slurry[J].Techniques and Equipment for Environmental Pollution Control,2006,7(6):89-91.
[12] Miller J D,Wan R Y.Reaction kinetics for the leaching of MnO2by sulfur dioxide[J].Hydrometallurgy,1983,10(2):219-242.
[13] Naik P K,Sukla L B,Das S C.Aqueous SO2leaching studies on Nishikhal manganese ore through factorial experiment[J].Hydrometallurgy,2000,54(3):217-228.
[14] 华一新. 冶金过程动力学导论[M]. 北京: 冶金工业出版社,2004:9-20.HUA Yixin. The kinetics introduction of metallurgical process[M].Beijing:Metallurgical Industry Press,2004:9-20.
[15] Piotrowski K, Mondal K, Wiltowski T, et al. Topochemical approach of kinetics of the reduction of hematite to wustite[J].Chemical Engineering Journal,2007,131(1/2/3):73-76.
