微囊藻毒素-LR对小鼠肠道消化酶的影响
2014-03-29刘鹿忆谢
刘鹿忆谢 平
(1. 华中农业大学水产学院, 武汉 430074; 2. 中国科学院水生生物研究所, 武汉 430072)
微囊藻毒素-LR对小鼠肠道消化酶的影响
刘鹿忆1谢 平2
(1. 华中农业大学水产学院, 武汉 430074; 2. 中国科学院水生生物研究所, 武汉 430072)
微囊藻毒素-LR(MCLR)是一类对动物和人类健康影响很大的蓝藻毒素。已有调查认为MCLR能导致某些胃肠道疾病, 相关实验室资料也证实 MCLR能在肠道积累并引起肠道损伤。研究对小鼠连续腹腔染毒MCLR 28d, 观察肠道病理水平及超微结构的变化, 并测定肠黏膜刷状缘膜酶活性。结果显示, 小肠绒毛受损较严重, 绒毛数量减少、部分脱落至肠腔, 固有层及黏膜下层水肿、充血; 电镜观察发现肠细胞细胞质电子密度降低, 伴有线粒体肿胀、细胞核变形现象; 肠黏膜二糖酶(蔗糖酶、麦芽糖酶、乳糖酶)、碱性磷酸酶及γ-谷氨酰转移酶活性均呈下降趋势。在亚慢性MCLR染毒条件下, 肠道的消化功能可能受到抑制, 进而导致机体对营养物质吸收不良。研究对理解蓝藻毒素引起的胃肠道不适(如恶心、呕吐、腹痛、腹泻)提供了新的证据。
微囊藻毒素; 肠道; 酶活; 超微结构
微囊藻毒素(Microcystins, 简称 MC)是一类具有生物活性的单环七肽[1], 具有强烈的肝毒性[2,3]。迄今为止, 已经发现了90多种MC的同系物[4], 其中MCLR、MCRR和MCYR是最常见、分布最多的种类, L、R和Y分别代表亮氨酸、精氨酸和酪氨酸。MCLR因其急性毒性最强受到广泛关注。目前认为MCLR最重要的致毒机制是其蛋白磷酸酶抑制作用。MCLR抑制丝氨酸/苏氨酸蛋白磷酸酶1和2A,破坏蛋白磷酸化/去磷酸化动态平衡[5], 导致蛋白质过度磷酸化, 干扰多种细胞进程并影响细胞骨架结构[6,7]。此外, 氧化应激被认为是MCLR毒性作用的另一个重要机制, 由此产生的损伤包括造成机体活性氧增加, 改变细胞抗氧化酶活性, 破坏氧化还原系统平衡, 导致脂质过氧化、细胞膜结构和功能受到损伤[8,9]。
近年来, 因误食铜绿微囊藻或摄入MCLR引起胃肠道功能紊乱的事件时有发生[10]。Ito, et al.[11]发现, 口服给药MCLR主要通过小肠吸收, 绒毛上皮及固有层显示强烈的MCLR阳性染色, 绒毛顶端严重侵蚀。许多关于鱼类经口染毒MC的报道均表明此类毒素具有肠毒性[12—14], 表现为肠细胞空泡化、肠黏膜损伤及炎性症状等。对小鼠采用气管内染毒[15]或利用肠细胞系[16]进行体外毒性试验, 也证实 MC能在肠道积累或对肠细胞产生毒性效应。无论利用何种试验模型(动物或细胞)采用何种染毒方式(经口或吸入), MCLR都能在肠道积累并对其结构产生一定的损伤, 因而肠道正常功能可能也受其影响。肠道损伤可能导致肠黏膜对营养物质消化、吸收受阻,或造成肠黏膜细菌移位和炎性反应。这些可能是微囊藻毒素污染的水源或水产品引起腹痛、腹泻及胃肠炎相关疾病的原因之一。
小肠是食物消化吸收最主要的部位, 肠黏膜绒毛上皮细胞刷状缘的消化酶在最终消化阶段处于关键地位, 其活性与肠黏膜结构完整性密切相关, 是监测小肠功能受损最敏感的指标。本研究选择与糖类和蛋白质消化相关的二糖酶及碱性磷酸酶、γ-谷氨酰转移酶作为肠黏膜刷状缘消化酶的代表。二糖酶将食物或淀粉消化物中的双糖水解为相应的单糖(葡萄糖、半乳糖和果糖), 以供机体吸收和利用。哺乳动物中蔗糖酶、麦芽糖酶和乳糖酶最重要, 因而在本研究中选择检测这三种二糖酶的活性。碱性磷酸酶与脂肪、糖类和蛋白质的吸收与运输密切相关[17,18],同时也是生物体内重要的解毒及防御系统[19,20]。γ-谷氨酰转移酶参与 γ-谷氨酰基循环及谷胱甘肽代谢,与氨基酸吸收和二肽转运有关, 该酶的活性影响机体摄取氨基酸的数量。
已有报道指出, MC染毒能引起胃肠道功能紊乱或不适, 但并未涉及相关病因[10]。结合 MC对肠黏膜显微及超微结构损伤的研究, 作者推测 MC损伤肠道正常结构的同时可能同样影响肠道的正常功能。我们选择MCLR腹腔注射Balb/c小鼠28d, 以空肠为代表, 观察肠道显微及超微结构变化, 测定黏膜消化酶活性, 以期为MCLR致肠道疾病提供部分依据。
1 材料与方法
1.1 材料与仪器
MCLR为本实验室纯化, 纯度经HPLC检测>95%。清洁级Balb/c小鼠6—8周, 体重约为20 g/只, 由武汉大学动物实验中心提供。RM2145半自动切片机为德国 Leica公司产品。BX-50光学显微镜为日本奥林巴斯公司产品。Tecnai G2 20透射电子显微镜为FEI公司产品。全波长酶标仪为 Thermo Scientific公司产品。二糖酶、碱性磷酸酶和 γ-谷氨酰转移酶测定试剂盒均为南京建成生物工程研究所产品。
1.2 剂量设置和动物处理
MCLR浓度分别为 5和 20 μg/kg, 注射量为0.2 mL/只, 对照组注射等体积生理盐水。每组平行处理6只小鼠, 连续28d腹腔注射。
1.3 取样
按照上述剂量注射小鼠, 于 29d颈椎脱臼法处死。迅速分离小肠, 选取空肠部位, 分别切取 1 cm肠段放入波恩氏液和2.5%戊二醛溶液固定。同时取10 cm左右肠段, 沿肠系膜纵向剖开, 用4℃生理盐水将内含物洗尽, 滤纸吸干水分, 再用盖玻片轻轻刮取肠黏膜, 分装在1.5 mL离心管中, 立即放入液氮速冻, 随后转入–80℃超低温冰箱冻存。
1.4 光镜样品制备及观察
小肠组织常规梯度酒精脱水, 二甲苯透明, 石蜡包埋, 连续切片, 厚度为4 μm, HE染色, 脱水封片。光学显微镜下进行观察和拍照。
1.5 电镜样品制备及观察
取小肠组织修切至 1 mm3, 1%锇酸固定, 梯度乙醇脱水, Epon812环氧树脂浸透、包埋, LKB-V超薄切片机切片, 经饱和醋酸铅双氧铀和柠檬酸铅双染色, 最后在透射电镜下进行细胞超微结构的观察与拍照。
1.6 空肠黏膜消化酶活性测定
肠黏膜刮取物按 1∶10(w/v)在冰冷的生理盐水中匀浆, 4℃, 5000 g/min离心15min, 取上清进行酶活测定。二糖酶(蔗糖酶、乳糖酶和麦芽糖酶)、碱性磷酸酶和γ-谷氨酰转移酶活性分别按照南京建成生物工程研究所试剂盒说明书测定。
1.7 统计分析
采用SPSS 16.0统计软件进行单因素方差分析(one-way ANOVA), LSD多重比较, P<0.05认为有显著性差异, P<0.01认为具有极显著差异。
2 结果
2.1 小鼠体重
在 4周试验过程中各组小鼠均未出现死亡现象。对照组及低剂量组小鼠体重稳定增长, 饮食饮水量及活动性无明显差异; 高剂量小鼠体重呈持续下降趋势, 在第2周至第3周出现饮食量骤增, 明显高于其他两组, 且小鼠表现亢奋状态, 之后饮食量有所下降, 但仍高于对照及低剂量组(Fan, et al. 未发表数据)。
2.2 病理学变化
大体病理学 对照组及低剂量组小鼠各器官表现正常, 高剂量小鼠器官普遍出现萎缩现象, 明显小于前两组。小肠变细, 个别肠道外观发黑, 疑似肠内出血(图1)。

图1 对照组及高剂量组小鼠空肠黏膜照片(a示对照组, b示20 μg/kg bw MC-LR组)Fig. 1 Pictures of jejunal mucosa in control and high dosage group mice (a. control; b. 20 μg/kg bw MC-LR)
光镜观察 对照组空肠结构完好, 小肠绒毛连贯完整、排列整齐, 绒毛表面覆盖柱状细胞, 数量众多, 与杯细胞相间排列, 各细胞大小均匀一致(图2a); 黏膜固有层结构完整, 无炎性症状(图2b)。低剂量组空肠结构与对照组无差异(图2c、图2d)。高剂量组空肠结构变化较明显, 与对照组及低剂量组相比, 绒毛稀少(图2e); 固有层及黏膜下层水肿、充血, 胞质普遍嗜酸性(图2f)。
超微结构变化 在透射电镜下, 对照组空肠上皮细胞微绒毛丰富, 细胞连接正常(图3a), 细胞核形态完整, 细胞质内含有丰富的线粒体(图3b)。与光镜结果类似, 低剂量组与对照组相比无明显变化(图3c、图3d)。高剂量组肠上皮细胞受损严重, 细胞质电子密度降低, 出现空泡化区域, 线粒体肿胀、基质丢失(图3e); 细胞核变形、核膜破裂(图3f)。
2.3 空肠消化酶活性
空肠黏膜二糖酶活性、碱性磷酸酶活性和γ-谷氨酰转移酶活性见表1。
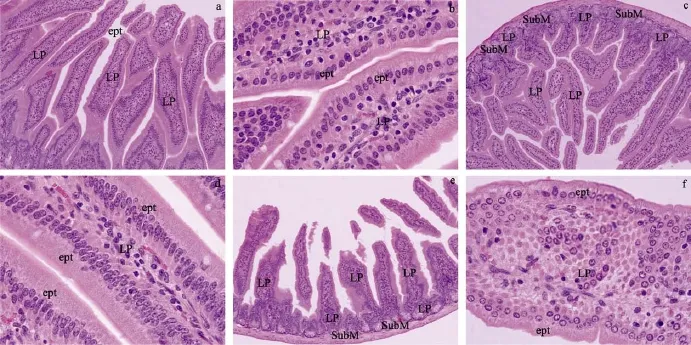
图2 不同剂量MC-LR腹腔注射染毒28d小鼠空肠HE染色切片Fig. 2 H&E stained sections of jejuna from mice injected i.p. with different dose of MC-LR after 28d

表1 MC-LR对小鼠空肠黏膜消化酶活性的影响Tab. 1 Effects of MC-LR on jejunal mucosal digestive enzyme activity of male Balb/c mice after 28 d intraperitoneal injection
与对照组相比, 低剂量组二糖酶活性均无明显变化; 相反, 高剂量组蔗糖酶、麦芽糖酶、乳糖酶活性分别下降15.40%、25.73%和22.88%(P<0.01)(图4)。
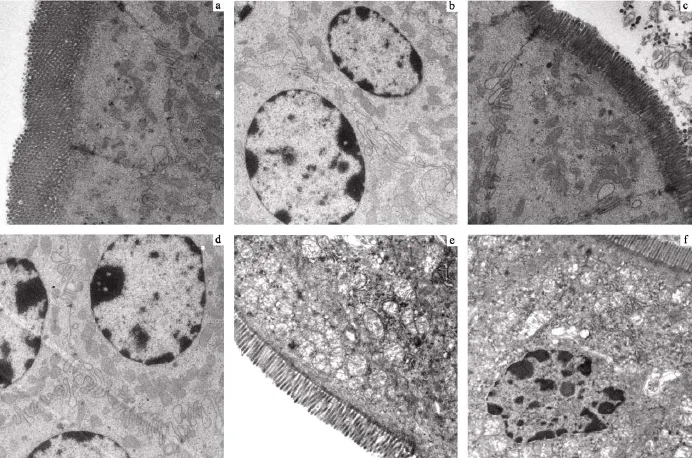
图3 不同剂量MC-LR腹腔注射染毒28d小鼠空肠超微结构(a, b. 0 μg/kg bw; c, d. 5 μg/kg bw; e, f. 20 μg/kg bw 放大倍数: 2500×)Fig. 3 Ultrastructure of jejuna from mice injected i.p. with different dose of MC-LR after 28d (a, b. 0 μg/kg bw; c, d. 5 μg/kg bw; e, f. 20 μg/kg bw magnification: 2500×)
a, c. 对照组及低剂量组线粒体丰富且完好, 细胞紧密连接; b, d. 细胞核结构完整, 周围有大量线粒体; e. 高剂量组细胞质电子密度降低, 明显的空泡化及线粒体肿胀; f. 核膜破裂、核变形, 周围的细胞质空泡化、线粒体肿胀
a, c. abundant and intact mitochondria in control and low dose group mice; b, d. nuclei in good appearance with plentiful mitochondria around; e. decreased density of cytoplasm in high dose group mice, obvious vacuolization and swollen mitochondria; f. rupture of nuclear membrane and deformation of nuclear with vacuolated cytoplasm and swollen mitochondria around

图4 MC-LR对小鼠空肠黏膜二糖酶活性的影响Fig. 4 Effect of MC-LR on jejunal mucosal disaccharidases activities of mice after 28 d i.p.
与对照组相比, ALP活性在低剂量组升高5.75%(P<0.05), 高剂量组则降低24.24%(P<0.01)(图5)。γ-GT活性在对照组和低剂量组中无明显差异;高剂量组活性降低26.91%(P<0.01)(图5)。
3 讨论
目前, 水体富营养化已成为全球范围内严重的水环境问题。水华不仅影响水体环境, 而且使水质严重恶化, 对家畜和人类健康造成威胁[21—25]。蓝藻毒素能引起一系列胃肠道疾病, 包括腹泻、呕吐、恶心和肠胃炎[10,26]。已有报道证实 MC对鱼类[12—14,27]及啮齿类[11,15,28,29]均有肠毒性, 本研究利用MCLR连续腹腔注射Balb/c小鼠28d, 观察肠道结构和功能的变化, 以期为蓝藻毒素致肠道损伤提供新的证据。
本研究中, 组织病理学检测结果和超微结构观察结果均证实MCLR暴露会引起肠道病理损伤。在本实验中发现了严重的肠道退行性变化, 高剂量组小肠绒毛数量锐减, 剥落至肠腔; 固有层及黏膜下层水肿、充血。电镜结果显示细胞质电子密度降低,空泡化严重, 线粒体肿胀、基质丢失, 核膜破裂、核变形。连续28d腹腔注射MCLR, 毒素通过肠肝循环和有机阴离子转运多肽进入小肠, 并在固有层内积累, 导致肠道不可逆损伤。
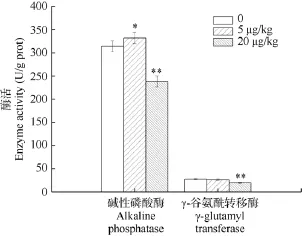
图5 MC-LR对小鼠空肠黏膜碱性磷酸酶和γ-谷氨酰转移酶活性的影响Fig. 5 Effects of MC-LR on jejunal mucosal ALP and γ-GT activities of mice after 28 d i.p.
二糖酶的活性依赖绒毛结构的完整性。酶活性结果显示, 低剂量组与生理盐水组相比无变化, 高剂量组酶活显著降低, 表明MCLR使肠黏膜结构受损, 同时降低关键酶活性, 影响糖类物质的消化。二糖酶活性受到抑制, 肠道对单糖的吸收、转化和利用降低, 可能导致血糖下降。Fan, et al. 检测本次实验中小鼠的血糖, 得出“高剂量组血糖含量显著低于对照组和低剂量组”(Fan, et al. 未发表数据), 证实了这个推测。在亚慢性染毒试验过程中, 多次反复注射使得毒素在各器官内大量积累, 以致超过机体所能承受的范围, 大量细胞凋亡、坏死, 造成器官普遍萎缩和退行性变化。小肠作为受影响器官之一,其黏膜二糖酶活性明显降低, 大量寡糖无法水解为可吸收的葡萄糖、果糖和半乳糖形式, 机体对单糖的吸收受到抑制, 使得细胞可利用糖源减少、机体供能不足, 动物表现消瘦。
除了二糖酶, 小肠黏膜上皮细胞刷状缘上还存在碱性磷酸酶和γ-谷氨酰转移酶[30]。本研究表明亚慢性MCLR染毒, 碱性磷酸酶活性在低剂量组中显著升高, 在高剂量组中极显著降低。由于受到低剂量毒素刺激, 机体可能产生了某种机制以适应染毒状态下对酶活性增加的需求, 加快相应酶促反应及生理生化进程, 降低毒素毒性或促进毒素排出。此外, 碱性磷酸酶活性的升高可能是酶蛋白本身在mRNA表达水平升高或酶蛋白的合成增加, 亦或是两方面因素的共同作用造成的, 这在回肠/结肠炎大鼠模型[31]及体外肠细胞系[32]已被证实。低剂量毒素一方面刺激机体已有的碱性磷酸酶活性升高, 另一方面可能促进肠黏膜表达更多的碱性磷酸酶, 两者结合以促进机体对毒素的降解或排除。而在高剂量组中, 肠黏膜结构受损程度超过机体所能承受范围,机体无法采取足够的应对措施以保证其正常活性,碱性磷酸酶受到抑制活性显著下降, 这种情况常常出现在较严重的病理状态下[33,34]。在我们的试验中,碱性磷酸酶活性的变化类似于毒物兴奋效应, 即高剂量致毒因素对生物体有害, 而低剂量致毒因素对生物体有益[35]。当暴露于低剂量MCLR时, 诱导机体适应性反应以产生一系列生理补偿效应, 例如增加碱性磷酸酶活性加快解毒途径; 而高剂量毒素处理对机体造成严重损伤, 机体无法有效清除毒性效应, 防御系统受到抑制。
在本研究中, 检测MCLR染毒后γ-谷氨酰转移酶活性是否发生变化, 可间接考察机体对蛋白质和氨基酸的吸收是否受到影响。结果表明, 连续腹腔注射MCLR 28d, 低剂量组γ-GT活性与对照组相比无明显变化, 而高剂量组此酶活性显著降低。高剂量组小鼠肠道 γ-谷氨酰转移酶受到抑制, 与之相关的谷胱甘肽代谢及氨基酸吸收均可能受到影响。谷胱甘肽是机体重要的抗氧化物质, 在MCLR染毒产生过量活性氧的解毒过程中发挥重要作用。高剂量小鼠肠黏膜 γ-GT活性降低, 谷胱甘肽合成受到影响,扩大了MCLR染毒对肠黏膜造成的氧化损伤。另一方面, γ-谷氨酰转移酶活性降低可能导致肠道对氨基酸的吸收受阻, 机体无法获得足够的蛋白质。在最近的一项研究中, He, et al.[36]发现MCLR能显著抑制营养物质的吸收, 尤其是氨基酸和脂类物质的吸收。MCLR通过抑制 γ-GT活性导致某些氨基酸吸收受阻, 造成腹泻或营养不良。
4 结语
通过对 Balb/c小鼠连续腹腔注射染毒 MCLR 28d发现, 肠黏膜消化酶活性受到明显抑制, 显微镜检及超微结构均表明肠道出现损伤, 说明 MCLR对肠道产生了一定的毒性效应。MCLR破坏肠道的正常结构和功能可能导致机体对营养物质的利用率降低, 造成高剂量组动物体重明显下降、普遍消瘦。日常生活中MC污染主要通过饮水、消费相关水产品或食用蓝藻保健品进入人体, 这种途径下小肠是吸收MC的主要器官, MC暴露必然影响肠道对营养物质的摄入或干扰肠黏膜免疫系统, 其对肠道的毒性效应值得进一步研究。
[1] Carmichael W W. The toxins of cyanobacteria [J]. Scientific American, 1994, 270: 64—72
[2] Li X Y, Liang J B, Huang P P. Toxic effects of microcystis cell extracts containing microcystin-LR on the blood of mice [J]. Acta Hydrobiologica Sinica, 2008, 12(6): 811—817 [李效宇, 梁俊波, 皇培培. 微囊藻细胞抽提液对小鼠血液的亚慢性毒性. 水生生物学报, 2008, 12(6): 811—817]
[3] Wu X Q, Gong Y, Wang Z, et al. Residue levels and distribution on features of microcystins in fish samples from Lake Dianchi [J]. Acta Hydrobiologica Sinica, 2010, 34(2): 388—393 [吴幸强, 龚艳, 王智, 等. 微囊藻毒素在滇池鱼体内的积累水平及分布特征. 水生生物学报, 2010, 34(2): 388—393]
[4] Ufelmann H, Krüger T, Luckas B. Human and rat hepatocyte toxicity and protein phosphatase 1 and 2A inhibitory activity of naturally occurring desmethyl-microcystins and nodularins [J]. Toxicology, 2012, 293(1—3): 59—67
[5] MacKintosh C, Beattie K A, Klumpp S, et al. Cyanobacterial microcystin-LR is a potent and specific inhibitor of protein phosphatases 1 and 2A from both mammals and higher plants [J]. FEBS Letters, 1990, 264(2): 187—192
[6] Eriksson J E, Toivola D, Meriluoto J A O, et al. Hepatocyte deformation induced by cyanobacterial toxins reflects inhibition of protein phosphatases [J]. Biochemical and Biophysical Research Communications, 1990, 173(3): 1347—1353
[7] Ohta T, Nishiwaki R, Yatsunami J, et al. Hyperphosphorylation of cytokeratins 8 and 18 by microcystin-LR, a new liver tumor promoter, in primary cultured rat hepatocytes [J]. Carcinogenesis, 1992, 13(12): 2443—2447
[8] Ding W X, Shen H M, Ong C N. Critical role of reactive oxygen species and mitochondrial permeability transition in microcystin-induced rapid apoptosis in rat hepatocytes [J]. Hepatology, 2000, 32(3): 547—555
[9] Gehringer M M, Shephard E G, Downing T G, et al. An investigation into the detoxification of microcystin-LR by the glutathione pathway in Balb/c mice [J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(5): 931—941
[10] el Saadi O E, Esterman A J, Cameron S, et al. Murray River water, raised cyanobacterial cell counts, and gastrointestinal and dermatological symptoms [J]. The Medical Journal of Australia, 1995, 162(3): 122—125
[11] Ito E, Kondo F, Harada K I. First report on the distribution of orally administered microcystin-LR in mouse tissue using an immunostaining method [J]. Toxicon, 2000, 38(1): 37—48
[12] Ernst B, Hoeger S J, O’Brien E, et al. Oral toxicity of the microcystin-containing cyanobacterium Planktothrix rubescens in European whitefish (Coregonus lavaretus) [J]. Aquatic Toxicology, 2006, 79(1): 31—40
[13] Djediat C, Moyenga D, Malécot M, et al. Oral toxicity of extracts of the microcystin-containing cyanobacterium Planktothrix agardhii to the medaka fish (Oryzias latipes) [J]. Toxicon, 2011, 58(1): 112—122
[14] Ferreira M F N, Oliveira V M, Oliveira R, et al. Histopathological effects of [D-Leu1]Microcystin-LR variants on liver, skeletal muscle and intestinal tract of Hypophthalmichthys molitrix (Valenciennes, 1844) [J]. Toxicon, 2010, 55(7): 1255—1262
[15] Ito E, Kondo F, Harada K I. Intratracheal administration of microcystin-LR, and its distribution [J]. Toxicon, 2001, 39(2—3): 265—271
[16] Botha N, Gehringer M M, Downing T G, et al. The role of microcystin-LR in the induction of apoptosis and oxidative stress in CaCO2cells [J]. Toxicon, 2004, 43(1): 85—92
[17] Toofanian F, Targowski S P. Fetal development and distribution of intestinal alkaline phosphatase in rabbit [J]. Research in Veterinary Science, 1982, 32(3):303—305
[18] Uauy R, Stringel G, Thomas R, et al. Effect of dietary nucleosides on growth and maturation of the developing gut in the rat [J]. Journal of Pediatric Gastroenterology and Nutrition, 1990, 10(4): 497—503
[19] McCracken V J, Lorenz R Z. The gastrointestinal ecosystem: a precarious alliance among epithelium, immunity and microbiota [J]. Cellular Microbiology, 2001, 3(1): 1—11
[20] Bates J M, Akerlund J, Erika M, et al. Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota [J]. Cell Host & Microbe, 2007, 2(6): 371—382
[21] Puschner B, Galey F D, Johnson B, et al. Blue-green algae toxicosis in cattle [J]. Journal of the American Veterinary Medical Association, 1998, 213(11):1605-1607, 1571
[22] Carmichael W W. Health effects of toxin-producing cyanobacteria: “The cyanohabs” [J]. Human and Ecological Risk Assessment, 2001, 7(5): 1393—1407
[23] Matsunaga H, Harada K I, Senma M, et al. Possible cause of unnatural mass death of wild birds in a pond in nishinomiya, Japan: Sudden appearance of toxic cyanobacteria [J]. Natural Toxins, 1999, 7(2): 81—84
[24] Pouria S, Andrade A, Barbosa J, et al. Fatal microcystinintoxication in haemodialysis unit in Caruaru, Brazil [J]. The Lancet, 1998, 352(9121): 21—26
[25] Azevedo S M F O, Carmichael W W, Jochimsen E M, et al. Human intoxication by microcystins during renal dialysis treatment in Caruaru--Brazil [J]. Toxicology, 2002, 181-182: 441—446
[26] Kuiper-Goodman T, Falconer I R, Fitzgerald J. Human health aspects [A]. In: Chorus I, Bartram J E (Eds.), Toxic cyanobacteria in water [C]. London: E & FN Spon. 1999
[27] Djediat C, Malécot M, Luze A, et al. Localization of microcystin-LR in medaka fish tissues after cyanotoxin gavage [J]. Toxicon, 2010, 55(2—3): 531—535
[28] Ito E, Kondo F, Harada K I. Hepatic necrosis in aged mice by oral administration of microcystin-LR [J]. Toxicon, 1997, 35(2): 231—239
[29] Botha N, Venter M, Downing T G, et al. The effect of intraperitoneally administered microcystin-LR on the gastrointestinal tract of Balb/c mice [J]. Toxicon, 2004, 43(3): 252—254
[30] Ferraris R P, Villenas S A, Diamond J. Regulation of brush-border enzyme activities and enterocyte migration rates in mouse small intestine [J]. American Journal of Physiology, 1992, 262(6): G1047—G1059
[31] Medina F S, Martínez-Augustin O, González R, et al. Induction of alkaline phosphatase in the inflamed intestine: a novel pharmacological target for inflammatory bowel disease [J]. Biochemical Pharmacology, 2004, 68(12): 2317—2326
[32] Posadas R L, González R, Ballester I, et al. Tissuenonspecific alkaline phosphatase is activated in enterocytes by oxidative stress via changes in glycosylation [J]. Inflammatory Bowel Diseases, 2011, 17(2): 543—556
[33] Tuin A, Poelstra K, Krikken A J, et al. Role of alkaline phosphatase in colitis in man and rats [J]. Gut, 2009, 58(3): 379—387
[34] Whitehouse J S, Riggle K M, Purpi D P, et al. The protective role of intestinal alkaline phosphatase in necrotizing enterocolitis [J]. Journal of Surgical Research, 2010, 163(1): 79—85
[35] Radak Z, Chung H Y, Koltai E, et al. Exercise, oxidative stress and hormesis [J]. Ageing Research Reviews, 2008, 7(1): 34—42
[36] He J, Chen J, Wu L Y, et al. Metabolic response to oral microcystin-LR exposure in the rat by NMR-based metabonomic study [J]. Journal of Proteome Research, 2012, 11(12): 5934—5946
EFFECTS OF MICROCYSTIN-LR ON THE DIGESTIVE ENZYME ACTIVITY OF INTESTINAL TRACT IN BALC/C MICE
LIU Lu-Yi1and XIE Ping2
(1. College of Fishery, Huazhong Agricultural University, Wuhan 430074, China; 2. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
Microcystin-LR has been known to harm the health in both humans and animals. Recently there has been an increase in reports about gastrointestinal ailments resulting from the ingestion of MCLR. Some data also indicated that MCLR could accumulate in the intestinal tract and cause injuries. In this study, we intraperitoneally injected mice with MCLR for 28 days, and observed the pathophysiological and ultrastructural changes. We also examined the activities of intestinal mucosal brush border membrane enzymes. Severe injuries were found in villi, such as a decrease in villi number and the exfoliation of villi into gut cavity. The cells of lamina propria and submucosa showed swell and hyperemia. In the ultrathin sections, loss of density in the cytoplasm associated with swollen mitochondria as well as nuclei deformation was observed. The activities of intestinal disaccharidase (sucrase, maltase, lactase), alkaline phosphatase, and γ-glutamyl transferase decreased after the MCLR exposure. Based on these results, we reasoned that the digestion capacity of small intestine might be inhibited after subchronic exposure of MCLR, which led to malabsorption. Our study suggested new cellular mechanisms that explain gastrointestinal sickness, such as nausea, vomiting and diarrhea, induced by cyanobacterial toxins.
Microcystin; Intestinal tract; Enzyme activity; Ultrastructure
X503.22
A
1000-3207(2014)03-0533-07
10.7541/2014.75
2013-04-16;
2014-01-12
中国国家自然科学基金(31070457)资助
刘鹿忆(1987—), 女, 江西赣州人; 硕士研究生; 主要从事微囊藻毒素分子毒理学研究。E-mail: sjtzcqn@aliyun.com
谢平, E-mail: xieping@ihb.ac.cn
