超声波对铜绿微囊藻超微结构和生理特性的影响
2014-03-29邵路路陆开宏朱津永
万 莉 邵路路 陆开宏 朱津永 杨 文
(宁波大学海洋学院, 应用海洋生物技术教育部重点实验室, 宁波 315211)
超声波对铜绿微囊藻超微结构和生理特性的影响
万 莉 邵路路 陆开宏 朱津永 杨 文
(宁波大学海洋学院, 应用海洋生物技术教育部重点实验室, 宁波 315211)
为了研究超声波对蓝藻细胞的影响, 利用超声波(40W)处理200 mL铜绿微囊藻(Microcystis aeruginosa)悬浮液20min, 之后继续培养并于不同时间取样检测。检测悬浮藻细胞生物量发现其3d降低了97.84%; 分别观察1、3、5d时沉降藻细胞超微结构变化, 发现1—3d时细胞内脂质颗粒和藻青素颗粒增多、类囊体片层断裂、藻胆体脱落, 5d时拟核区萎缩消失、细胞基础结构解体、胞质出现空洞、胞内结构颗粒降解; 检测藻细胞光合放氧速率、叶绿素a (Chl.a)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性、膜透性以及跨膜ATP酶活性, 发现光合放氧速率3d下降24.83%, Chl.a含量5d下降23.75%, 超声组细胞SOD活性变化幅度比较大, 但总体上活性降低, 而CAT活性则表现为先增后减, 活性始终大于对照组, 同时胞内有机物渗出量增大,三种跨膜ATP酶活性(Na+/K+-ATPase、Mg2+-ATPase 和Ca2+-ATPase)均先升后降, 并与膜透性变化相关。以上结果表明, 超声波使铜绿微囊藻细胞沉降, 并对其造成了胁迫, 使部分藻细胞光合作用减弱, 光合色素遭到损伤, 细胞膜透性增大, 甚至引起藻细胞程序性死亡。SOD活力的快速降低表明超声波使藻细胞内超氧离子( O2−⋅)过量累积, 从而对藻细胞造成氧化损伤, 除此之外, 超声波使藻细胞基础结构破坏、细胞内结构颗粒降解、细胞膜透性增大, 这些都可能是致使部分铜绿微囊藻细胞死亡的重要原因。铜绿微囊藻细胞CAT以及跨膜 ATP酶活性增大, 表明藻细胞增强抗氧化酶活性以及离子调控和能量活动以抵御超声波的胁迫,而当胁迫随着时间减小后, 细胞开始恢复生长和代谢, 酶活力开始降低。
超声波; 铜绿微囊藻; 超微结构; 光合作用; 抗氧化酶; ATP酶
多年来, 随着水体富营养化现象的日趋严重,频繁暴发的蓝藻水华已经成为严重影响生态环境和人类健康的全球性社会经济问题。尽管目前已经开发出多种治理蓝藻水华的措施, 包括物理打捞、喷洒化学除藻剂、黏土絮凝以及生物操纵等。但是这些除藻方法在经济性、安全性和高效性等方面仍存在局限性, 甚至会造成二次污染。而超声除藻由于其操作简便、能耗低, 无二次污染等特点被认为是极具潜力的治藻技术, 同时也是近年来的研究热点[1—4]。国内外研究均证实一定时间的超声处理可以有效抑制藻类繁殖, 且与其他除藻方式的有机结合能够达到更理想的抑藻效果[5—8]。尤其对具有伪空泡的蓝藻,如微囊藻、超声对其的抑制作用更为明显。研究显示在超声辐射后, 微囊藻的沉降率明显高于其他藻类[9]。一般认为主要是由于其内部存在大量气囊, 在超声波的空化效应下, 气囊受到巨大的压力而破裂,导致微囊藻丧失了浮力调节机能, 进而下沉[10]。然而超声波对微囊藻的抑制作用不仅只是简单的物理沉降过程, 而是一个复杂而缓慢的生理生化影响过程。近年来, 关于超声波对铜绿微囊藻细胞生理生化特性影响的研究只有零星报道, 研究认为超声波能够有效破坏藻细胞吸收光能的天线复合物和叶绿素, 减慢光合作用, 从而抑制细胞生长[11]; 并且诱导藻细胞发生脂膜过氧化反应, 增加膜透性[9]。但关于超声波对铜绿微囊藻细胞超微结构以及酶活性影响的研究尚未见报道, 对微囊藻细胞抵御超声波胁迫具体的响应机制了解甚少, 一定程度阻碍了超声波除藻技术的发展。为此, 本研究通过观察超声处理后铜绿微囊藻细胞超微结构的变化, 并结合藻细胞光合作用、抗氧化酶以及ATP酶等理化特性的变化,旨在阐释超声波对藻细胞的影响以及藻细胞抗氧化酶体系和跨膜ATP酶的响应机制, 为超声波抑制微囊藻水华技术提供理论支持。
1 材料与方法
1.1 试验生物材料
铜绿微囊藻(Microcystis aeruginosa FACHB-905),属于蓝藻门(Cyanophyta)色球藻目(Chroococcales)微囊藻属(Microcystis), 单细胞形态, 购于中国科学院水生生物研究所。单种培养于光照培养箱(GXZ-268D,宁波江南仪器厂), 温度(25±0.5) , ℃ 光暗比 12L∶2D, 光照强度为2000 lx, 培养基为BG-11培养液。实验采用对数生长期的藻细胞, 密度约为 2×107个/mL, 实验开始时用 BG-11培养基将微囊藻悬浮液稀释至起始浓度约为2.45×104个/ mL。
1.2 实验方案
实验用超声波(40W)由超声装置(Poolsonic, Tomas Electronics BVBA, Belgium)通过一个圆柱形探头发射出, 探头半径2.5 cm, 高15 cm。每组实验, 200 mL藻液装入500 mL烧杯中, 超声探头用酒精棉反复擦拭消毒后插入藻液液面下 1 cm辐射20min。在超声辐射后, 将藻液装入250 mL锥形瓶中, 并培养于光照培养箱, 以此作为超声组(Ug)。以不做超声处理的藻液作为对照组(Cg), 培养于相同条件下。实验所用玻璃器皿均高压灭菌后烘干备用,并在无菌状态下操作实验。
1.3 藻细胞超微结构的观察
分别收集超声组和对照组培养1、3、5d的藻细胞, 用4% 戊二醛及1% 锇酸各固定2h, 之后再用各级浓度(30%、50%、70%、80%、90%、100%)丙酮脱水, 每级15min。脱水后的样品用Epon815 树脂在 60℃包埋 2h。包埋块用超薄切片机(LKB-V, LKB, Sweden)切片, 切片经醋酸双氧铀-柠檬酸铅双染色后, 用透射电镜(JEM-1200EX, JEOL, Japan)观察并拍照。
1.4 生理指标测定方法
藻细胞超声处理前即对相关理化指标进行测定作为0d检测指标, 经20min超声处理后分别于0.25、0.5、1、3、5d离心取样检测各项指标。悬浮藻细胞生物量采用紫外-分光光度计(WFZ UV-2000, 龙尼柯(上海)仪器有限公司)测量藻悬液在波长560 nm处的光密度值, 即以OD560表示悬浮藻细胞生物量; 叶绿素a测定采用Hao, et al.的方法[10], 实验测定全部藻细胞叶绿素a含量; 光合放氧速率采用液相氧电极(Oxytherm, Hansatech Instrument Ltd., U.K.)测定;细胞膜透性的测定参照谢田和徐中际的紫外吸收法[12]并加以改进, 即取适量藻液, 用冷冻离心机(Biofuge Primo R, Thermo Scientific, Germany) 4 ℃, 3000 r/min低温离心10min后取上清液于264 nm波长下测定吸光值, 以OD264值表示细胞内有机物渗出量测定细胞膜透性。
藻细胞酶提取液的制备: 4000 r/min离心收集藻细胞, 以0.05 mL/L磷酸盐缓冲液作为悬浮液(其中ATP酶液的制备采用超纯水做为悬浮液), 在–20℃和4℃下进行反复冻融。在–20℃下分别冷冻1、2、3、6h后, 于4℃解融, 每组反复冻融6次, 将破碎得到的提取液离心(10000 r/min, 4 ℃ ) 20min 后, 收集上清液, –20℃保存待测。采用南京建成生物工程研究所酶试剂盒测定各种酶活力。
1.5 数据处理
数据统计分析在 SPSS 17.0统计软件上进行,不同处理之间差异采用独立样本 T检验统计分析, P<0.05为差异显著, P<0.01为差异极显著。每组实验重复三次, 文中数据均为各次实验平均值。文中用 Origin 8.0进行绘图, 图中误差棒表示标准偏差(SD)。
2 结果
2.1 超声波对悬浮铜绿微囊藻细胞生物量的影响
在超声处理后, 悬浮铜绿微囊藻细胞生物量的变化如图1所示。超声组悬浮藻细胞生物量在超声后 0.25d便显著下降, 约为初始值的 15.55%, 至3d时降为最低, 仅为初始值的 2.16%, 而对照组藻细胞随着培养时间的延长不断增加, 5d时藻细胞生物量增加了38.52%, 说明超声波能够使铜绿微囊藻细胞沉降。此外, 超声组悬浮藻细胞在5d 时又略微上升为初始值的 5.17%, 则说明经过一段时间的培养, 部分藻细胞可能开始恢复生长。
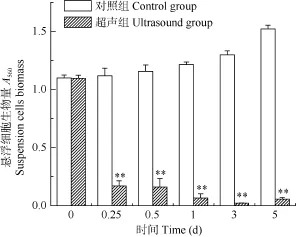
图1 超声波对悬浮铜绿微囊藻细胞生物量的影响Fig. 1 The effect of ultrasound on biomass of suspension M. aeruginosa cells
2.2 超声波对铜绿微囊藻细胞超微结构的影响
分别在1、3、5d取底部沉降的藻细胞进行处理并运用透射电镜观察。图片显示部分底部藻细胞出现了调亡现象, 铜绿微囊不同阶段的凋亡特征如图2。对照组藻细胞细胞壁完整, 外形规则; 类囊体光合片层结构丰富并且排列整齐; 高电子密度的藻胆体均匀依附于类囊体周围; 胞质中分布着少量的多磷酸体、多面体以及脂质颗粒等(图2A1、A2)。与对照组相比, 超声处理后的藻细胞超微结构变化明显, 而且随着培养时间的延长损伤加剧。1d后, 类囊体变得分散, 并有部分断裂; 依附于类囊体片层的藻胆体减少, 分散在胞质中; 此外, 胞质中脂质颗粒增多, 并出现藻青素颗粒、间体等内含物(图2B1、B2); 3d后, 核质开始向四周扩散, 类囊体和藻胆体进一步减少(图2C1、C2); 5d时, 藻细胞萎缩变形, 出现了明显的质壁分离现象, 但细胞壁仍保持完整; 胞质中的基础结构变得模糊甚至消失; 拟核区出现大片空洞; 藻青素、脂质等颗粒物质也开始降解(图2D1、D2)。

图2 超声波对沉降铜绿微囊藻细胞超微结构的影响Fig. 2 The effect of ultrasound on ultrastructure of sedimentary M. aeruginosa cells
2.3 超声波对铜绿微囊藻细胞光合作用的影响
光合放氧速率是衡量藻细胞光合作用状况的重要指标, Chl.a是铜绿微囊藻光合作用最主要的色素,它们都对光合作用系统起着至关重要的影响。因此,为了阐明超声波对藻细胞光合作用的影响, 检测了铜绿微囊藻细胞光合放氧速率和 Chl.a含量的变化(图3)。发现超声组藻细胞的光合放氧速率随着时间不断降低, 3d时降至最低, 仅为初始值的75.17%, 5d时略有升高, 而对照组光合放氧速率不断上升(图3A)。超声组Chl.a含量在处理后1d内变化不明显,甚至有小幅的波动, 3d时才明显下降, 到5d时下降了 23.75%, 而对照组的 Chl.a含量则不断增加(图3B)。这表明超声波减弱铜绿微囊藻的光合作用, 破坏光合作用色素。但光合放氧速率在5d后又略微上升, 则说明藻细胞可能存在某些响应机制抵御超声胁迫进而恢复代谢。
2.4 超声波对铜绿微囊藻细胞抗氧化酶活性的影响
从图4A可以看出, 超声处理后的藻细胞SOD活性先升高, 之后迅速降低, 1d时SOD活性达到最低, 为 21.47 U/mg蛋白, 比同期对照组低 31.32% (P<0.05)。而第3天时SOD活性又迅速升高至29.32 U/mg 蛋白, 之后再持续下降, 5d时超声组比对照组低26.15% (P<0.05)。CAT活性的变化则与SOD有所不同, 0—0.25d CAT活力显著升高, 之后上升趋势趋缓, 但在1d后又上升明显, 至3d时最高, 为同期对照组的4.5倍(P<0.01)(图4B)。综观以上结果,超声组细胞SOD活性变化幅度比较大, 但总体上活性降低, 而 CAT活性则表现为先增后减, 活性始终大于对照组。
2.5 超声波对铜绿微囊藻细胞膜透性和跨膜 ATP酶活力的影响
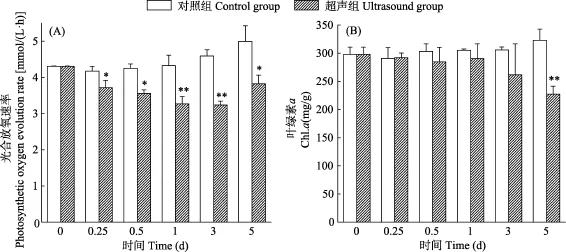
图3 超声波对铜绿微囊藻光合放氧速率(A)和Chla (B)的影响Fig. 3 The effect of ultrasound on photosynthetic oxygen evolution rate (A) and Chlorophyll a (B) of M. aeruginosa

图4 超声波对铜绿微囊藻SOD (A)和CAT (B)活性的影响Fig. 4 The effect of ultrasound on SOD (A) and CAT (B) activities of M. aeruginosa
在超声处理之后, 检测了培养液中有机质的渗出量(图5)。超声20min后, 从0.5d开始, 超声组藻细胞有机物渗出量分别比对照组高 47.17%、64.81%、52.73%和30.52%, 1d时膜透性最大。而对照组的渗出量无明显变化。说明超声波处理增大了藻细胞膜透性。
超声波处理还明显提高了铜绿微囊藻细胞膜上ATP酶活性(表 1), 1d时以上三种 ATP酶(Na+/K+-ATPase 、Mg2+-ATPase 和Ca2+-ATPase)活性均达到最高(分别是对照组的2.47、2.02、1.37倍), 之后缓慢降低, 但始终高于对照组和初始值。而对照组ATP酶活性无明显变化。值得一提的是, 细胞膜透性和ATP酶活性变化趋势相似。通过Pearson相关分析发现膜透性与 Na+/K+-ATPase、Mg2+-ATPase和Ca2+-ATPase活性的相关系数分别为 0.94 (P<0.05)、0.945(P<0.05)、0.991(P<0.001), 这说明细胞膜透性与ATP酶活性之间显著性相关, 特别与Ca2+-ATPase活性之间极显著相关。

图5 超声波对铜绿微囊藻细胞膜透性的影响Fig. 5 The effect of ultrasound on cell membrane permeability of M. aeruginosa
3 讨论
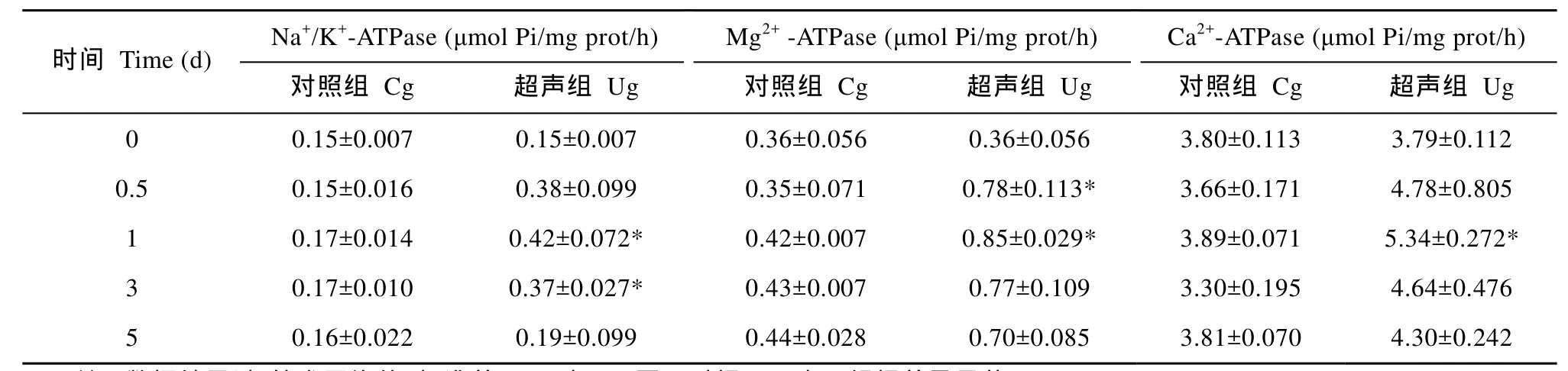
表1 超声波对铜绿微囊藻细胞ATP酶活力的影响Tab. 1 The effect of ultrasound on ATPase activity of M. aeruginosa
3.1 超声波对铜绿微囊藻超微结构和光合作用的影响
在实验条件下, 超声波在短时间内迅速沉降了水体中悬浮铜绿微囊藻细胞, 仅 0.25d生物量就下降了85% (图1)。悬浮藻细胞迅速沉降水底的最主要原因是超声波的空穴效应破坏了藻细胞内的气囊结构, 使其不能悬浮, 进而下沉[10]。为了更深入了解超声波对铜绿微囊藻细胞结构的影响, 研究了底部沉降的藻细胞超微结构的变化, 发现部分藻细胞受到明显损伤。在藻细胞遭遇环境胁迫时, 胞内通常会出现一些特殊的内含物颗粒, 最典型的就是藻青素颗粒和脂质颗粒等[13,14]。在本研究中, 超声波处理后的底部藻细胞内脂质颗粒增多(图2), 出现藻青素颗粒, 这表明铜绿微囊藻细胞遭到了超声波的胁迫。不仅如此, 藻细胞的类囊体片层也逐渐断裂(图2), 而类囊体是铜绿微囊藻细胞光合作用的主要场所, 全部或几乎所有的 Chl.a及许多类胡萝卜素都在类囊体片层内[15]。藻胆体附着在类囊体片层表面, 是吸收光能的天线复合物, 并将吸收的光能传递给 Chl.a, 是光合作用能量吸收和传递的功能单位[16]。在超声波处理后, 部分藻细胞的藻胆体脱离类囊体, 分散在胞质中, 导致光合作用电子传递链遭到破坏, 势必会减弱光合作用。因此这也是本试验中的藻细胞光合放氧速率降低的重要原因之一(图3A)。Zhang, et al.[11]用25 kHz, 0.32 W/mL超声波处理铜绿微囊藻5min, 结果发现光合放氧速率降低了 40.5%, 而且还发现藻胆体中的藻蓝蛋白活性和Chl.a含量分别降低了44.8%和21.3%。Lee, et al.[2]用28 kHz, 120 W超声波处理藻细胞30 s, 也发现Chl.a含量下降20%。而在本研究中, Chl.a含量也减少了 23.75% (图3B), 这说明超声波不仅破坏电子传递链, 还会损坏光合色素, 进一步抑制光合作用。此外, Chl.a在培养3d后才明显减少, 出现上述现象的原因可能是 Chl.a位于类囊体片层内, 类囊体膜对其起到了一定的保护作用, 随着类囊体逐渐断裂, Chl.a才逐步受到损伤。
另外, 超声处理后受损伤的铜绿微囊藻细胞亦出现拟核区逐渐萎缩消失、胞内基础结构解体, 胞质空洞化、细胞膜损伤、质壁分离等现象, 而且到5d时, 胞内的藻青素、脂质颗粒等也开始降解(图2)。Hong, et al.[17]研究芦竹碱对铜绿微囊藻的抑制作用, 发现藻细胞超微结构发生明显变化, 如类囊体断裂, 藻胆色素减少, 脂质小球和藻青素颗粒先变多之后再被溶解, DNA断裂成碎片等, 并认为芦竹碱导致铜绿微囊藻出现细胞程序性死亡。郭莎莎等[18]研究铜绿微囊藻细胞死亡过程中形态和生理变化, 在黑暗限气条件下, 发现类囊体等细胞内部结构解体、藻细胞出现空泡、胞质固缩形成结构颗粒,但细胞壁完整等与真核细胞程序性死亡类似的特征,并据此推测原核藻细胞与真核细胞一样具有程序性死亡机制。而在后生动物细胞程序性死亡过程中,也可以观察到染色质浓缩, 随后断裂成小片段; 核膜及细胞膜内陷, 细胞支架断裂, 形成凋亡小体等形态学特征变化[19]。因此, 有研究者用“类凋亡”(Apoptosis-like)来描述藻类的这种类似细胞死亡方式[20]。据本研究中超微结构形态变化推断, 超声波胁迫可能导致部分铜绿微囊藻细胞程序性死亡或是“类凋亡”。在本试验中, 超声波沉降了 90%以上的悬浮藻细胞, 而光合放氧速率和 Chl.a含量只降低了 20%—30%, 而且观察沉降藻细胞的超微结构时,也发现只有部分藻细胞凋亡。推测原因可能是藻细胞具有某些防御体系抵御超声波的胁迫, 致使只有部分藻细胞的光合作用系统和细胞结构受到损伤。而未受损伤的藻细胞, 会随着培养时间的延长, 逐渐恢复生长和代谢(图1、图3A)。Lee, et al.[21]就曾发现在光照条件下, 蓝藻细胞在超声波处理 1—3d内能重新生成气囊, 恢复浮力。这也从另一方面印证了以上推测。
3.2 超声波对铜绿微囊藻抗氧化酶的影响
超声波作为一种物理刺激, 具有多种生物效应, 最明显的便是破裂介质中的气泡形成空穴作用, 气泡中的能量释放从而产生超氧离子(⋅)、羟基离子(OH–)以及过氧化氢(H2O2)等活性氧(ROS)分子[22—24]。ROS水平升高会导致细胞氧化损伤或死亡。为了抵御氧化胁迫, 藻细胞在进化过程中形成了一系列复杂的抗氧化防御体系。SOD和 CAT是抗氧化酶体系中两种重要的酶, 对氧化胁迫造成的细胞损伤具有很强的防御和保护功能。SOD是细胞对抗ROS的第一道防线[25], 主要将细胞内过量的⋅歧化为 H2O2和 H2O。在本研究中, 超声之后的藻细胞 SOD活性变化幅度较大, 但总体上活性降低。一般认为, 当细胞内自由基含量增加时, 抗氧化酶活力也会升高; 但过量的自由基则会破坏抗氧化酶体系, 使其活性降低[26]。这意味着超声波致使藻细胞内⋅过量累积, SOD不能及时清除导致其活性降低, 使藻细胞造成氧化损伤。这也可能是超声波致使铜绿微囊藻细胞凋亡的重要原因之一。值得一提的是, 在本研究中, 超声波胁迫后的藻细胞, SOD活性在第 3 天时有明显的恢复现象(图4A)。Chen, et al.[22]研究了免疫金定位 紫 球 藻(Porphyridium cruentum), 即超声辐射60s后, 藻细胞SOD活力增加了49.8%。Al-Hamdani, et al.[24]用20 kHz, (16—18)W 的超声波辐射极大螺旋藻(Spirulina maxima) 5s, 发现藻细胞SOD活性下降。可以发现, 本试验结果与以上研究有差异, 出现此现象的原因之一可能是不同种类藻细胞 SOD对超声波的响应机制不同。此外, 超声波的频率、功率以及作用时间不同也是影响因素之一。另外, 不同离子结合形态的SOD酶对ROS的响应机制也有所不同。Bridges 和 Salin[27]就曾发现 H2O2对 Cu-Zn SOD和Fe-SOD有抑制作用, 而对Mn-SOD则无明显的作用。这说明SOD对超声波的响应可能具有藻细胞种群特异性以及酶形态特异性。
藻细胞中CAT主要将H2O2歧化为H2O和O2,防止过量的H2O2破坏细胞结构。在本研究中, 超声处理后的藻细胞CAT活力逐渐增大, 表明胞内H2O2含量增加, 这与Chen, et al.[21]的研究结果类似。在细胞内, 除了SOD歧化⋅生成H2O2外, 其他如胺氧化酶、过氧化物酶、草酸氧化酶也能歧化产生H2O2[28]。由于在本试验中 SOD活性降低, 1d后的H2O2可能来源于以上酶反应。Hong, et al.[29]研究显示, 1 mg/L浓度的2-甲基乙酰乙酸乙酯(EMA)增强铜绿微囊藻细胞CAT活性, 但随着培养时间的延长,CAT活力开始下降。同样的变化亦发生在 Cu2+和Zn2+胁迫下的巴夫藻(Pavlova viridis)细胞中, 并认为细胞增强抗氧化酶活性以抵御金属离子引起的氧化胁迫[30]。在本研究中, 铜绿微囊藻CAT活性也出现先上升后降低的趋势变化, 表明超声波胁迫激活了藻细胞抗氧化防御机制, 以降低H2O2对细胞结构的氧化伤害。然而, 随着培养时间的延长, 部分未受损伤的藻细胞开始恢复生长与代谢(图1、图3A), 表明氧化胁迫减小, 因此, CAT活性也开始下降恢复至正常水平。
3.3 超声波对铜绿微囊藻膜透性和ATP酶的影响
一般认为, ROS能破坏细胞内的某些成分和功能结构, 最明显的就是诱导细胞膜上不饱和脂肪酸发生过氧化反应。此外, 超声波空穴效应也能生成高强度的液体剪切力撕裂细胞膜[31]。以上两个因素均会导致超声波增大藻细胞膜透性。在本研究中,超声处理后的铜绿微囊藻细胞有机物渗出量增大,表明细胞膜透性增大。同时, Tang, et al.[9]和Chen, et al.[22]研究超声波对铜绿微囊藻细胞膜透性的影响, 也发现了相似的结果。
ATP酶是细胞膜上依赖于ATP的离子调控蛋白酶, 对维持细胞膜电位以及细胞内外环境渗透压的平衡有着重要作用。那么, ATP酶活性与细胞膜透性之间是否有联系?研究显示, 超声波处理人参细胞[23]或纤维细胞[32]后, 出现细胞内 Ca2+浓度增加, K+外流等现象。Honda, et al.[33]利用1MHz, 4.9 W/cm2的超声波辐射人骨髓单核淋巴瘤细胞, 也发现了相似的现象并认为Ca2+增加是由于非特异性的细胞外涌入。而Kumon, et al.[34]则推测认为超声波造成细胞膜上出现非特异性小孔是引起 Ca2+增加的部分原因。据此推测超声波在增大细胞膜透性的同时亦会增加膜内外离子流动性。在本研究中, ATP酶活性与细胞膜透性的显著相关性也印证了以上观点。膜内外离子流动会破坏细胞渗透压平衡, 另外, 细胞内过多的 Ca2+累积亦会引起细胞中毒, 甚至调亡[32]。因此, 为了维持细胞内外渗透压平衡以及抵御 Ca2+胁迫, 跨膜ATP酶活性增强。Liu, et al.[35]研究显示, 20 kHz、(2—10)W的低强度超声波作用于芦荟愈伤组织细胞(2—10)s, Ca2+-ATP酶活性增大。Chen, et al.[22]对紫球藻的研究显示, Na+/K+-ATPase和Ca2+/Mg2+-ATPase活性分别增加了67.7%和69.3%。在本研究中, 超声组铜绿微囊藻细胞的 3种 ATP酶(Na+/K+-ATPase、Mg2+-ATPase 和 Ca2+-ATPase)活性均表现出先升后降的趋势, 总体水平始终高于对照组(表 1),这说明铜绿微囊藻细胞增强离子调控和能量活动以抵御超声波所引起的胁迫, 而随着胁迫的逐渐减小, ATP酶活性亦开始降低。
综上所述, 超声波不仅使铜绿微囊藻沉降, 并对藻细胞造成了胁迫, 使部分藻细胞光合作用减弱,光合色素遭到损伤, 并增大细胞膜透性, 甚至引起藻细胞程序性死亡。SOD活力的快速降低表明超声波使藻细胞内2O−⋅过量累积, 从而对藻细胞造成氧化损伤。除此之外, 超声波使藻细胞基础结构破坏、细胞内结构颗粒降解、细胞膜透性增大, 这些都可能是导致部分铜绿微囊藻细胞死亡的重要原因。铜绿微囊藻细胞CAT以及跨膜ATP酶活性增大, 表明藻细胞增强抗氧化酶活性以及离子调控和能量活动以抵御超声波的胁迫, 而当胁迫随着时间减小后,细胞开始恢复生长和代谢, 酶活力开始降低。
[1] Ahn C Y, Park M H, Joung S H, et al. Growth inhibition of cyanobacteria by ultrasonic radiation: laboratory and enclosure studies [J]. Environmental Science & Technology, 2003, 37(13): 3031—3037
[2] Lee T J, Nakano K, Matsumara M. Ultrasonic irradiation for blue-green algae bloom control [J]. Environmental Technology, 2001, 22(4): 383—390
[3] Zhang G, Zhang P, Wang B, et al. Ultrasonic frequency effects on the removal of Microcystis aeruginosa [J]. Ultrasonics Sonochemistry, 2006, 13(5): 446—450
[4] Shao L L, Lu K H, Zhu J Y, et al. Study on growth inhibition of Microcystis aeruginosa by low intensity ultrasonic [J]. Ecological Science, 2012, 31(4): 413—417 [邵路路, 陆开宏, 朱津永, 等. 低强度超声波抑制铜绿微囊藻生长的研究. 生态科学, 2012, 31(4): 413—417]
[5] Nakano K, Lee T J, Matsumura M. In situ algal bloom control by the integration of ultrasonic radiation and jet circulation to flushing [J]. Environmental Science & Technology, 2001, 35(24): 4941—4946
[6] Zhang G, Zhang P, Fan M. Ultrasound-enhanced coagulation for Microcystis aeruginosa removal [J]. Ultrasonics Sonochemistry, 2009, 16(3): 334—338
[7] Heng L, Jun N, Wen J H, et al. Algae removal by ultrasonic irradiation–coagulation [J]. Desalination, 2009, 239(1): 191—197
[8] Lu Y C, Wang G X, Li R H. Using the intergrated technique of ultrasonic and modified-clay to remove algal blooms [J]. Journal of Lake Sciences, 2010, 22(3): 421—429 [陆贻超,王国祥, 李仁辉. 超声波和改性黏土集成技术在去除蓝藻水华上的应用. 湖泊科学, 2010, 22(3): 421—429]
[9] Tang J W, Wu Q Y, Hao H W, et al. Effect of 1.7 MHzultrasound on a gas-vacuolate cyanobacterium and a gas-vacuole negative cyanobacterium [J]. Colloids and Surfaces B: Biointerfaces, 2004, 36(2): 115—121
[10] Hao H, Wu M, Chen Y, et al. Cavitation mechanism in cyanobacterial growth inhibition by ultrasonic irradiation [J]. Colloids and Surfaces B: Biointerfaces, 2004, 33(3): 151—156
[11] Zhang G, Zhang P, Liu H, et al. Ultrasonic damages on cyanobacterial photosynthesis [J]. Ultrasonics Sonochemistry, 2006, 13(6): 501—505
[12] Xie T, Xu Z J. Ultraviolet absorption method for determination of cell membrane permeability [J]. Plant Physiology Communication, 1986, 1: 45—46 [谢田, 徐中际.测定细胞膜透性的紫外吸收法. 植物生理学通讯, 1986, 1: 45—46]
[13] Hong Y, Huang J J, Hu H Y. Effects of a novel allelochemical Ethyl 2-Methyl Acetoacetate (EMA) on the ultrastructure and pigment composition of cyanobacterium Microcystis aeruginosa [J]. Bulletin of Environmental Contamination and Toxicology, 2009, 83(4): 502—508
[14] Churro C, Fernandes A S, Alverca E, et al. Effects of tryptamine on growth, ultrastructure, and oxidative stress of cyanobacteria and microalgae cultures [J]. Hydrobiologia, 2010, 649(1): 195—206
[15] Hu H J. The Biology of Water-blooms Blue-green Algae [M]. Beijing : Science Press. 2011, 139 [胡鸿钧. 水华蓝藻生物学. 北京: 科学出版社. 2011, 139]
[16] Wang G C, Zeng C Q. Structure and function of phycobilisomes: a review [J]. Acta Hydrobiologica Sinica, 1998, 12(4): 372—377 [王广策, 曾呈奎. 藻胆体结构与功能的研究概况. 水生生物学报, 1998, 12(4): 372—377]
[17] Hong Y, Hu H Y, Sakoda A, et al. Effects of allelochemical gramine on metabolic activity and ultrastructure of cyanobacterium Microcystis aeruginosa [J]. Proceedings of World Academy of Science, Engineering and Technology, 2010, 71: 825—829
[18] Guo S S, Zhang J, Wu J, et al. Morphological and biochemical changes of Microcystis aeruginosa PCC7806 subjected to dark and oxygen limitation [J]. Acta Microbiologic Sinica, 2012, 52(2): 228—235 [郭莉莎, 章军,吴娟, 等. 黑暗限气条件下铜绿微囊藻细胞死亡的形态结构和生理生化变化. 微生物学报, 2012, 52(2): 228—235]
[19] Zheng D S. Apoptosis and programmed cell death [J]. Zoological Research, 2000, 21(1): 17—22 [郑德枢. 细胞凋亡与细胞程序性死亡. 动物学研究, 2000, 21(1): 17—22]
[20] Moharikar S, D'Souza J S, Kulkarni A B, et al. Apoptotic-like cell death pathway is induced in unicellular Chlorophyte Chlamydomonas reinhardtii (Chlorophyceae) cells following UV irradiation: detection and functional analyses [J]. Journal of Phycology, 2006, 42(2): 423—433
[21] Lee T J, Nakano K, Matsumura M. A new method for the rapid evaluation of gas vacuoles regeneration and viability of cyanobacteria by flow cytometry [J]. Biotechnology Letters, 2000, 22(23): 1833—1838
[22] Chen B, Huang J, Wang J, et al. Ultrasound effects on the antioxidative defense systems of Porphyridium cruentum [J]. Colloids and Surfaces B: Biointerfaces, 2008, 61(1): 88—92
[23] Wu J, Lin L. Elicitor-like effects of low-energy ultrasound on plant (Panax ginseng) cells: induction of plant defense responses and secondary metabolite production [J]. Applied Microbiology and Biotechnology, 2002, 59(1): 51—57
[24] Al-Hamdani S, Burnett C, Durrant G. Effect of low-dose ultrasonic treatment on Spirulina maxima [J]. Aquacultural Engineering, 1998, 19(1): 17—28
[25] Hassan H M, Scandalios J G. Superoxide dismutases in aerobic organisms [A]. In: Alscher R G, Cumming J R (Eds.), Stress responses in plants: Adaptation and acclimation mechanisms [C]. New York: Wiley-Liss, Inc. 1990, 175—199
[26] Öncel I, Yurdakulol E, Keleş Y, et al. Role of antioxidant defense system and biochemical adaptation on stress tolerance of high mountain and steppe plants [J]. Acta Oecologica, 2004, 26(3): 211—218
[27] Bridges S M, Salin M L. Distribution of iron-containing superoxide dismutase in vascular plants [J]. Plant Physiology, 1981, 68(2): 275—278
[28] Wojtaszek P. Oxidative burst: an early plant response to pathogen infection [J]. Biochemical Journal, 1997, 322(3): 681
[29] Hong Y, Hu H Y, Xie X, et al. Responses of enzymatic antioxidants and non-enzymatic antioxidants in the cyanobacterium Microcystis aeruginosa to the allelochemical ethyl 2-methyl acetoacetate (EMA) isolated from reed (Phragmites communis) [J]. Journal of Plant Physiology, 2008, 165(12): 1264—1273
[30] Li M, Hu C, Zhu Q, et al. Copper and zinc induction of lipid peroxidation and effects on antioxidant enzyme activities in the microalga Pavlova viridis (Prymnesiophyceae) [J]. Chemosphere, 2006, 62(4): 565—572
[31] Brennen C E. Cavitation and Bubble Dynamics [M]. Oxford University Press on Demand. 1995, 25—29
[32] Tsukamoto A, Higashiyama S, Yoshida K, et al. Stable cavitation induces increased cytoplasmic calcium in L929 fibroblasts exposed to 1-MHz pulsed ultrasound [J]. Ultrasonics, 2011, 51(8): 982—990
[33] Honda H, Kondo T, Zhao Q L, et al. Role of intracellular calcium ions and reactive oxygen species in apoptosis induced by ultrasound [J]. Ultrasound in Medicine & Biology, 2004, 30(5): 683—692
[34] Kumon R E, Aehle M, Sabens D, et al. Spatiotemporal effects of sonoporation measured by real-time calcium imaging [J]. Ultrasound in Medicine & Biology, 2009, 35(3): 494—506
[35] Liu Y, Yang H, Takatsuki H, et al. Effect of ultrasonic exposure on Ca2+-ATPase activity in plasma membrane from Aloe arborescens callus cells [J]. Ultrasonics Sonochemistry, 2006, 13(3): 232—236
EFFECTS OF ULTRASOND WAVE ON THE ULTRASTRUCTURE AND PHYSIOLOGICAL CHARACTERISTICS OF BLUE-GREEN ALGAE (MICROCYSTIS AERUGINOSA)
WAN Li, SHAO Lu-Lu, LU Kai-Hong, ZHU Jin-Yong and YANG Wen
(Key Laboratory of Applied Marine Biotechnology, Ministry of Education, School of Marine Science, Ningbo University, Ningbo 315211, China)
To study the effects of ultrasound wave on the blue-green algae (Microcystis aeruginosa), blue-green algae were exposed to ultrasound waves (40W) for 20 minutes, and then cultured for 1, 3, and 5 days. The results indicated that the biomass of suspended algae cells reduced by 97.84% at Day 3. From Day 1 to Day 3, lipid bodies and cyanophycin granules were accumulated, and thylakoid layers were cracked, and phycobilisomes attached to thylakoid dropped off in the cells. At Day 5, the nucleoid area gradually shrinked or disappeared, the cell infrastructure disintegrated, and voids appeared in cytoplasm and intracellular granules were degraded. Moreover, the photosynthetic oxygen evolution rate decreased by 24.83% on Day 3. Chl.a content reduced by 23.75% on Day 5. SOD activity and CAT activity were induced by ultrasound, although both of the activities diminished from Day1 to Day 5. The amount of intracellular organic exudation increased after treatment. The activities of three ATPases (Na+/K+-ATPase, Mg2+-ATPase and Ca2+-ATPase) increased firstly and then decreased, which was related to the change of membrane permeability. These results suggested that ultrasound wave may reduce algae photosynthesis, damage photosynthetic pigments and increase the membrane permeability, which can cause oxidative damage and induce death of M. aeruginosa. The dynamic CAT and ATPases activities suggested that M. aeruginosa may enhance antioxidant enzymes activity as well as ion regulation and energy activity to resist the ultrasound stress, and that the growth and metabolism of algae cells began to recover over time while the enzyme activities began to decline.
Ultrasound; Microcystis aeruginosa; Ultrastructure; Photosynthesis; Antioxidant enzyme; ATPase
Q938.8
A
1000-3207(2014)03-0516-09
10.7541/2014.73
2013-05-16;
2013-12-10
国家教育部高等学校博士学科点专项科研基金(20123305110001); 国家自然科学基金(30771658); 宁波市重大科技攻关项目(2008C50017); 宁波大学研究生科研创新基金(G12JA029); 国家自然科学基金项目(31302192); 浙江省教育厅科研项目(Y201327177); 宁波市自然科学基金项目(2013A610171)资助
万莉(1989—), 女, 重庆万州人; 硕士研究生; 主要从事水域生态研究。E-mail: whkjdxwanli@163.com
陆开宏, E-mail: lukaihong@nbu.edu.cn
