雨生红球藻在红光下的生长及营养盐消耗特征
2014-03-29王建沅周成旭严小军骆其君蒋莹马斌谭应宏
王建沅周成旭严小军骆其君蒋 莹马 斌谭应宏
(1. 宁波大学海洋学院, 宁波 315211; 2. 云南省丽江程海保尔生物开发有限公司, 丽江 674202)
雨生红球藻在红光下的生长及营养盐消耗特征
王建沅1周成旭1严小军1骆其君1蒋 莹1马 斌1谭应宏2
(1. 宁波大学海洋学院, 宁波 315211; 2. 云南省丽江程海保尔生物开发有限公司, 丽江 674202)
研究了在红光下雨生红球藻 Haematcoccus pluvialis的细胞增殖过程中, 叶绿素荧光参数的变化以及氮磷消耗特征, 并且研究了在不同初始氮磷浓度下, 细胞增殖周期、色素变化以及氮磷消耗速率, 以期为雨生红球藻的培养工艺提供参考。结果显示: (1)在细胞增殖过程中, 光合荧光参数ΦPSⅡ、qP、ETR与细胞增殖周期一致, 没有显著差异。Fv/Fm、NPQ则随着细胞密度的上升而下降, 随着细胞密度下降而上升, 且发生变化的拐点与营养盐胁迫造成细胞数量下降的时间点基本一致。(2)以不同初始氮磷浓度(氮磷比 10︰1, 重量比)的培养液接种细胞, 较高浓度的氮磷条件(45/4.5—130/13.0 mg/L), 比较低浓度的氮磷条件(15/1.5—20/2.0 mg/L)有利于提高批次培养后的细胞终产量。但是, 在初始高浓度氮磷下, 接种初期细胞受到胁迫, 相对增长速率小; 氮磷消耗率低, 后期浓度维持高位; 藻细胞指数生长延迟, 培养周期变长。在红光下, 最优化的氮磷接种浓度为45/4.5 mg/L。研究结果对半连续培养雨生红球藻的应用进行了讨论。
雨生红球藻; 细胞增殖; 氮磷营养盐; 叶绿素荧光参数; 红光
雨生红球藻Haematcoccus pluvialis能大量积累优质虾青素, 是一种高价值经济微藻[1]。在培养时,采用绿色细胞培养和转红培养两步法进行, 绿色细胞的高效培养是生产虾青素的首要环节。先提高雨生红球藻生物量、后进行诱导转红可获得比一步培养更高产量的虾青素[2]。雨生红球藻累积虾青素的过程,是细胞对各种环境胁迫非常灵敏的保护性反应。因此,优化培养条件和工艺、避免绿色细胞在低生物量时进入抗胁迫代谢, 是绿色细胞培养研究的重点。
Tomohisa等[3]研究不同波长的 LEDs灯对雨生红球藻的影响, 发现红色 LEDs能促进绿色细胞生长, 而蓝色LEDs能诱导高水平虾青素的积累。齐安翔[4]发现, 在低强度光照条件下, 红、蓝光比白光更能有效地促进绿色细胞的生长; 在诱导虾青素积累时, 白光胁迫处理经不同波段光培养后的藻细胞,结果显示, 红光培养组藻粉产率最高, 蓝光培养组虾青素产率最高。Satoshi等[5]报道, 在低光强下, 长波光可避免绿色细胞在低生物量时发生形态变化而影响虾青素终产量的提高。其他研究同样显示, 红光对雨生红球藻营养细胞的增殖具有促进作用[6,7]。我们的前期研究也显示出这种促进作用, 红光下氮磷营养盐消耗快, 实验组藻细胞更早地受到胁迫(待发表结果)。
目前关于红光下雨生红球藻的生长状态、生理特征及营养盐浓度需求等问题尚缺乏深入的研究,使该工艺的应用还处于基础研究阶段。本研究针对红光下雨生红球藻绿色细胞的培养过程, 分析了细胞增殖、氮磷营养盐消耗、叶绿素荧光参数及三者之间的变化特征, 以期为雨生红球藻规模化养殖的研究及培养工艺的改进提供理论参考。
1 材料与方法
1.1 藻种
雨生红球藻(NMBlud05-011)由宁波大学微藻种质库提供。于NMB3#培养基中进行增殖预培养, 培养基母液配方如表1所示, 使用时以1︰1000比例配制新鲜培养液。培养温度 23 , ℃ 光强 20 μmol/ (m2·s) (D︰L=12h︰12h), 日光灯光源。

表1 NMB3#培养基母液配方Tab. 1 NMB3#medium stock solution
1.2 实验方法
在红光下, 一次培养中的细胞增殖、营养盐消耗及叶绿素荧光参数变化 以红色滤光膜过滤日光灯提供红色给光条件。该滤光膜可完全透过>550 nm的光, 滤除<500 nm的光。
取预培养至平台期的微藻(1.0×105cells/mL)接种于NMB3#培养液中(250 mL锥形瓶, 培养水体体积 200 mL), 3平行。置于温度为 25 , ℃ 光照强度50 μmol/(m2·s) (D︰L=12h︰12h)的滤光培养室培养。每日摇瓶2—3次, 每天取样检测细胞密度, 跟踪叶绿素荧光参数变化。隔天取藻液抽滤, 水样冻存, 备检氮磷营养盐变化。
叶绿素光合荧光参数以Water-PAM叶绿素荧光仪检测。
细胞密度以浮游植物计数框计数(北京普利特仪器公司)。
水样的氮磷浓度以Smartchem全自动化学分析仪200分析。水样低温避光解冻后检测。
在红光下, 初始氮磷浓度对细胞增殖、营养盐消耗、叶绿素荧光参数及色素的影响 取平台期绿色细胞(1.1×105cells/mL), 基于 NMB3#培养基,设置接种时藻液氮、磷终浓度: 在相同的氮磷比(10︰1重量比)条件下, 藻液中的氮磷浓度由低到高: N/P=15/1.5 mg/L (Ⅰ)、N/P=20/2.0 mg/L (Ⅱ)、N/P=45/ 4.5 mg/L (Ⅲ)、N/P=85/8.5 mg/L ( )Ⅳ、N/P=130/13.0 mg/L (Ⅴ), 其他营养元素相同。培养水体体积200 mL, 各3平行。实验组起始藻密度约为 5.3×104cells/mL。培养条件同上。
隔天取样, 跟踪生物量和氮磷浓度变化。
培养结束时, 收集全部微藻, 制备冻干藻粉,分析细胞色素。
细胞色素的测定: 参考Kwan和Kim[8]的方法, 测定冻干藻粉的叶绿素、胡萝卜素和虾青素的相对比值。
细胞增殖至平台前期, 以酶标仪测定光密度表征相对生物量变化。考虑培养后期的色素变化及细胞聚团可能造成的影响, 培养结束时, 以浮游植物计数框计数测定生物量。
1.3 数据分析
数据采用Excel 2003、SPSS 13.0和origin 7.5分析软件进行分析和制图。

100%, 其中A676(t1)和A676(t2)分别表示藻液在t1、t2时于676 nm处的光密度值。
2 结果
2.1 在红光下一次培养中的细胞增殖、营养盐消耗及叶绿素荧光参数变化
如图 1所示, 平台期接种后藻细胞迅速增殖,无滞缓期。氮磷营养盐快速消耗, 与初始浓度(N/P=8.5/0.8 mg/L)相比, 在2d快速增殖后, 氮磷浓度分别下降 52.8%和 48.2%。氮磷营养盐迅速降低导致细胞增殖停滞(4thd), 此时培养液中的氮磷浓度分别为2.81和0.27 mg/L。受氮磷营养盐胁迫, 藻细胞逐渐由绿色游动细胞向红棕色游动细胞转变(8thd)。此后, 氮、磷浓度相对稳定, 分别维持在2.0和0.2 mg/L左右。

图1 红光下雨生红球藻的细胞增殖及培养液中氮磷变化Fig. 1 The growth of Haematcoccus pluvialis and the change of nitrogen (N) and phosphorus (P) concentration in the medium in a batch culture under red light
检测增殖全程的叶绿素荧光参数(Fv/Fm、NPQ、ΦPSⅡ、qP、ETR)变化发现(图2), ΦPSⅡ、ETR和qP与细胞增殖变化趋势一致: 快速增殖时相应上升, 平台期最大, 随藻体因受营养盐胁迫停止分裂衰亡时,又呈下降趋势。而Fv/Fm和NPQ与藻细胞增殖过程呈现互逆现象, 在细胞快速增殖时均呈下降趋势, 从平台期向衰败期转化过程中又逐渐上升, 中间出现明显的拐点, 此时培养液中的N、P浓度为2.81和0.27 mg/L。

图2 红光下雨生红球藻一次培养过程中的叶绿素荧光参数变化Fig. 2 The change of chlorophyll fluorescence parameters of Haematcoccus pluvialis in batch culture under red light
2.2 在红光下, 初始氮磷浓度对细胞增殖、营养盐消耗、叶绿素荧光参数及色素的影响
细胞增殖 在相同初始接种密度下, 不同浓度的氮磷影响藻细胞的增殖状态, 使培养过程出现差异。图3显示, 5个实验组的藻细胞生长状态大致可分成三组, 低氮磷浓度的Ⅰ、Ⅱ组, 以及较高浓度的(Ⅲ、Ⅳ、Ⅴ)组。Ⅰ组和Ⅱ组接种后即快速增殖, 8d到达平台期, 前 4d的倍增速率明显大于后 4d (图4)。较高浓度的Ⅲ、Ⅳ和Ⅴ三组, 初期迟滞期相对于Ⅰ、Ⅱ组延长, 而Ⅲ组的初期增长速率大于Ⅳ和Ⅴ组。前 4天随浓度的升高, 细胞倍增速率下降; 6d后进入快速增殖期, 细胞的增殖速率明显增大(图4)。 三个较高氮磷接种浓度的实验组能够达到相对于Ⅰ、Ⅱ组更高的生物量, 但三组的最大生物量之间没有显著差异(P>0.05)(图5)。
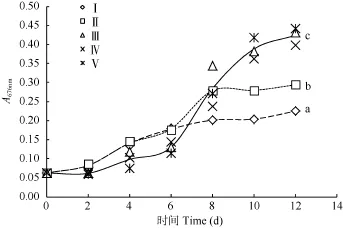
图3 不同初始氮磷浓度下雨生红球藻的细胞增殖Fig. 3 The growth of Haematcoccus pluvialis under different initial concentration of nitrogen (N) and phosphorus (P)
氮磷营养盐变化 如图 6所示, 细胞增殖过程与氮磷消耗密切相关。较低氮磷浓度Ⅰ、Ⅱ两组中, 初期细胞增殖迅速, 氮磷营养盐消耗率高;后期生长受胁迫, 氮磷消耗变缓。Ⅲ、Ⅳ和Ⅴ组的细胞初期增殖受到抑制, 营养盐消耗率低, 尤其是第Ⅴ组, 0—4d氮、磷的消耗显著滞缓, 仅为初始浓度的3.7%和4.2%, 远低于其余各组, Ⅲ组细胞的氮磷消耗高于Ⅳ和Ⅴ组。培养结束时, Ⅳ、Ⅴ两组的氮磷浓度仍维持在较高水平, 分别为42.54/5.37 mg/L和98.39/8.44 mg/L, 藻液外观呈绿色, 而其余各组均不同程度地转变成红色。

图4 不同氮磷浓度组中雨生红球藻倍增速率的变化Fig. 4 The multiplication rate of Haematcoccus pluvialis under different concentration of nitrogen (N) and phosphorus (P)

图5 不同氮磷起始浓度下雨生红球藻达到的最大生物量Fig. 5 The maximum biomass of Haematcoccus pluvialis under different initial concentration of nitrogen (N) and phosphorus (P)
进一步分析氮磷消耗量比值发现(图 7, 氮磷消耗量比值是相对于前一时间点氮磷浓度减少量的比值: N(Tt-1–Tt)/P(Tt-1–Tt)), 氮磷消耗量比值在各实验组的细胞分裂增殖过程中均呈下降趋势。Ⅰ-Ⅳ组的特征显示, 随着氮磷起始浓度增高, 其下降的斜率增大。最高浓度Ⅴ组的氮磷消耗量比值变化特征与其余四组相异, 前6天呈上升趋势, 之后下降。前6天处于细胞增殖受抑的滞缓期, 第 6天后细胞快速增殖, 此时氮磷消耗量比值下降。
细胞色素 在培养结束时, 对细胞色素的分析结果显示(图 8),Ⅰ、Ⅱ两组已处于营养盐显著胁迫状态, 胡萝卜素的相对含量高, 虾青素明显增加,藻液外观呈红色。Ⅲ组受到的胁迫程度低于Ⅰ、Ⅱ两组, 藻液外观呈红棕色。Ⅳ-Ⅴ组的营养盐胁迫程度低(培养液中残余的氮磷浓度仍较高), 胡萝卜素和虾青素的相对含量低。Ⅳ和Ⅴ两实验组的细胞色素含量没有显著差异(P>0.05), 藻液外观仍呈绿色。
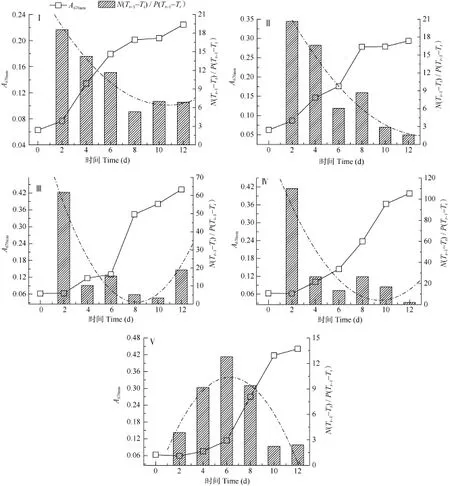
图7 不同氮磷接种浓度下, 培养过程中的氮磷元素消耗量比值变化趋势Fig. 7 The variation of the ratio of absorbed nitrogen and phosphorus in medium during the cultivation of different initial concentration of nitrogen and phosphorus
3 讨论
光照条件和营养盐浓度是影响雨生红球藻增殖和虾青素积累的关键因素。已有多次报道长波长的光有利于绿色细胞的增殖, 并且影响转红培养后的虾青素产量[4,5]。因此, 研究红光下的藻生理特征变化是优化生产工艺的基础。
叶绿素荧光分析技术具有快速、灵敏、对细胞无损伤等优点, 实时反映环境胁迫对光合生理产生的影响, 已广泛应用于微藻的胁迫生理研究[9]。Dewez等[10]讨论了将叶绿素荧光参数变化作为藻类受胁迫“biomarker”的可行性。本研究发现, 红光下雨生红球藻的Fv/Fm和NPQ在绿色细胞培养过程中呈先降后升的趋势, 与细胞增殖周期及营养盐消耗有显著相关性, 并出现明显的拐点, 从而指示藻细胞的培养状态。NPQ是由于光合膜两侧的质子梯度和形成的膜高能态引起的, 与ATP的形成和光合膜的状态有关。在红球藻细胞增殖至平台期时, NPQ下降说明红球藻的卡尔文循环活跃, 能量利用率高;随着藻细胞逐渐受胁迫作用, NPQ变大, 表明红球藻的卡尔文循环受抑制程度逐渐加大, PSⅡ的潜在热耗散能力增强, 从而起到保护光合器官的作用,是红球藻响应外界环境胁迫的一种生理机制[11]。Fv/Fm后期上升可能是此时的营养胁迫已引起细胞累积部分虾青素与胡萝卜素, 叶绿素的相对含量减少, 而初始荧光Fo的大小与叶绿素浓度有关, 叶绿素的减少导致Fo变小, Fv变大(Fv=Fm–Fo), 使Fv/Fm变大[12,13]。因此, 有可能利用叶绿素荧光参数的变化来指示雨生红球藻培养过程中发生的营养盐胁迫, 为半连续培养中营养盐的更新时机提供参考。在深入的研究中, 还需要分析叶绿素荧光参数的拐点指示在怎样的培养条件中成立、细胞各光合色素的定量变化是否与叶绿素荧光参数指示的结果具有实时一致性等问题。
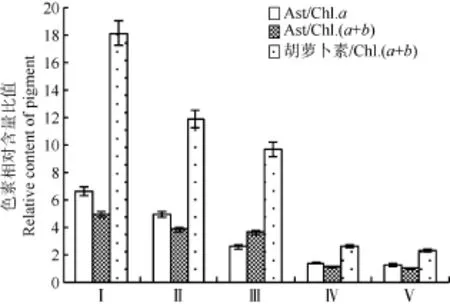
图8 不同氮、磷起始浓度下培养的雨生红球藻的色素含量相对比值
氮磷浓度和比值是影响微藻营养生长的重要因素, 且同时影响代谢产物的含量和组成。氮磷浓度过低不能满足微藻的营养生长从而影响生物量的提高, 并可造成藻细胞低密度时即受胁迫过早红化[14];氮磷浓度过高同样会对雨生红球藻的细胞增殖产生抑制作用, 对生产的连续性带来不确定因素, 且不利于第二步转红培养的进行[15]。García-Malea等[16]研究发现, 当NO3–-N浓度超过28 mg/L时, 随氮浓度的升高平台期的最大生物量变化不大, 当浓度超过60 mg/L时, 无论光照强度如何改变, 大部分藻细胞群体将以绿色细胞状态存在而不积累虾青素。Borowitzka等[17]曾报道, 雨生红球藻在KNO3浓度为0.01 g/L培养基中培养10d即能完全转化成红色胞囊, 但在KNO3浓度为0.1 g/L培养时, 一个月后仅生成小部分红色胞囊。在本研究中, 雨生红球藻在红光下培养, 当KNO3浓度为 0.07—0.15 g/L时,藻细胞一周左右完全转红; 当浓度为 0.32 g/L时,藻细胞培养至 12d转为红棕色; 而当浓度大于0.61 g/L时, 很少有藻细胞转为红色胞囊。造成各研究结果的绝对浓度有差异的主要原因在于培养条件的不同。因此在实际生产中, 相对不同藻株以及不同工艺能力, 需要有针对性的综合参数指标。但所有结果显示相同的特征: 在适宜低的氮磷添加浓度下, 营养盐消耗迅速, 接种后增殖速率高, 缩短红球藻达到最大生物量的生长周期; 较高浓度的氮磷则相对延长藻细胞的生长周期, 而高浓度的氮磷会抑制藻细胞的增殖和转红。
半连续培养在一定程度上能够克服批次培养的不利因素。但营养盐的添加剂量及添加时机是优化半连续工艺的关键因素, 本研究的结果显示, 在培养过程中跟踪检测叶绿素荧光参数Fv/Fm和NPQ的变化, 可能指示雨生红球藻绿色细胞培养阶段的营养盐变化胁迫; 当营养盐胁迫发生时, 藻类进入平台期, 适宜浓度的营养盐添加剂量则是优化生长过程的关键。本研究显示, 在红光下培养时, 当藻细胞起始密度约为 5×104(cells/mL)时, 初始氮磷浓度为45/4.5 mg/L 左右最优。在两步法培养雨生红球藻生产虾青素的工艺中, 红色光照有利于绿色细胞的培养, 进一步研究尚需要就光强及光暗比等条件的影响进行深入研究。
[1] Xiao Y, Wang G H, Liu Y D. UV-B effects on the photosynthetic features and astaxanthin accumulation of Haematococcus pluvialis and its responses [J]. Acta Hydrobiologica Sinica, 2010, 34(6): 221—229 [肖媛, 王高鸿, 刘永定. UV-B辐射对雨生红球藻光和特性和虾青素含量的影响及其相应. 水生生物学报, 2010, 34(6): 221—229]
[2] Claude A, Yuval M, Aliza Z, et al. On the relative efficiency of two- vs. one-stage production of astaxanthin by the green alga Haematococcus pluvialis [J]. Biotechnology and Bioengineering, 2007, 98(1): 300—306
[3] Tomohisa K, Abdolmajid L, Kazumichi S, et al. Astaxanthin production by Haematococcus pluvialis under illumination with LEDs [J]. Enzyme and Microbial Technology, 2004, 35(1): 81—86
[4] Qi A X. Studies of cultures medium and cultures modes of Haematococcus pluvialis for enhanced production of astaxanthin [D]. Thesis for Master of Sicence. Xiamen University, Xiamen. 2006 [齐安翔. 高产虾青素的雨生红球藻培养基及培养模式的若干研究. 硕士学位论文, 厦门大学, 厦门. 2006]
[5] Satoshi Y, Reza R, Ryota I, et al. Effective utilization of transmitted light for astaxanthin production by Haematococcus pluvialis [J]. The Society for Biotechnology, 2006, 102(2): 97—101
[6] Huang S Y, Qi A X, Li Z, et al. Initial studies on the effects of stress conditions on astaxanthin accumulation of Haematococcus pluvialis [J]. Studia Marina Sinica, 2009, 49: 144—151 [黄水英, 齐安翔, 李哲, 等. 几种胁迫方式对雨生红球藻积累虾青素影响的初步研究. 海洋科学集刊, 2009, 49: 144—151]
[7] Wu X, Kang R J, Cong W, et al. Application of sun-light conversion film on the growth of Hnematococcus pluvialis [J]. The Chinese Journal of Process Engineering, 2006, 6(6): 969—972 [吴霞, 康瑞娟, 丛威, 等. 转光膜在雨生红球藻养殖上的应用过程. 工程学报, 2006, 6(6): 969—972]
[8] Kwan W C, Kin W C. HPLC pigment analysis of marine phytoplankton during a red tide occurrence in Tolo Harbour, Hong Kong [J]. Chemosphere, 2003, 52(9): 1633—1640
[9] Liang Y, Feng L X, Yin C L, et al. Current status and prospect of chlorophyll fluorescence technique in the study of responses of microalgae to environment stress [J]. Marine Science, 2007, 31(1): 71—79 [梁英, 冯力霞, 尹翠玲, 等.叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景. 海洋科学, 2007, 31(1): 71—79]
[10] Dewez D, Didur O, Vincent-Héroux J, et al. Validation of photosynthetic-fluorescence parameters as biomarkers for isoproturon toxic effect on alga Scenedesmus obliques [J]. Environmental Pollution, 2008, 151(1): 93—100
[11] Liang Y, Feng L X, Yin C L. Effects of high temperature stress on the chlorophyll fluorescence kinetics of Phaeodactylum tricornutum and Chaetoceros gracilis [J]. Periodical of Ocean University of China, 2006, 36(3): 427—433
[12] Xu J J, Zhang D L, Wu G Q, et al. Effect of wind stress on photosynthetic activity of Microcoleus vaginatus crusts [J]. Acta Hydrobiologica Sinica, 2010, 34(3): 575—583 [许娟娟,张德禄, 櫵吴国 , 等. 风力胁迫对具鞘微鞘藻结皮光合活性的影响. 水生生物学报, 2010, 34(3): 575—583]
[13] Wayama M, Ota S, Matsuura H, et al. Three-dimensional ultrastructural study of oil and astaxanthin accumulation during encystment in the green alga Haematococcus pluvialis [J]. Plos One, 2013, 8(1): 1—9
[14] Choi Y E, Yun Y S, Park J M, et al. Determination of the time transferring cells for astaxanthin production considering two-stage process of Haematococcus pluvialis cultivation [J]. Bioresource Technology, 2011, 102(24): 11249—11253
[15] Chang D K, Se J H, Seung P C, et al. Fed-batch culture of astaxanthin-rich Haematococcus pluvialis by exponential nutrient feeding and stepwise light supplementation [J]. Bioprocess and Biosystems Engineering, 2010, 33(1): 133–139
[16] García-Malea M C, Acién F G, Fernández J M, et al. Production of astaxanthin by Haematococcus pluvialis: taking the one-step system outdoors [J]. Biotechnology and Bioengineering, 2009, 102(2): 651—657
[17] Borowitzka M A, Huisman J M, Osborn A. culture of the astaxanthin-producing green alga Haematococcus pluvialis 1. effect of nutrients on and cell type [J]. Journal of Applied Phycology, 1991, 3(4): 295—304
THE CHARACTERISTICS OF GROWTH AND NUTRIENT CONSUMPTION OF HAEMATOCOCCUS PLUVIALIS UNDER RED LIGHT
WANG Jian-Yuan1, ZHOU Cheng-Xu1, YAN Xiao-Jun1, LUO Qi-Jun1, JIANG Ying1, MA Bin1and TAN Ying-Hong2
(1. School of Marine Sciences, Ningbo University, Ningbo 315211, China; 2. Chenghai Bao’er Biotechnology Inc., Lijiang 674202, China)
It has been proposed that Haematococcus pluvialis grow better under red light than PAR. In the present study, the characteristics of chlorophyll fluorescence parameters and nutrient requirements during population growth under red light were analyzed. The results showed that chlorophyll fluorescence parameters ΦPS II, qP and ETR had the same variation trend along with the population growth phase. Fv/Fmand NPQ decreased with the increased cell numbers, and then increased at the late growth stage when the cell density decreased. The turning point of Fv/Fmand NPQ is practically consistent with the cell stress condition caused by nutrient depletion stress. High concentrations of the nutrients nitrogen (N) and phosphorus (P) such as 85/8.5 mg/L and 130/13.0 mg/L enhanced the biomas at early stage, and then inhibited cell growth at the longer retarded phase before entering exponential growth phase that Nutrient consumption was also reduced. These results suggested that the optimum of N/P concentration for H. pluvialis cultured under red light was 45/4.5 mg/L. The potential application of the results in semi-continuous culture of H. pluvialis has been discussed.
Haematococcus pluvialis; Cell growth; Nitrogen and phosphorus; Chlorophyll fluorescence parameters; Red light
Q178.1+1
A
1000-3207(2014)06-1135-08
10.7541/2014.165
2013-11-08;
2014-05-22
教育部博士点优先发展领域课题(20133305130001); 浙江省重大科技创新团队“海洋生物技术产业科技创新团队”2011R10029; 浙江省重点基金(Z3100565)资助
王建沅(1990—), 女, 浙江上虞人; 硕士; 主要从事微藻生物技术研究。E-mail: 731726876@qq.com
严小军, E-mail: yanxiaojun@nbu.edu.cn
