pH对小球藻Chlorella sp. XQ-200419光合作用、生长和产油的影响
2014-03-29虎张桂艳温小斌耿亚洪李夜光
张 虎张桂艳温小斌耿亚洪李夜光
(1. 中国科学院武汉植物园, 植物种质创新与特色农业重点实验室, 武汉 430074; 2. 中国科学院大学, 北京 100049)
pH对小球藻Chlorella sp. XQ-200419光合作用、生长和产油的影响
张 虎1,2张桂艳1,2温小斌1,2耿亚洪1李夜光1
(1. 中国科学院武汉植物园, 植物种质创新与特色农业重点实验室, 武汉 430074; 2. 中国科学院大学, 北京 100049)
以一种生长快、油脂含量高的小球藻(Chlorella sp. XQ-200419)为实验材料, 利用测定净光合放氧速率的方法研究了pH对其光合作用的影响; 使用改良的BG-11培养基在微藻环形培养池模拟系统中进行分批培养, 培养周期为8d, 培养过程中使用 pH控制仪在线监测藻液的pH, 根据pH变化, 自动接通、关闭CO2通气管道, 将藻液pH分别控制在5.0—6.0, 7.0—8.0, 8.0—9.0, 9.0—10.0, 10.0—11.0内, 研究pH对生长速率、生物质面积产率、总脂含量和总脂面积产率的影响。主要结果如下: 藻液 pH 对小球藻 Chlorella sp. XQ-200419光合放氧、生长速率、生物质产率、总脂含量和产率都有显著影响, 适宜的pH范围是7.0—9.0,在此范围内, 光合放氧、生长速率、生物质产率、总脂含量和产率均保持较高水平, 且pH的影响不显著; pH低于7.0, 高于9.0, 其光合放氧、生长速率、生物质产率、总脂含量和产率都显著降低。这表明pH对小球藻Chlorella sp. XQ-200419光合作用的影响和对生长、产油的影响是一致的。pH 7.0—8.0, 小球藻的生物质平均面积产率和总脂平均面积产率都达到最大值, 分别是8.9 g/(m2·d)和2269.5 mg/(m2·d); 当藻液pH超过10.0, 生物质平均面积产率和总脂平均面积产率分别降低42.1%和60.0%。适合于小球藻生长的pH也有利于其积累油脂, 所以, pH对小球藻产油的影响是一种“适宜模式”, 而非“胁迫模式”。规模化培养小球藻Chlorella sp. XQ-200419, 通过补充CO2将藻液pH控制在7.0—9.0内, 可以获得高生物质产率和总脂产率。研究结果反映出pH对小球藻光合作用、生长和产油影响的规律, 也为规模化培养小球藻生产微藻油脂过程中合理控制藻液pH提供了依据。
小球藻; 微藻生物柴油; pH; 光合作用; 生长; 产油
水体 pH是水生微藻生态环境最重要的理化因子之一。pH能改变微藻体内相关酶的结构状态和活性, 决定培养液中碳源的存在形式以及各种金属复合物的溶解性, 是影响藻细胞生长和生物质积累以及次生代谢产物的重要因素[1—4]。同时, 藻类光合作用吸收CO2和呼吸作用释放CO2也影响HCO3–- CO32–缓冲体系的化学平衡移动, 从而影响培养基的pH[5],所以 pH变化也可以作为预报藻类生长速度的一个指标[6]。许多研究报道了pH对微藻光合作用和生长的影响, 不同的藻类有一定的pH适应范围[7—10]。同时, pH对微藻产油的影响也已经受到了广泛的关注。Santos等[11]通过荧光显微镜观察证明了 Neochloris oleoabundans 在高pH下积累油脂。王翠等[12]发现偏碱性环境有利于小球藻积累油脂。杨勋等[13]发现pH 9.5 和pH 4.5时若夫小球藻(Chlorella zofingiensis)油脂质量分数略低于正常状况。吕梦梦等[14]提出富油微藻培养过程中 pH 的分阶段调节路径从而兼顾微藻生物质积累和油脂积累。pH不仅影响微藻的生长, 而且决定培养基中三种碳源形式(CO2、HCO3–、CO32–)的相互转化, 影响碳源利用效率[15]。合理的控制藻液的pH, 能够促进微藻快速生长并大量积累油脂, 同时还能提高碳源利用效率, 降低生产成本。
小球藻(Chlorella sp. XQ-200419)是一株生长快、油脂含量高的藻株, 具有规模化培养的应用前景[8]。张桂艳等[16]利用通气培养研究了N、P、Fe3+、盐度、温度、光照强度对该小球藻生长和产油的影响, 发现除了 N源对产油的影响是一种“胁迫模式”外, 其他因子对产油的影响都是“适宜模式”, 对优化培养条件、促进油脂积累提供了指导。但是, 我们还不清楚藻液 pH对这株小球藻生长及油脂积累有何影响。为了深入认识 pH对微藻生长、产油影响的规律, 本文以小球藻(Chlorella sp. XQ-200419)为实验材料, 系统研究了pH对小球藻(Chlorella sp. XQ-200419)生长、生物质单位面积产率、总脂含量和总脂单位面积产率的影响。旨在掌握 pH对小球藻的生长和产油影响的规律, 为规模化生产中藻液pH 的合理调控提供依据。
1 材料与方法
1.1 藻种及其培养
小球藻(Chlorella sp. XQ-200419)由中国科学院武汉植物园经济微藻藻种库提供。
采用2倍改良的BG-11培养基[16]。用1L三角瓶培养小球藻(Chlorella sp. XQ-200419), 每瓶放藻液 600 mL, 接种后放在水平摇床上培养, 转速110 r/min, 温度(24±1) , ℃ 光强70 μmol/(m2·s), 光暗周期为14h︰10h。
1.2 不同pH 条件下光合放氧速率的测定
取对数生长期的小球藻(Chlorella sp. XQ-200419)藻液, 向灭菌的 250 mL三角瓶中放入100 mL 藻液, 共24瓶, 分为8组, 每组3瓶(平行样), 用NaOH和HCl将每组藻液的pH 分别调至6.5、7.0、8.0、9.0、10.0、10.5、11.0。在弱光环境中放置12h, 每隔4h用NaOH和HCl调节藻液的pH , 测定前再一次将藻液调为设定的 pH。在光强为 600 μmol/ (m2·s)、温度为35.0℃的条件下, 测定小球藻在不同pH 条件下的净光合放氧速率。通过计算单位时间内溶解氧变化的平均值求得净光合放氧速率[7—9]。

1.3 环形培养池模拟系统培养小球藻
环形培养池模拟系统的结构和技术参数见苗凤萍等[17]的描述。
取对数生长期的小球藻藻液, 在 4000 r/min离心 10min, 采收藻细胞, 然后用 2倍的改良 BG-11培养基清洗采收的藻, 反复操作两次, 再将离心收集的藻接种于2倍的改良BG-11培养基中, 放入环形培养池模拟系统中培养。培养条件: 温度 30 , ℃光照强度 300 μmol/(m2·s), 光暗周期为 14h︰10h,搅拌转速为50 r/min。初始A540值设为0.5±0.005, 藻液深度为4 cm。记录藻液液面高度, 每天定时在藻液中加入一定量的蒸馏水至原液面高度, 以补充挥发掉的水分。每24h测定一次OD540值, 绘制生长曲线、生长速率曲线、单位面积产率曲线。待藻液OD540不再明显增长, 离心收集环形培养池模拟系统中的藻液, 真空干燥至恒重, 并测定小球藻的总脂含量。重复实验3次。
1.4 pH的设定和控制
pH 设定为: pH 6.0—7.0、pH 7.0—8.0、pH 8.0—9.0、pH 9.0—10.0、pH 10.0—11.0。
pH控制系统由 pH传感器、pH控制仪、CO2钢瓶、管道、电磁阀、流量计组成。培养过程中, 伴随小球藻旺盛的光合作用, 藻液的 pH 不断升高[18]。当藻液pH 达到设定的pH 控制上限, pH 控制仪控制电磁阀开启, 向藻液中通入 CO2。随着CO2的不断通入, 藻液pH 降低, 当pH 降低到设定的pH 控制下限, pH 控制仪控制电磁阀关闭, 停止充CO2。如此循环往复, 藻液的pH 被控制在设定的范围内。
1.5 藻液吸光度的测定
用UV5800紫外可见分光光度计(上海元析), 在波长为 540 nm、光径 1 cm下测定藻液的吸光度(A540)。每隔24h, 取出约3 mL藻液测定藻液的吸光度, 重复测定3次, 取平均值[19]。
1.6 叶绿素含量的测定
利用热乙醇萃取分光光度法[20]测定叶绿素a的含量。
1.7 生长速率的计算
生长速率计算公式:
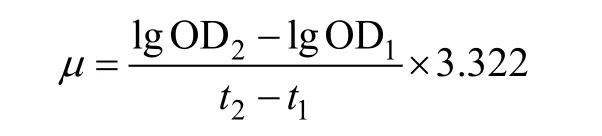
OD1和OD2分别是两次取样时藻液OD值, t1和t2是对应的培养时间(天)。
1.8 生物质干重的测定
准确量取藻液体积, 用事先干燥并已称重的孔径为 0.45 μm的玻璃纤维膜过滤收获藻细胞, 用蒸馏水洗涤两次, 放入真空干燥器中干燥至恒重。根据干藻重量和藻液体积计算出 1 L藻液中的生物质干重(g/L)。
1.9 生物质平均面积产率的计算
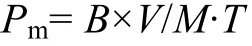
Pm是小球藻平均面积产率(g/m2·d), B是培养结束时小球藻的生物质干重与接种时生物质干重之差(g/L), M是反应器的有效培养面积(m2), T是培养时间(d), V是藻液体积(L)。
1.10 总脂含量定量分析
采用超声波辅助正己烷-乙酸乙酯提取法[16,21]。
1.11 总脂平均面积产率的计算
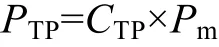
PTP是总脂平均面积产率(g/m2·d), CTP是培养结束时小球藻的总脂含量。
1.12 数据处理
数据采用 Microsoft Excel 2007 和 SPSS 17.0进行统计分析、作图等。
2 结果
2.1 pH对小球藻光合放氧速率的影响
在 pH 6.5—7.0内, 小球藻净光合放氧速率随pH的增加呈上升趋势; pH 7.0时, 其净光合放氧速率达到最大值; pH 7.0—9.0, 随着pH 的升高, 净光合放氧速率呈下降趋势, 但变化不大; pH 超过9.0,随着 pH 的进一步升高, 净光合放氧速率快速下降(图1)。数据表明, 小球藻适宜生长在中性偏碱的环境中, 在pH 7.0—9.0内其净光合放氧速率均保持在较高的水平。

图1 Chlorella sp. XQ-200419净光合放氧速率与pH的关系Fig. 1 Photosynthesis of Chlorella sp. XQ-200419 in different pH
2.2 pH对小球藻生长的影响
小球藻在pH 6.0—7.0、pH 7.0—8.0的OD值变化几乎一致; pH 8.0—9.0时小球藻在接种后第2、第3天的OD值略低于pH 6.0—7.0、pH 7.0—8.0时的OD值, 但是从第4天开始赶上前两组的OD值。pH 9.0—10.0、pH 10.0—11.0两组, 小球藻从接种后第1天的OD值就明显低于前三组OD值(P<0.01), 培养过程中从未赶上前三组的OD值。pH 10.0—11.0, 小球藻接种后OD值增长缓慢, 一直低于前四组(图2)。
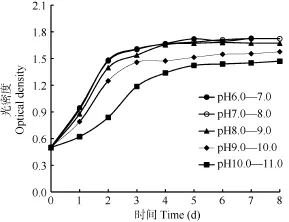
图2 Chlorella sp. XQ-200419在不同pH条件下的生长曲线Fig. 2 Growth curves of Chlorella sp. XQ-200419 in different pH
在pH 6.0—7.0、7.0—8.0、8.0—9.0时小球藻在接种后第1天均能快速生长, 第2天生长速率开始减缓, 三组间的生长速率没有明显差异(P>0.05);当pH升高至9.0—10.0时, 小球藻在接种后第1天的生长速率较前三组明显减缓(P<0.01), 第2天的生长速率与前三组的生长速率接近; pH为10.0—11.0时, 小球藻第1天和第2天生长很慢, 第3天生长速率才达到最大值, 但是, 其最大生长速率明显低于前四组。pH 9.0是一个分界点, pH 低于9.0, 小球藻很快进入快速生长状态; pH 高于 9.0, 小球藻就需要一段时间适应高pH 环境, pH 越高, 适应环境需要的时间越长(图3)。
2.3 pH对小球藻生物质产率的影响
小球藻的生物质平均面积产率在pH 7.0—8.0时最大, pH 8.0—9.0时的生物质干重次之, pH 6.0—7.0时生物质干重比前两组更低, 三组间差异明显(P<0.01); 当pH高于9.0时, 小球藻的生物质干重明显低于前三组(P<0.01), 其中pH10.0—11.0比pH9.0—10.0时生物质干重更低。数据表明pH7.0—8.0最有利于小球藻生物质的积累(图4)。
2.4 pH对小球藻总脂含量的影响
小球藻在pH 6.0—7.0、7.0—8.0、8.0—9.0时总脂含量都较高, 三组间差异不显著(P>0.05), 但是,均极显著高于 pH为 9.0—10.0、10.0—11.0时小球藻的总脂含量(P<0.01)。pH为10.0—11.0时小球藻总脂含量最低, 与pH 9.0—10.0时总脂含量相比较差异也极显著(P<0.01)(图5)。这表明pH 6.0—9.0范围内, 小球藻均可以达到较高的总脂含量, 而更高的pH环境则不利于小球藻积累油脂。
pH 7.0—8.0时小球藻的总脂平均面积产率最高; pH 8.0—9.0时次之; pH 6.0—7.0时更低; pH 9.0—10.0、10.0—11.0的小球藻的总脂平均面积产率显著降低(P<0.01), 两组间差异也很显著(P<0.01); pH 7.0—8.0最有利于小球藻生物质和油脂的积累, 因而, 在这个 pH范围小球藻获得了最高的总脂平均面积产率(图6)。
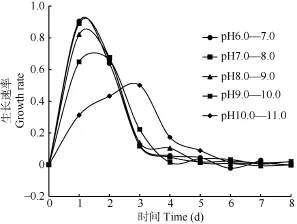
图3 不同pH条件下培养Chlorella sp. XQ-200419生长速率随培养时间的变化Fig. 3 The growth rate of Chlorella sp. XQ-200419 in different pH
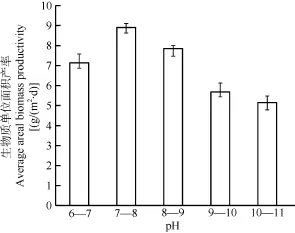
图4 Chlorella sp. XQ-200419在不同pH下的单位面积的生物质产率Fig. 4 Average areal biomass productivity of Chlorella sp. XQ-200419 in different pH

图5 不同pH培养Chlorella sp. XQ-200419的总脂含量Fig. 5 Total lipid content of Chlorella sp. XQ-200419 in different pH
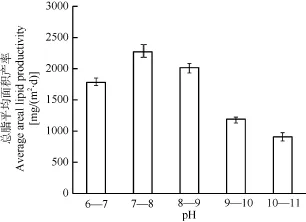
图6 Chlorella sp. XQ-200419在不同pH下的总脂平均面积产率Fig. 6 Average areal lipid productivity of Chlorella sp. XQ-200419 in different pH
3 讨论
pH是藻类生长环境的重要理化指标之一, 许多研究报道了 pH对微藻光合作用、生长及代谢产物的影响。不同的藻类生长的最佳 pH 不同, 偏离最佳pH , 微藻生长和体内有关代谢活动会受到抑制。如钝顶螺旋藻(Spirulina Platensis)生长的最适pH为9.0—9.6, 偏离此值时, 藻体生长变慢, 而且高pH(超过 10.5)还影响藻细胞的形态[22]。新月菱形藻(Nitzschia Closterium)最适生长的pH为6.5, 在此pH下, 藻体的EPA含量也最高[23]。Yongmanitchal等[24]研究发现当初始 pH在 6.4—8.4时三角褐指藻(P. tricornutum)均能很好的生长, 但只有当初始 pH为7.6时 EPA在总酯中含量才最高。王子敬等[25]研究发现小球藻 USTB-01在 pH 7.0 条件下小球藻生长最好而且有利于蛋白质的合成; 随着pH从6.5增加到7.0时, 小球藻USTB-01蛋白质含量从19.17%增加到 23.19%, 但 pH进一步增加时, 蛋白含量却下降。还有研究报道了培养体系 pH的改变可以影响小球藻细胞内pH, 因此可以通过改变培养体系的pH从而影响细胞内的酸碱平衡来控制小球藻细胞的生长和繁殖[26]。徐年军等[27]发现在起始pH 8.5时后棘藻(Ellipsoidion sp.)有最大的生长速率和最高的总脂含量, 而EPA和PUFA在起始pH 7.5时含量最大, 分别占脂肪酸的18.77%和23.38%。可见, pH是影响微藻生长和代谢的重要因子之一。
在培养过程中, 藻液的pH不是稳定的, 而是随着微藻的生长、代谢一直处于变化中。受实验条件等限制, 以前的报道大多集中在研究藻液的起始或收获时的 pH对微藻生长和代谢的影响[13,24,27], 而没有在培养微藻的过程中将 pH 恒定在一定的范围内研究pH对微藻的影响。此外, 在调节藻液pH 时大多采用强酸和强碱, 例如氢氧化钠和盐酸, 而没有使用经济的、在微藻规模化培养中普遍使用的CO2。本研究使用 pH控制仪在线监测藻液 pH, 根据pH变化, 控制CO2的供给与否, 将pH一直控制在设定的范围, 更能准确反映pH对微藻的影响。
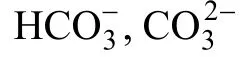
如果使用酸、碱控制pH, 虽然pH处于设定范围内, 但是, 由于光合作用不断消耗碳源, 藻液中可供利用的碳源浓度并不稳定。与酸、碱控制pH 的方法相比, 通过控制CO2补给恒定藻液 pH 的方法有一个优点: 在培养过程中, 不仅pH被恒定在设定的范围内, 由于不断地补充 CO2, 藻液的碳源总浓度也在与pH对应的范围内波动, 即pH和碳源总浓度均处于设定的范围内。
从pH对小球藻Chlorella sp. XQ-200419光合放氧速率的影响看, 在pH 6.5—7.0范围内, 小球藻净光合放氧速率随 pH的增加呈上升趋势, 在pH7.0—9.0的范围内其净光合放氧速率变化不大,均保持在较高的水平; pH低于 7.0, 高于 9.0, 光合放氧速率明显降低。从 pH对生长和产油的影响来看, 在pH 7.0—9.0小球藻生长速率与油脂含量没有显著的差异, 说明小球藻在pH为7.0—9.0的环境下均能很好的生长和积累油脂; pH低于7.0, 高于9.0,小球藻生长速率和总脂含量、产率均显著下降。很显然, pH对小球藻Chlorella sp. XQ-200419光合作用的影响和对生长、产油的影响是一致的。
光合作用特征是微藻最基本、最重要的生理生态特征, 光合作用特性的研究已被用于藻种筛选[8,9]、蓝藻水华发生机理[7]和赤潮发生机理[29,30]的研究。研究表明, 通过研究微藻光合作用对主要理化因子变化的响应, 可以掌握其生长繁殖对理化因子的要求以及对这些理化因子变化的适应性[30]。本研究进一步表明重要理化因子—pH对于微藻光合作用的影响不仅与对其生长的影响是一致的, 而且与对其总脂产率的影响也是一致的, 这一结果启发我们思考: 有利于光合作用的条件也有利于其油脂的积累,这中间的联系环节是什么?能否通过调节产油微藻的光合作用促进其油脂的积累?这些问题值得深入研究。
在 pH7.0—8.0, 小球藻的生物质平均面积产率和总脂平均面积产率都达到最大值, 分别为 8.9和2269.5 mg/(m2·d)。当藻液 pH超过10.0, 生物质平均面积产率和总脂平均面积产率都大幅度降低,与最高值相比, 分别降低 42.1%和 60.0%。可见,为了获得高产率必须将藻液 pH控制在适宜的范围内。
张桂艳等[16]发现, 理化因子对生长和油脂含量的影响分为两种模式: (1) 温度、光强、铁浓度和盐度的影响表现为在适宜生长的条件下油脂含量提高,这种模式称为“适宜模式”; (2) 氮浓度的影响表现为在不利于生长的条件下油脂含量提高, 这种模式称为“胁迫模式”。在适宜模式中, 理化因子对油脂含量、产量的影响是一致的: 利于生长的条件既提高油脂含量也提高油脂产量。在胁迫模式中, 理化因子对油脂含量、产量的影响是不一致的: 不利于生长的条件提高油脂含量但是降低油脂产量。本研究结果表明, pH 7.0—8.0, 小球藻的生物质产率最高; pH 8.0—9.0, 其总脂含量略高于pH 7.0—8.0, 但是差异不显著; pH 7.0—8.0, 总脂产率最高。很显然,适合于小球藻生长的 pH也有利于其积累油脂, 所以, pH对小球藻产油的影响是一种“适宜模式”。本文通过研究pH对小球藻Chlorella sp. XQ-200419光合作用、生长和产油的影响, 发现藻液pH对小球藻Chlorella sp. XQ-200419光合放氧、生长速率、生物质产率、总脂含量和产率都有显著影响, 最适pH是7.0—8.0, 适宜的pH是7.0—9.0, pH低于7.0, 高于9.0, 其光合放氧、生长速率、生物质产率、总脂含量和产率都显著降低; 规模化培养小球藻 Chlorella sp. XQ-200419, 通过补充 CO2将藻液 pH控制在7.0—9.0范围内, 可以获得最高的生物质产率和总脂产率; pH对小球藻Chlorella sp. XQ-200419光合作用的影响和对生长、产油的影响是一致的; 适合于小球藻生长的pH也有利于其积累油脂, pH对小球藻产油的影响是一种“适宜模式”。本研究为规模化培养小球藻Chlorella sp. XQ-200419合理调节藻液pH提供了理论依据。
[1] Zhao Y K, Zhang W S, Wang Y N, et al. Research progress in physiology and molecular biology of plant responses to high pH [J]. Chinese Journal of Eco-Agriculture, 2008, 16(3): 783—787 [赵彦坤, 张文胜, 王幼宁, 等. 高pH对植物生长发育的影响及其分子生物学研究进展. 中国生态农业学报, 2008, 16(3): 783—787]
[2] Bhatii S, Huertas I E, Colman B. Acquisition of inorganic carbon by the marine haptophyte Isochrysis galbana (Prymnesiophyceae) [J]. Journal of Phycology, 2002, 38(5): 914—921
[3] Williams T G, Colman B. The effects of pH and dissolved inorganic carbon on external carbonic anhydrase activity in Chlorella saccharophila [J]. Plant, Cell and Environment, 1996, 19(4): 485—489
[4] Liu H X, Sun Y Y, Wang C H. Effect of pH value and nitrogen on activities of extracellular carbonic anhydrase in Isochrysis galbana [J]. Journal of Yantai University (Natural Science and Engineering Edition), 2008, 21(4): 286—290 [刘洪霞, 孙颖颖, 王长海. pH和氮素对球等鞭金藻胞外碳酸酐酶活性的影响. 烟台大学学报(自然科学与工程版), 2008, 21(4): 286—290]
[5] Liu C G, Jin X C, Sun L, et al. Effects of pH on growth and species changes of algae in freshwater [J]. Journal of Agro-Environment Science, 2005, 24(2): 294—298 [刘春光,金相灿, 孙凌, 等. pH 对淡水藻类生长和种类变化的影响. 农业环境科学学报, 2005, 24(2): 294—298]
[6] You L, Cui L F, Liu Z W, et al. Correlation analysis of parameters in algal growth [J]. Environment Science and Technology, 2007, 30(9): 42—44 [游亮, 崔莉凤, 刘载文,等. 藻类生长过程中DO、pH与叶绿素相关性分析. 环境科学与技术, 2007, 30(9): 42—44]
[7] Li X L, Geng Y H, Li Y G, et al. The advantages in competition based on the photosynthetic characteristics of Microcystis aeruginosa [J]. Journal of Wuhan Botanical Research, 2006, 24(3): 225—230 [李小龙, 耿亚红, 李夜光, 等. 从光合作用特性看铜绿微囊藻(Microcystis aeruginosa)的竞争优势. 武汉植物学研究, 2006, 24(3): 225—230]
[8] Ouyang Z R, Wen X B, Geng Y H, et al. The effect of light intensity, temperature, pH and salinities on photosynthesis of Chlorella [J]. Journal of Wuhan Botanical Research, 2010, 28(1): 49—55 [欧阳峥嵘, 温小斌, 耿亚红, 等. 光照强度,温度, pH, 盐度对小球藻(Chlorella)光合作用的影响. 武汉植物学研究, 2010, 28(1): 49—55]
[9] Zhang B Y, Li Y G, Li Z K, et al. Effects of temperature, light intensity and pH on photosynthesis and grow rate of Haematococcus pluvialis [J]. Oceanologia et Limnologia Sinca, 2003, 34(5): 558—565 [张宝玉, 李夜光, 李中奎,等. 温度、光照强度和pH 对雨生红球藻光合作用和生长速率的影响. 海洋与湖沼, 2003, 34(5): 558—565]
[10] Xu H, Liu Z P, Yuan L, et al. Effect of pH on growth of several freshwater algae [J]. Environmental Science and Technology, 2009, 32(1): 27—30 [许海, 刘兆普, 袁兰, 等. pH对几种淡水藻类生长的影响. 环境科学与技术, 2009, 32(1): 27—30]
[11] Santos A M, Janssen M, Lamers P P, et al. Growth of oil accumulating microalga Neochloris oleoabundans under alkaline-saline conditions [J]. Bioresource Technology, 2012, 104: 593—599
[12] Wang C, Li H, Wang Q Q, et al. Effect of pH on growth and lipid content of Chlorella vulgaris cultured in biogas slurry [J]. Chinese Journal of Biotechnology, 2010, 26(8): 1074—1079 [王翠, 李环, 王钦琪, 等. pH对沼液培养的普通小球藻生长及油含量积累的影响. 生物工程学报, 2010, 26(8): 1074—1079]
[13] Yang X, Hiao Z D, Zhang S, et al. Effects of trophic elements and pH on growth rate and lipid productivity of Chlorella zofingiensis cells [J]. South China Fisheries Science, 2013, 9(4): 33—38 [杨勋, 郝宗娣, 张森, 等. 营养元素和pH 对若夫小球藻生长和油脂积累的影响. 南方水产科学, 2013, 9(4): 33—38]
[14] Lü M M, Yang J H, Zhao J. Phased adjustment paths of medium pH in the process of oleaginous microalgae cultivation [J]. Modern Chemical Industry, 2013, 33(5): 58—60 [吕梦梦, 杨俊红, 赵军. 富油微藻培养过程中pH的分阶段调节路径. 现代化工, 2013, 33(5): 58—60]
[15] Imhoff J F, Sahl H G. The Wadi Natrum: chemical composition and microbial mass developments in alkaline brines of eutrophic desert lake [J]. Geomicrob Journal, 1979, 1: 219—234
[16] Zhang G Y, Wen X B, Liang F, et al. The effects of physical and chemical factors on the growth and lipid productivity of Chlorella [J]. Acta Ecologica Sinica, 2011, 31(8): 2076—2085 [张桂艳, 温小斌, 梁芳, 等. 重要理化因子对小球藻生长和油脂产量的影响. 生态学报, 2011, 31(8): 2076—2085]
[17] Miao F P, Li Y G, Geng Y H, et al. The Effects of temperature on the biomass and the astaxanthin output of Haematococcus pluvialis [J]. Journal of Wuhan Botanical Research, 2005, 23(1): 73—76 [苗凤萍, 李夜光, 耿亚红,等. 温度对雨生红球藻(Haematococcus pluvialis) 生物量和虾青素产量的影响. 武汉植物学研究, 2005, 23(1): 73—76]
[18] Li Y G, Hu H J, Gong X M. Studies on the mechanism of pH value change and carbon conversion ratio of Spirulina media [J]. Chinese Journal of Biotechnology, 1996, 12(supplementary issue): 242—248 [李夜光, 胡鸿钧, 龚小敏. 螺旋藻培养液pH 变化的机理和碳源利用率的研究. 生物工程学报, 1996, 12(增刊): 242—248]
[19] Jiang L L, Wen X B, Geng Y H, et al. A newly selected lipid-rich microalgae strain and its molecular identification [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 606—612 [江丽丽, 温小斌, 耿亚洪, 等. 一株产油微藻的筛选及分子鉴定. 水生生物学报, 2013, 37(4): 606—612]
[20] Chen Y W, Gao X Y. Comparison of two methods for phytoplankton Chlorophyll-a concentration measurement [J]. Journal of Lake Sciences, 2000, 12(2): 185—188 [陈宇炜,高锡云. 浮游植物叶绿素 a 含量测定方法的比较测定.湖泊科学, 2000, 12(2): 185—188]
[21] Wen X B, Jiang L L, Geng Y H, et al. Comparative study of quantitative analysis methods for microalgae total lipid [J]. China Oils and Fats, 2012, 37(11): 80—85 [温小斌, 江丽丽, 耿亚洪, 等. 微藻总脂定量分析方法的比较研究. 中国油脂, 2012, 37(11): 80—85]
[22] Ma C H, Yu L J, Peng Q J. The effects of pH on the growth of Spirulina platensis [J]. China Food Additives, 2004, 4: 68—71 [马成浩, 于丽娟, 彭奇均. pH 对钝顶螺旋藻生长的影响. 中国食品添加剂, 2004, 4: 68—71]
[23] Li M Q, Zhang Q H, Ma Y. Effects of different pH and NaCl levels on the production of EPA and growth of Nitzschia closterium [J]. Modern Food Science and Technology, 2005, 21(2): 55, 74—76 [李梦琴, 张秋会, 马莺. 不同 pH 和NaCl水平对新月菱形藻生长及EPA含量的影响. 现代食品科技, 2005, 21(2): 55, 74—76]
[24] Yongmanitchai W, Ward O P. Growth of and omega-3 fatty acid production by Phaeodactylum tricornutum under different culture conditions [J]. Applied Environmental Microbiology, 1991, 57(2): 419—425
[25] Wang Z J, Jing J K, Xu Q Q, et al. Effects of different temperature and pH on the growth and quality of Chlorella USTB-01 [J]. Modern Chemical Industry, 2009, 29(supplementary issue 2): 210—213 [王子敬, 景建克, 许倩倩, 等.不同温度和pH对小球藻USTB-01生长和品质的效应. 现代化工, 2009, 29(增刊2): 210—213]
[26] Gebl K A, Colman B. Effect of external pH on the internal pH of Chlorella saccharophila [J]. Plant Physiology, 1985, 77(4): 917—921
[27] Xu N J, Zhang X C. Effect of temperature, light Intensity and pH on the growth and fatty acid compositions of Ellipsoidion sp. [J]. Journal of Ocean University of Qingdao (Natural Science Edition), 2001, 31(4): 541—547 [徐年军, 张学成.温度, 光照, pH 对后棘藻生长及脂肪酸含量的影响. 青岛海洋大学学报(自然科学版), 2001, 31(4): 541—547]
[28] Li Y G, Hu H J, Zhang L J, et al. Studies on CO2supply technique for Spirulina production [J]. Journal of Wuhan Botanical Research, 1996, 14(4): 349—356 [李夜光, 胡鸿钧, 张良军, 等. 以 CO2为碳源工业化生产螺旋藻工艺技术的研究. 武汉植物学研究, 1996, 14(4): 349—356]
[29] Deng G, Li Y G, Hu H J, et al. Effects of temperature, light and pH on photosynthesis, and of light-dark cycle on growth rate and biomass of Scrippsiella trochoidea and Alexandrium tamarense [J]. Journal of Wuhan Botanical Research, 2004, 22(2): 129—135 [邓光, 李夜光, 胡鸿钧, 等. 温度、光照和 pH 对锥状斯氏藻和塔玛亚历山大藻光合作用的影响及光暗周期对其生长速率和生物量的影响. 武汉植物学研究, 2004, 22(2): 129—135]
[30] Deng G, Geng Y H, Hu H J, et al. Effects of environmental factors on photosynthesis of a high biomass bloom forming species Prorocentrum donghaiense [J]. Marine Sciences, 2009, 33(12): 34—39 [邓光, 耿亚红, 胡鸿钧,等. 几种环境因子对高生物量赤潮甲藻-东海原甲藻光合作用的影响. 海洋科学, 2009, 33(12): 34—39]
EFFECTS OF PH ON THE PHOTOSYNTHESIS, GROWTH AND LIPID PRODUCTION OF CHLORELLA SP. XQ-200419
ZHANG Hu1,2, ZHANG Gui-Yan1,2, WEN Xiao-Bin1,2, GENG Ya-Hong1and LI Ye-Guang1
(1. Key Laboratory of Plant Germplasm Enhancement and Speciality Agriculture, Wuhan Botanical Garden, Chinese Academy of Sciences, Wuhan 430074, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Chlorella sp. XQ-200419 is a lipid-rich strain with potential application in microalgal biodiesel. To study the effects of pH on the growth rate, areal biomass productivity, total lipid content, and areal lipid productivity of Chlorella sp. XQ-200419, the batch culture was conducted for 8 days with modified BG-11 medium in a pH range of 5.0—6.0, 7.0—8.0, 8.0—9.0, 9.0—10.0, 10.0—11.0, which was monitored by a on-line pH controller in a self–designed photo bioreactor that mimics the open circular pond. We observed that pH significantly regulated the photosynthesis, growth rate, areal biomass productivity, total lipid content and areal lipid productivity of Chlorella sp. XQ-200419 the pH range of 7.0—9.0 was the best condition for culturing Chlorella sp. XQ-200419 and no significant difference was existed in the pH from 7.0 to 9.0. Both pH values below 7.0 and above 9.0 significantly reduced the photosynthesis, growth rate, areal biomass productivity, total lipid content and areal lipid productivity compared with pH range of 7.0—9.0. The photosynthesis was consistent with the growth and lipid production of Chlorella sp. XQ-200419 at all pH conditions.Chlorella sp. XQ-200419 achieved the peak average areal biomass productivity [8.9 g/(m2·d)] and the maximal average areal lipid productivity [2269.5 mg/(m2·d)] in pH 7.0—8.0. The average areal biomass productivity and average areal lipid productivity decreased by 42.1% and 60% at the pH range of 10.0—11.0, respectively. Both the growth and lipid production were enhanced under suitable pH range, indicating that the effects of pH on the lipid production of Chlorella sp. XQ-200419 was a kind of “fitting mode” not “stress mode”. The current study not only evaluated the effects of pH on the photosynthesis, growth and lipid production of Chlorella sp. XQ-200419, but also provided a basis for controlling of proper pH in mass culture of Chlorella for algal lipid production.
Chlorella; Microalgal biodiesel; pH; Photosynthesis; Growth; Lipid production
S968.4
A
1000-3207(2014)06-1084-08
10.7541/2014.159
2013-12-18;
2014-03-15
国家“863”项目(2013AA065805); 国家科技基础性工作专项(2012FY112900); 国家自然科学基金项目(31272680)资助
张虎(1988— ), 男, 河南信阳人; 硕士; 主要从事微藻生物技术研究。E-mail: zhanghu1900@sina.com
李夜光, E-mail: yeguang@wbgcas.cn
