Nec-1对冈田酸诱导的大鼠皮层神经元损伤的保护作用
2014-03-29李艳丽王增仙武敏霞
李艳丽,王增仙,武敏霞
生理条件下,蛋白磷酸酶2A(PP2A)与蛋白激酶调节微管相关蛋白tau蛋白磷酸化水平,处于低水平磷酸化的动态平衡[1]。冈田酸(okadaic acid,OA)是一种蛋白磷酸酯酶抑制剂,对PP2A有特异性抑制作用[2]。OA能使神经元tau蛋白异常过度磷酸化,继而引起神经元毒性[3]。
Degterev等[4]研究发现,在细胞内不存在凋亡信号时,Fas/TNFR能活化一种非凋亡的死亡途径,称为坏死性凋亡(necroptosis)。同时,他们发现一种小分子物质necrostatin-1(Nec-1)可以特异且有效地抑制坏死性凋亡。本研究旨在探讨Nec-1对OA诱导的神经元损伤是否有抑制作用。
1 材料与方法
1.1 试 剂 DMEM/F-12 和 胎 牛 血 清 (Gibco-BRL);Cell Counting Kit-8(CCK-8)、calcein-AM(Dojindo);OA、阿糖胞苷、多聚赖氨酸、Nec-1(Sigma);胰蛋白酶(Biosharp);乳酸脱氢酶(LDH)(南京建成生物工程研究所)。
1.2 原代细胞培养 取新生1 d~3 d Wistar大鼠,分离大脑皮层,用胰酶消化制备单细胞悬液。细胞悬液经1 000 r/min离心5 min,弃上清,用完全培养液(DMEM/F-12培养基+15%胎牛血清)重悬细胞。然后接种于培养瓶或培养板上,在37℃,5%CO2的孵育箱培养。24 h后加入10μmol/L阿糖胞苷。成熟的神经元(8 d~10 d)用于实验。
1.3 实验分组 将 Wistar大鼠分为5组,对照组、OA组(10 nmol/L)、Nec-1组在加入OA前24 h加入不同浓度的Nec-1(10μmol/L,30μmol/L,100μmol/L)预孵育。
1.4 细胞活力检测 细胞在96孔板培养(100μL/孔),向各孔加入10μL CCK-8溶液,在37℃,5%CO2的孵育箱孵育2 h,用酶标仪测定490 nm处OD值。
1.5 LDH的检测 当细胞遭受损伤时,LDH由胞浆释放到胞外。加入OA 24 h后,收集培养液检测LDH活性。
1.6 calcein-AM染色 细胞与calcein-AM避光孵育20 min,PBS避光洗涤两次,在490 nm激发波长,515 nm发射波长的滤光片的荧光显微镜下观察细胞。
1.7 统计学处理 计量资料用均数±标准差(x±s)表示。组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 Nec-1抑制OA引起的细胞活力的下降 CCK-8细胞活力检测发现OA引起皮层神经元损伤。与对照组相比,将神经元暴露于OA 2 h,细胞活力降至(52.55±2.86)%(P<0.01)。在OA作用前24 h用Nec-1预处理神经元可以抑制OA引起的细胞活力的下降。Nec-1(30μmol/L)和 Nec-1(100μmol/L)分别使其增加10%(P<0.05)和19%(P <0.01),但 Nec-1(10μmol/L)并不能抑制OA引起的细胞活力的降低。详见图1。
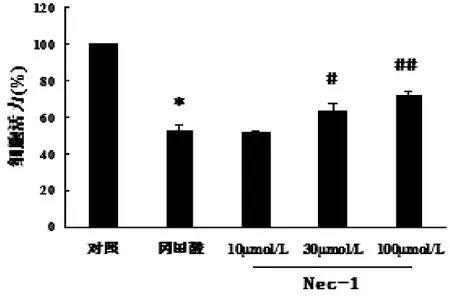
图1 Nec-1抑制OA引起的细胞死亡
2.2 Nec-1抑制OA引起的LDH释放的增加 皮层神经元暴露于OA可引起LDH的释放。OA处理后,LDH水平与对照组相比增加44.36%(P<0.01)。Nec-1(30μmol/L)和 Nec-1(100 μmol/L)预处理分别使LDH释放减少13%(P<0.05)和21%(P<0.01)。详见图2。
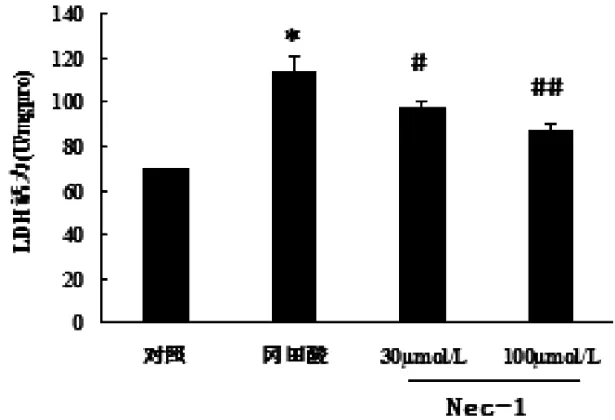
图2 Nec-1抑制OA引起的LDH释放
2.3 Nec-1抑制OA引起的活细胞数的减少 Calcein-AM染色结果发现OA可引起活细胞数减少。OA处理后,Calcein-AM染色阳性的神经元(代表活细胞)与对照组相比减少45.16%(P<0.05)。与 OA处理组相比,Nec-1(30μmol/L)和Nec-1(100μmol/L)分别使活细胞数增加11%(P<0.05)和20%(P<0.01)。
3 讨 论
阿尔兹海默病(AD)是引起老年期痴呆最常见的原因。随着我国人口结构的逐步老龄化,该病的高发病率和危害性也越来越被关注。其主要的病理特征是脑内出现老年斑和神经纤维缠结(NFT)[5]。过度磷酸化的tau蛋白是形成神经纤维缠结的主要成分,在AD发病中发挥重要作用[6]。
PP2A是脑内调节tau蛋白去磷酸化的主要磷酸酶[7]。研究报道,AD病人脑中PP2A活性降低30%左右。PP2A活性降低是导致AD病人tau蛋白过度磷酸化的主要原因[8]。OA是一种特异性的PP2A抑制剂,在体内或体外条件下,OA可使神经细胞内微管相关蛋白tau过度磷酸化,最终导致神经细胞退化[9]。
坏死性凋亡是新近发现的一种细胞死亡方式,Nec-1为其特异且有效的抑制剂,有可能成为临床治疗疾病的一个新靶点[4]。研究发现Nec-1可抑制中风模型或创伤性脑损伤(TBI)模型中的脑损伤[10,11]。前期研究也发现Nec-1抑制NMDA诱导的兴奋性神经毒作用[12]。
本研究发现Nec-1可以抑制OA诱导的大鼠皮层神经元损伤。已证实Nec-1抑制OA引起的细胞活力的降低、LDH释放和活细胞数的减少。这些结果均表明Nec-1对OA诱导的大鼠皮层神经元损伤有保护作用。Nec-1为坏死性凋亡的特异性抑制剂,证明在OA诱导tau蛋白磷酸化引起的神经元损伤中,坏死性凋亡起着重要作用,可以为AD疾病的治疗提供新的靶点。
Tau蛋白过度磷酸化使tau蛋白结合微管能力降低[13],神经元轴突转运障碍[14],导致神经元呈慢性进行性变性。本研究表明在神经元变性过程中有坏死性凋亡的参与。尽管其作用可能只占其中一部分,但坏死性凋亡级联反应是可调节的,所以它可能会为AD的治疗提供一个新的甚至更有效的靶点。
[1] Iqbal K,Grundke-Iqbal I.Pharmacological approaches of neurofibrillary degeneration [J].Curr Alzheimer Res,2005,2(3):335-341.
[2] Fernandez JJ,Candenas ML,Souto ML,et al.Okadaic acid,useful tool for studying cellular processes[J].Curr Med Chem,2002,9(2):229-262.
[3] Feng L,Shen Y,Sun A,et al.Endoplasmic reticulum stress is involved in okadaic acid-induced tau phosphorylation and neurotoxic effects of okadaic acid[J].Neural Regen Res,2010,5(20):1534-1540.
[4] Degterev A,Huang Z,Boyce M,et al.Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J].Nat Chem Biol,2005,1(2):112-119.
[5] Blennow K,de Leon MJ,Zetterberg H.Alzheimer’s disease[J].Lancet,2006,368:387-403.
[6] Lace G,Savva GM,Forster G,et al.Hippocampal tau pathology is related to neuroanatomical connections:An ageing populationbased study[J].Brain,2009,132:1324-1334.
[7] Liu F,Grundke-Iqbal I,Iqbal K,et al.Contributions of protein phosphatases PP1,PP2A,PP2B and PP5 to the regulation of tau phosphorylation[J].Eur J Neurosci,2005,22(8):1942-1950.
[8] Kins S,Crameri A,Evans DR,et al.Reduced protein phos-phatase 2A activity induces hyperphosphorylation and altered compartmentalization of tau in transgenic mice [J].J Biol Chem,2001,276(41):38193-38200.
[9] Zhang Z,Simpkins JW.Okadaic acid induces tau phosphorylation in SH-SY5Y cells in an estrogen-preventable manner[J].Brain Res,2010,1345:176-181.
[10] Degterev A,Huang Z,Boyce M,et al.Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J].Nat Chem Biol,2005,1(2):112-119.
[11] Wang YQ,Wang L,Zhang MY,et al.Necrostatin-1 suppresses autophagy and apoptosis in mice traumatic brain injury model[J].Neurochem Res,2012,37(9):1849-1858.
[12] Li Y,Yang X,Ma C,et al.Necroptosis contributes to the NMDA-induced excitotoxicity in rat’s cultured cortical neurons[J].Neurosci Lett,2008,447(2-3):120-123.
[13] Wang JZ,Grundke-Iqbal I,Iqbal K.Restoration of biological activity of Alzheimer abnormally phosphorylated tau by dephosphorylation with protein phosphatase-2A,-2B and-1[J].Brain Res Mol Brain Res,1996,38(2):200-208.
[14] Yang Y,Yang XF,Wang YP,et al.Inhibition of protein phosphatases induces transport deficits and axonopathy[J].J Neurochem,2007,102(3):878-886.
