紫菀中肽类成分研究进展
2014-03-29朱旭灿张朝凤许翔鸿
朱旭灿,卢 毅,张朝凤,许翔鸿,张 勉
(中国药科大学 生药学研究室,江苏 南京 211198)
紫菀为菊科紫菀属植物紫菀(AstertataricusL.)的干燥根和根茎,为常用中药材,又名青菀、紫菀草、还魂草根等,始载于《神农本草经》,列为中品,主产于河北安国和安徽亳州。具有润肺下气、消痰止咳之功效,主治痰多喘咳、新久咳嗽、劳嗽咳血等症[1]。紫菀化学成分丰富,主要为萜及其苷,其中三萜皂苷是其主要特征性成分,环肽astins是该属比较有特色的一类化学成分,是紫菀抗肿瘤活性的主要成分。2006年,谭宁华[2]等对植物环肽进行了详细的综述并进行了分类,紫菀中的环肽归为菊科类型环肽,至今此类型环肽只在该种中发现。目前已从紫菀中分离得到的环肽类化合物共有17个,其中主要为15个环五肽astins A-I[3-8]和astins K-P[10],两个环四肽tataricins A-B[11];直连肽7个,其中6个直链五肽为asterinin A-F[12,13],1个直链二肽aurantiamide acetate[14]。为了更好地理解及开发此类化合物,本文以紫菀astins为主要对象,对其化学结构、生物活性、构效关系方面的研究综述如下。
1 化学结构
1.1 紫菀肽类的氨基酸组成
紫菀肽类主要为环五肽或直链五肽,氨基酸组成较固定,为脯氨酸(Pro)、L-α-氨基丁酸(Abu)、L-丝氨酸(Ser)、L-β-苯丙氨酸(β-Phe)和L-allo-苏氨酸(allo-Thr);环四肽仍由以上5个氨基酸组成,只是环合的部分为4个氨基酸;astin P中出现L-Ava,这也是Ava残基首次在菊科类型环肽中出现[10]。直链二肽为苯丙氨酸衍生的肽酰胺类物质。
1.2 紫菀环肽的化学结构
迄今为止,已发现的紫菀环肽共17个,15个为环五肽,即astins A-I[3-8]和astins K-P[10];2个为环四肽tataricins A-B[11],其结构式见图1、图2,氨基酸序列见表1。
1.3 紫菀直链肽的化学结构
已发现的直链肽数量较少,含量也较低,其中6个为五肽asterinin A-F[12-13](astin J[9]与asterinin D结构相同,图3),1个直链二肽aurantiamide acetate[14-15]。氨基酸序列见表2。直链五肽可能是环五肽的水解产物。




图1 紫菀中15个环五肽化合物的结构

图2 紫菀中2个环四肽类化合物Tataricins A和B的结构

表1 紫菀中环肽的氨基酸序列
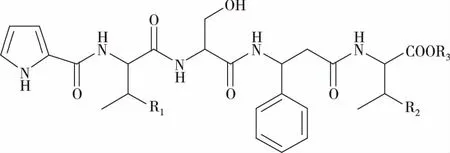

图3 紫菀直链肽类化合物的结构

表2 紫菀中的直链肽的氨基酸序列
1.4 已检测到但尚未分离得到的紫菀肽类
刘晓东等[16]运用HPLC/DAD/ESI-MS方法对紫菀毒性组分Fr-2进行了成分分析。检测并鉴定了其中35个成分,其中包括28个五肽类物质(18个环肽,10个直链肽),其中10个环肽(astin K和astin L后被分离得到[10])和2个直链肽结构为首次报道。紫菀中环肽类成分结构多样,值得进一步的探究。
2 生物活性
2.1 抗肿瘤活性
Allo苏氨酸虽然在自然界中罕见,却是生物活性肽的重要组成部分。Astins A-C都含有氯原子和allo Thr,并具有一个特征的反式肽键。采用计算细胞总体积的方法对astins抗小鼠腹水肿瘤细胞进行了研究发现其显示出中等强度的抗肿瘤活性,Astin A、B的活性约强过astin C 10倍[3]。astin B对 BGC-823细胞(IC50 19.2 μg/mL)、astin C对HCT-116和BGC-823细胞也显示出细胞毒活性,IC50分别为13.4 μg/mL 、3.3 μg/mL[10]。用劳森试剂(Lawesson’s reagents)对astin B和astin C的骨架进行修饰[17],得到的硫代的衍生物均比相应的astins表现出更高的抗肿瘤活性。
2.2 抗氧化
Ng T B[19]等在对紫菀中的紫菀酮、表木栓醇、槲皮素、山萘酚、Aurantiamide acetate等进行抗氧化研究时发现, Aurantiamide acetate对超氧自由基的生成有一定的媒介抑制活性,对脂质过氧化的抑制作用则稍弱。
2.3 免疫抑制
2011年,沈燕、徐会敏[20]等首次发现环肽astin C在1×10-5mg/mL时无细胞毒作用,却有强烈的免疫抑制活性,可触发线粒体凋亡通路,选择性诱导T细胞凋亡,和环孢菌素A作用强度相似而作用机制不同。
2.4 肝毒性
紫菀在临床应用中一直被认为是安全的,也没有任何关于紫菀副作用的报道。然而,张建伟[21]等研究紫菀、款冬配伍规律时,发现小鼠口服紫菀水煎液显示出一定毒性,包括肝毒性和急性毒性,较大剂量下能够引起严重的肝损伤。
王蕾等[22]对紫菀的毒性部位进行研究,发现其Fr-2部位对大鼠可造成急性肝损伤并致死。对Fr-2部位进行分析,主要化学成分为萜类及其皂苷、肽类、香豆素、蒽醌及黄酮类有机酸及酚类等[14,23-24],asitns是紫菀中一类特色成分,其中astin C由于和环氯素具有相似的化学结构,被认为是肝毒性成分之一[4]。环氯素可导致严重的肝毒并作用迅速[25]。astin C和环氯素都具有双氯脯氨酸结构,具有相同的氨基酸序列,主要的区别在于astin C的Abu残基和顺式脯氨酸键在环氯素中被替换成Ser和一个反式的脯氨酸键[26]。从这个角度上来说,astins可能是紫菀中主要的毒性成分。
为了进一步了解紫菀的毒性成分,刘晓东等[16]运用HPLC/DAD/ESI-MS方法对紫菀毒性组分Fr-2进行了成分分析。检测并鉴定了其中35个成分,其中包括28个五肽类物质(18个环肽,10个直链肽),占到了总成分的87%(环肽为71.2%,直链肽为15.8%),其他7个化合物为酚类物质。这个结果提示,肽类,尤其是环肽可能是Fr-2部位及紫菀的主要毒性成分。是否astins就是引起肝毒性的主要成分及其损伤机制,目前正在研究当中。
3 构效关系
3.1 Astin的环状骨架结构
环肽Astin A、B、C等具有抗肿瘤活性[3],而直链astins在体外实验中没有显示对S180细胞的抑制活性[9],这提示astins的天然环状骨架对其抗肿瘤活性的发挥具有重要作用。为了阐释Astins环状结构与抗肿瘤的关系,Filomena Rossi[28]等选择性地合成了一系列Astins类似物并用人类NPA 细胞(乳头状甲状腺癌细胞)进行活性研究,结果发现,其中环状的peptideⅡ和peptideⅢ显示出了抗肿瘤活性,并且,peptideⅢ的IC50值与Astins A 、 B相当,而它们水解开环后的产物及其他合成出的直链肽未表现出抗肿瘤的活性。这进一步证实了Astins的环状结构对抗肿瘤活性起着关键性的作用。
3.2 双氯脯氨酸结构
在发现的15种环肽Astins中,只有具顺式3,4双氯脯氨酸结构的Astin A、B、C具有抗癌活性[3]。在很多文献中,许多学者把具有双氯脯氨酸结构作为抗肿瘤活性的重要因素纳入考虑范围。为了阐明astins A、B、C的抗肿瘤活性和双氯脯氨酸结构存在的关系,对astins A、B、C进行脱氯,并用S180细胞对其脱氯的衍生物进行活性研究,结果发现,所有的脯氨酸脱氯的衍生物在10.0 mg/(kg·d)的剂量下均未表现出抗肿瘤活性[29]。另外,Itokawa H[30]等通过体外抗KB细胞(鼻咽癌细胞)及小鼠体内抗S180细胞和P388淋巴细胞性白血病细胞的实验也证实了双氯脯氨酸结构在astins抗肿瘤活性的发挥中起到了重要作用。
3.3 肽环骨架的柔顺性
肽环骨架的柔顺性也是影响抗肿瘤活性的一大因素。为了增加肽环的柔顺性,常常采用硫化的方法。将Astin B的肽键进行硫化可削弱分子内氢键的影响,增强肽环骨架的柔顺性,硫化的Astin B显示出了更强的抗癌活性[29]。为了进一步解释构象的柔顺性对活性的影响, Cozzolino R等[27]合成了一系列Astins类似物并对其进行活性研究,其中脯氨酸脱氯并硫化的peptideⅢ抗NPA细胞的活性与Astins A 、B相当。这也是首次发现的不具顺式双氯脯氨酸结构的却和astin A、B活性相当的astins类似物。
3.4 肽环中Thr2和Ser3残基间氢键的影响
通过对Astin B晶体的结构分析,Cozzolino R 等[27]发现Astin B 肽环中Thr2和Ser3残基间的分子内氢键作用是促使Astin B结构稳定的原因,并提出这种结构与抗肿瘤活性密切相关。然而,该说法只是假设,缺乏有效实验数据佐证。
4 结语和展望
近年来植物环肽的研究取得长足进展,但目前主要的研究目的还是从中寻找具有生物活性的先导物。紫菀中的环肽作为其特有的一类成分,以其新颖的结构和所具有的生物活性引起了人们极大的兴趣。对其进行深入的研究,不论是从分类学意义上、还是寻找活性先导物及紫菀的用药安全性上都具有重要的意义。
参考文献:
[1] 国家药典委员会.中国药典:一部[S].北京:中国医药科技出版社,2010:322.
[2] Tan N H, Zhou J. Plant cyclopeptides[J]. Chemical reviews,2006,106(3):840-895.
[3] Morita H, Nagashima S, Takeya K, et al. Astins A and B, antitumor cyclic pentapeptides fromAstertataricus[J]. Chemical & pharmaceutical bulletin,1993,41(5):992.
[4] Kosemura S, Ogawa T, Totsuka K. Isolation and Structure of Asterin, a new halogenated cyclic penta-peptide fromAstertataricus[J]. Tetrahedron letters,1993,34(8):1291-1294.
[5] Morita H, Nagashima S, Takeya K, et al. Structures and conformation of antitumour cyclic pentapeptides, astins A, B and C, fromAstertataricus[J].Tetrahedron,1995,51(4):1121-1132.
[6] Morita H, Nagashima S, Shirota O, et al. Two novel monochlorinated cyclic pentapeptides, astins D and E fromAstertataricus[J].Chemistry Letters,1993(11):1877-1880.
[7] Morita H, Nagashima S, Takeya K, et al. Cyclic Peplides from Higher Plants. Part 8. Three Novel Cyclic Pentapeptides, Astins F, G and H fromAstertataricus[J].Heterocycles-Sendai Institute of Heterocyclic Chemistry,1994,38(10):2247-2252.
[8] Morita H, Nagashima S, Takeya K, et al. Cyclic peptides from higher plants. II. A novel cyclic pentapeptdie with a β-hydroxy-γ-chloroproline fromAstertataricus[J].Chem Lett,1994,42:2009-2010.
[9] Morita H, Nagashima S, Takeya K, et al. Structure of a new peptide, astin J, fromAstertataricus[J].Chemical & pharmaceutical bulletin,1995,43(2):271-273.
[10] Xu H M, Zeng G Z, Zhou W B, et al. Astins K-P, six new chlorinated cyclopentapeptides fromAstertataricus[J].Tetrahedron,2013,69(37):7964-7969.
[11] Xu H M, Yi H, Zhou W B, et al. Tataricins A and B, two novel cyclotetrapeptides fromAstertataricus, and their absolute configuration assignment[J].Tetrahedron Letters,2013,54(11):1380-1383.
[12] Dongliang C, Yu S, Hartman R, et al. Oligopeptides fromAstertataricus[J].Phytochemistry,1994,36(4):945-948.
[13] Cheng D L,Shao Y,Hartmann R,et al.New pentapeptides fromAstertataricus[J].Phytochemistry,1996,41(1):225-227.
[14] 卢艳花,舒跃中.紫菀化学成分的研究[J].中国药科大学学报,1998,29(2):97-99.
[15] Wang ZT, Lu YH, Ye WC, et al. A dipeptide isolated fromAstertataricus[J].Journal of Chinese Pharmaceutical Sciences,1999,8:171-172.
[16] Liu XD, Cao PP, Zhang CF, et al. Screening and analyzing potential hepatotoxic compounds in the ethanol extract of Asteris Radix by HPLC/DAD/ESI-MS technique[J].Journal of pharmaceutical and biomedical analysis,2012,67:51-62.
[17] Morita H, Nagashima S, Takeya K, et al. Solution forms of antitumor cyclic pentapeptides with 3,4-dichlorinated proline residues, astins A and C, fromAstertataricus[J].Chemical & pharmaceutical bulletin,1995,43(8):1395-1397.
[18] Morita H, Nagashima S, Takeya K, et al. Thionation of an antitumour cyclic pentapeptide, astin B, fromAstertataricus[J].Bioorganic & Medicinal Chemistry Letters,1995,5(7):677-680.
[19] Ng T B, Liu F, Lu Y, et al. Antioxidant activity of compounds from the medicinal herbAstertataricus[J].Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2003,136(2):109-115.
[20] Shen Y, Luo Q, Xu H, et al. Mitochondria-dependent apoptosis of activated T lymphocytes induced by astin C, a plant cyclopeptide, for preventing murine experimental colitis[J].Biochemical pharmacology,2011,82(3):260-268.
[21] 张建伟,窦昌贵,张勉,等.紫菀、款冬及其配伍的毒性及药效学研究[J].中国临床药理学与治疗学,2007,12(4):405-411.
[22] 王蕾,张勉,金晶,等.紫菀的毒性部位及对小鼠的急性肝损伤作用研究[J].时珍国医国药,2010,21(10):2526-2529.
[23] 侯海燕,陈立,董俊兴.紫菀化学成分及药理活性研究进[J].中国药学杂志.2006,41(3):161.
[24] 王国艳,吴弢,林平川,等.紫菀酚类化学成分的研究[J].中国中药杂志,2004,28(10):946-948.
[25] Terao K, Ito E, Tatsuno T. Liver injuries induced by cyclochlorotine isolated from Penicillium islandicum[J]. Archives of toxicology,1984,55(1):39-46.
[26] Schumacher K K, Hauze D B, Jiang J, et al. First total synthesis of astin G[J].Tetrahedron letters,1999,40(3):455-458.
[27] Cozzolino R, Palladino P, Rossi F, et al. Antineoplastic cyclic astin analogues kill tumour cells via caspase-mediated induction of apoptosis[J].Carcinogenesis,2005,26(4):733-739.
[28] Rossi F, Zanotti G, Saviano M, et al. New antitumour cyclic astin analogues: synthesis, conformation and bioactivity[J].Journal of Peptide Science,2004,10(2):92-102.
[29] Morita H, Nagashima S, Takeya K, et al. Cyclic peptides from higher plants. Part 21 . Thionation of the antitumour cyclic pentapeptides, astins A, B and C, fromAstertataricus[J].J Chem Soc,Perkin Trans 1,1995(18):2327-2331.
[30] Saviano G, Benedetti E, Cozzolino R, et al. Influence of conformational flexibility on biological activity in cyclic astin analogues[J].Peptide Science,2004,76(6):477-484.
