无患子水提皂素液发酵精制联产生物表面活性剂槐糖脂
2014-03-29赵丹青朱莉伟孙达峰张卫明蒋建新
付 尧,赵丹青,朱莉伟,孙达峰,张卫明,蒋建新*
(1.北京林业大学 材料科学与技术学院,北京 100083; 2.南京野生植物综合利用研究院,江苏 南京 210042)
无患子皂素是一种天然非离子表面活性剂,具有良好的起泡性能,其表面活性物质为三萜皂苷类和倍半萜糖苷类、脂肪油和蛋白质。能有效去除污垢,有良好的清洁能力,并且在一些文献中报道无患子皂素具有抗菌、增白、祛斑、祛痘、防止皮肤病的药用功能[1-4],可以在各种护肤品中作为天然活性物质的主要成分。
生物表面活性剂是天然表面活性剂的一种, 是微生物在特定条件培养时分泌的具有表面活性的一类代谢产物[5-7]。与化学合成的表面活性剂相比, 生物表面活性剂除具有降低表面张力、稳定乳化液和增加泡沫等相同作用外,还具有一般化学合成表面活性剂所不具备的无毒、良好的选择性和专一性、能生物降解、生物相溶性好等优点[8]。在食品工业、精细化工、医药和农业等工业方面越来越受到青睐。
丘陵假丝酵母是能够生产生物表面活性剂的菌种,可以利用葡萄糖为碳源,进行发酵,生产槐糖脂,具有较高的产量。
本研究根据无患子水提液中含有较高浓度的纤维二糖和葡萄糖,纤维二糖经酶水解,以水提水解液为底物,接种丘陵假丝酵母和相应的发酵培养基,利用无患子水提溶液中的葡萄糖作为碳源,生产生物表面活性剂槐糖脂,在精制皂素的同时,发酵生产生物表面活性剂,从而达到无患子皂素的精制与高值化利用。
1 材料和方法
1.1 材料
原料与试剂:无患子果皮,产自福建;纤维二糖酶,丹麦Novozymes公司;NaOH,KOH,MgSO4·7H2O,KH2PO4,Na2HPO4·12H2O,均为分析级,浓硫酸,美蓝,无水乙醇,北京化工厂;香草醛,天津津科化工厂;葡萄糖,天津市化学试剂三厂;琼脂,蛋白胨,酵母膏,北京奥博星生物技术有限责任公司;葡萄糖、纤维二糖标准品,美国Sigma公司;丘陵假丝酵母(CGMCC2.1654),CGMCC为中国普通微生物菌种保藏管理中心。
实验仪器:L-550台式低速大容量离心机,长沙湘仪离心机仪器有限公司;手提式不锈钢高压蒸汽消毒器,上海三申医疗器械有限公司;HANGPING FA1004N型电子天平;Eppendoff移液枪100 μL/1 000 μL;HIQ-F160全温振荡培养箱,哈尔滨市东联电子技术开发有限公司;JK99B全自动表面张力仪,上海中晨数字技术设备有限公司;SW-CJ-IFD洁净工作台,苏州安泰空气技术有限公司;MJ-16B-Ⅱ型霉菌培养箱,上海跃进医疗器械厂;Canon Power Shot S80数码相机;PHS-25数显pH计,上海雷磁技术有限公司;Leica CME生物显微镜;UV-2000型紫外-可见分光光度计,尤尼柯(上海)仪器有限公司;Waters 2695e高效液相色谱仪,美国Waters公司;布氏漏斗;B-260旋转蒸发仪,上海亚荣生化仪器厂;DZF-6051型真空干燥箱,上海一恒科技有限公司;2151罗氏泡沫仪,上海隆拓仪器设备有限公司。
1.2 方法
1.2.1 培养基的配置
固体培养基:葡萄糖10 g/L,蛋白胨10 g/L,酵母膏5 g/L,琼脂20 g/L;
液体培养基:葡萄糖10 g/L,蛋白胨10 g/L,酵母膏5 g/L;
发酵培养基:KH2PO41 g/L,Na2HPO4·12H2O 1 g/L,MgSO4·7H2O 0.5 g/L,酵母膏5 g/L。
1.2.2 产表面活性剂菌株的种子培养
丘陵假丝酵母(CGMCC2.1654)株菌株购买时以干细胞形式储存于安瓿管内,在超净工作台中操作,安瓿瓶口在酒精灯上加热,滴加两滴无菌水使安瓿瓶开裂处小口,向瓶内滴加相应的灭菌液态培养基,摇匀,吸取菌悬液 加入到对应的固态斜面培养基中,丘陵假丝酵母于28 ℃培养2天,生长出的菌株作为第一代菌株。
将第一代菌株 接种到固态斜面培养基上,在28 ℃的培养温度下培养2天。挑取第一代斜面上的菌落划线接种到固态斜面培养基上,生长出的菌株作为第二代菌株。
将第二代菌株按照同样的步骤,进行第三代培养,到第三代后菌种性质及形态都趋于稳定,将第三代菌种作为后续培养、发酵的基础菌株。丘陵假丝酵母取2只第三代斜面培养菌株,用灭菌液体石蜡封存,4 ℃冰箱保存。
将第三代菌株接种到液体培养基中,在全自动恒温摇床中震荡培养48 h,制备成种子悬液。具体方法:挑取一环第三代培养的菌株,接到液体培养基中,液体培养基中加入适量玻璃珠,28 ℃,130 r·min-1培养48 h。
1.2.3 菌株的形态观察
将挑取第三代菌株斜面上的菌落,划线到固体平板培养基上进行培养。用平行划线法,选出单菌落菌株。挑取丘陵假丝酵母单菌落大载玻片上,用美蓝溶液进行染色,在生物显微镜下进行细胞的观察,并用相机拍照,记录形态。
美蓝溶液的配置:A液,美蓝0.6 g,溶于30 mL 95%乙醇中;B液,KOH 0.01 g,溶于100 mL去离子水中。使用时A,B溶液进行混合。
1.2.4 无患子水提液底物制备
称取50 g无患子干燥果皮(果皮经粉碎,过20目筛),加入300 mL去离子水,在60 ℃恒温摇床中以150 r·min-1振动提取4 h。将提取液置于离心机中以3 000 r·min-1离心15 min,收集上层清液,即为无患子皂素水提液。由液相色谱分析其中纤维二糖、葡萄糖等浓度。用10%的NaOH溶液,滴加1~2滴调节溶液pH值为4.8。向溶液加入10 IU纤维二糖酶,45 ℃,180 r·min-1的全温震荡培养箱中进行酶解96 h。在水解酶解过程中,前12 h,每2 h取1次酶解样品,12 h后,每12 h取1次酶解样品。最后将酶解液作为丘陵假丝酵母的发酵底物。
1.2.5 生物表面活性剂发酵
将三角瓶加棉塞、牛皮纸,发酵培养基,去离子水,在121 ℃的条件下灭菌20 min。将三角瓶编号 1,2,3,4、5,每瓶加入30 mL无患子水提皂素酶解液。1号为空白组,不接发酵菌种,不加培养基,加入无菌水,补充体积其他组份相同。2、3、4号组份分别接入2%、5%和8%的丘陵假丝酵母,加入相同体积的发酵培养基。5号为3号的对照组,在接种量为5% 的前提下,补充加入5 g/L大豆油。28 ℃,130 r·min-1的全温震荡培养箱发酵168 h。用高效液相色谱检测发酵液中糖浓度,浓硫酸-香草醛显色法[9]检测发酵液中表面活性物质浓度,全自动表面张力仪测定发酵液表面张力。
2 结果与讨论
2.1 产表面活性剂菌株的种子培养
丘陵假丝酵母在经过三代的培养,菌株形态及活性以完全稳定,可作为实验菌株进行发酵实验。使菌株划线接种到平板培养基,在其适宜的培养基下生长,具体情况见图1。

A:丘陵假丝酵母;B:丘陵假丝酵母结晶紫染色显微观察
丘陵假丝酵母在培养24 h后,培养基表面分布白色膜状物,在培养基上有白色菌落,在培养48 h后,菌体在生长繁盛,生长出大量白色菌体。挑选划线培养尾端的单菌落进行美蓝染色,显微镜观察,见图1B。丘陵假丝酵母细胞呈球状,分散排列,是一种能形成假菌丝、不产生子囊孢子的酵母。
2.2 无患子水提液酶解过程
在向无患子水提液加入纤维二糖酶进行水解酶解后,水提液中的纤维二糖浓度随着水解时间的增长而降低,同时葡萄糖浓度随着水解酶解时间的增长而升高(见图2)。 无患子水提液中初始含有纤维二糖33.75 g/L,在加入纤维二糖酶的酶解后,纤维二糖完全酶解为葡萄糖,溶液中葡萄糖浓度为27.93 g/L,香草醛-浓硫酸法测其中皂素含量为133.6 g/L。在水解的前10 h,酶解速率较快,葡萄糖的转化速率较高,同时纤维二糖浓度在水解前10 h降低最为明显,在后续的水解过程中葡萄糖的转化率趋于平缓。在水解72 h 时,纤维二糖浓度为0 g/L,完全转化为葡萄糖,葡萄糖浓度达到最高,完成酶解过程。
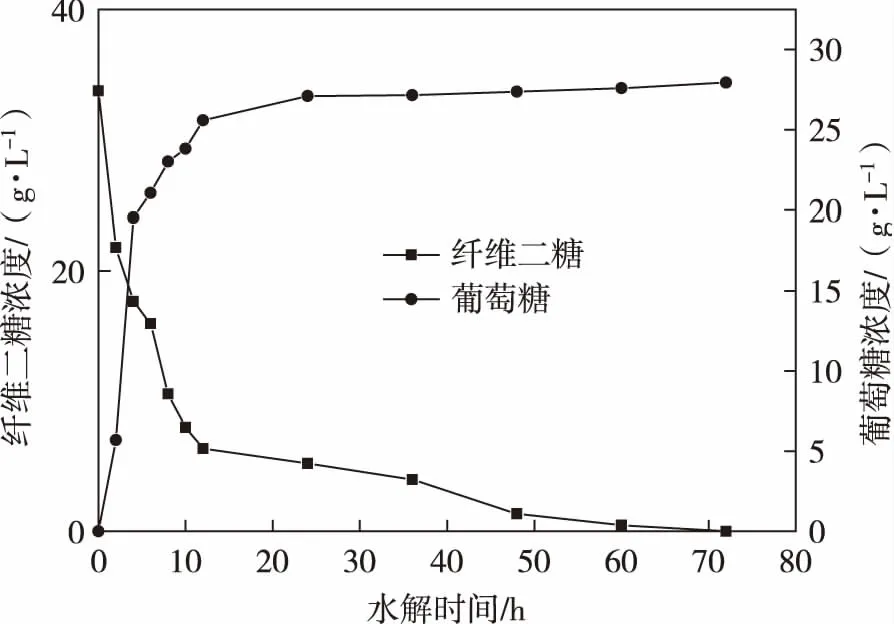
图2 无患子水提液酶法酶解过程糖浓度变化
在水解酶解过程中,水解液的表面张力随时间的变化曲线见图3。无患子水提液的在水解过程中,溶液表面张力呈波动状,但基本维持在57.2 mN/m左右。在水解前10 h,溶液表面张力波动幅度较大,可能原因是在这过程中纤维二糖酶将大量的纤维二糖降解为葡萄糖,溶液中葡萄糖浓度突然增大,而无患子皂素结构中也有糖基。溶液中糖浓度的增大会对无患子皂素的表面张力产生一定的影响,使得表面张力波动幅度较大。而在水解10 h以后,溶液表面张力波动较为平缓,由图2得知,在此时间段,溶液中葡萄糖转化率较低,糖浓度变化较小,对溶液中皂素表面张力影响也较小,所以在水解后期,溶液表面张力比较平缓。在水解过程中,溶液表面张力变化不大,在57.2 mN/m上下浮动,说明纤维二糖酶的酶解对无患子皂素影响不大,皂素性质在酶解过程总保持稳定。同时也说明酶蛋白对无患子皂素性质影响不大,对后续接入菌株进行发酵提供了可能性。
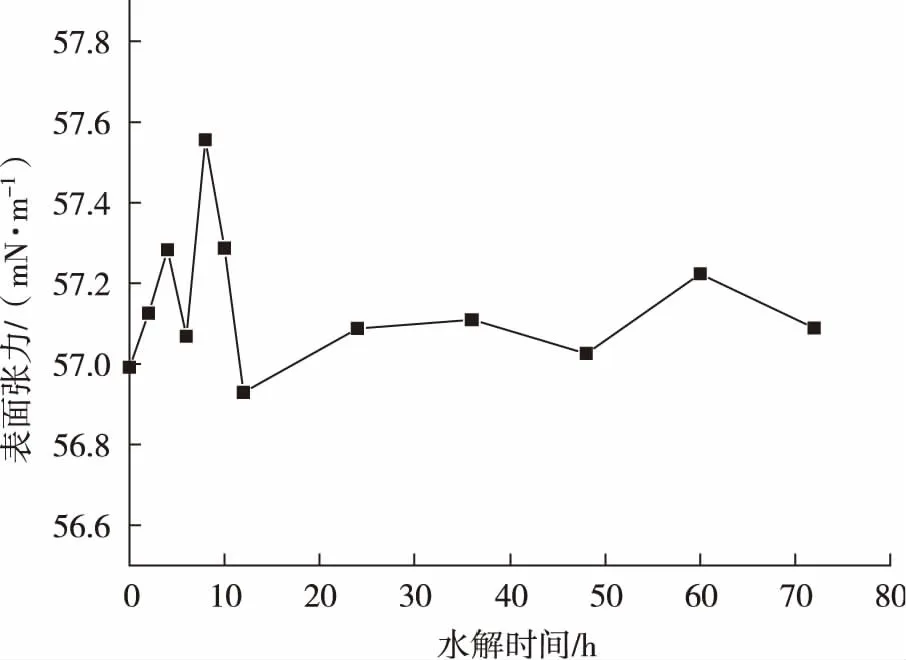
图3 无患子水提液酶解水解过程中表面张力变化
2.3 丘陵假丝酵母发酵生产槐糖脂生物表面活性剂
丘陵假丝酵母在一定的发酵条件下,可以产生槐糖脂类的表面活性物质,能有效降低溶液的表面张力。以无患子水提皂素液为底物,接种菌种进行发酵,发酵液中葡萄糖浓度随发酵时间的变化情况见图4。
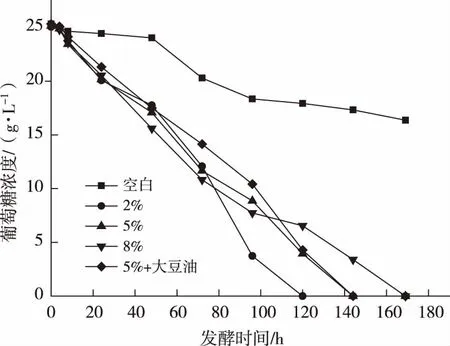
图4 丘陵假丝酵母接种量与发酵过程中葡萄糖浓度变化
发酵初始,溶液中葡萄糖浓度为25.33 g/L,空白溶液未接入菌种。接入发酵菌的分别为2%,5%,8%,在接种量为5% 的组份中,补充加入5 g/L大豆油作为对照。在未加入大豆油的组份中,葡萄糖的消耗量随着发酵时间的增长而降低,菌种利用葡萄糖为碳源,进行发酵生产表面活性剂。在发酵的前24 h,反应速率最快,葡萄糖浓度降低幅度较大。在发酵中期,各样品组份发酵速率保持一致,在发酵96 h 时,接种量为2%的组份葡萄糖浓度迅速降低,且低于同时期其他组份,在发酵120 h时,发酵液中葡萄糖浓度完全消耗。接种量为5%和8%的组份中,均在144 h时发酵完毕,发酵液中无残留葡萄糖。在加入大豆油的对照组份中,葡萄糖的消耗量与其他组保持一致,没有明显的降低,说明对于丘陵假丝酵母,主要利用葡萄糖作为碳源进行发酵,而且大豆油的加入,增加了发酵体系中碳源的浓度,延长了发酵时间,使得发酵体系在168 h时完全消耗葡萄糖,完成发酵。适当的菌种接入量即可达到发酵消耗葡萄糖的效果,并且无患子水提液中具有较为丰富的碳源,可以作为丘陵假丝酵母的发酵。
发酵过程中的溶液表面张力变化趋势图见图5。由图中可以看出,在丘陵假丝酵母的发酵过程中,溶液表面张力波动明显,并且在波动中保持降低的趋势。空白的表面张力基本维持在57.512 mN/m,最终表面张力为57.366 mN/m。接种量对溶液的最终表面张力有较小影响,接种量为2%的组份最终表面张力为56.083 mN/m,5%和8%的组份最终表面张力分别为56.112 mN/m、56.172 mN/m。最终溶液表面张力随着接种量的升高而升高,说明在以无患子水提液为底物的发酵体系中,适当的接种丘陵假丝酵母就能达到较好的发酵效果,同时接种量越小,溶液的表面张力值越低。对于额外加入5 g/L大豆油的组分,在发酵24 h~72 h之间,发酵液表面张力迅速下降,说明在此时产生大量表面活性物质,能有有效降低溶液的表面张力。72 h之后,溶液的表面张力也略有升高,但也依旧保持降低的趋势,最终表面张力值为55.399 mN/m。与空白组份对比,接入发酵菌和大豆油,均使溶液表面张力有所降低,且加入大豆油的组份降低最为明显,说明产生表面活性物质较多,有效降低溶液表面张力。
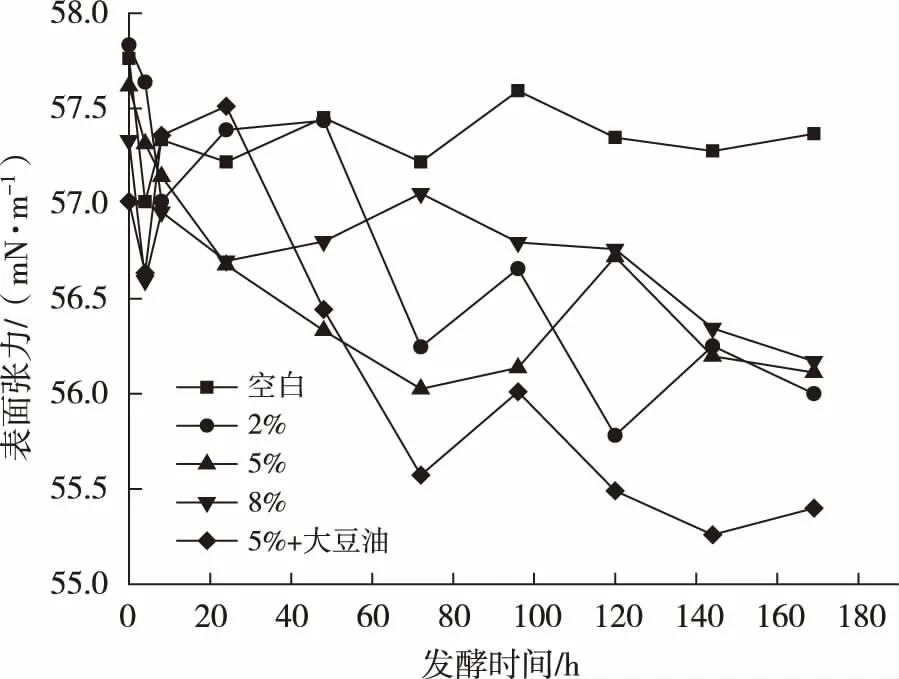
图5 丘陵假丝酵母发酵过程中发酵液表面张力变化
2.4 最终表面活性物质浓度
对发酵结束溶液表面活性物质浓度,采用浓硫酸-香草醛法进行测定,测定结果见表1,可以看出,在经过发酵后,溶液中表面活性物质浓度都有明显的升高,空白组中表面活性物质主要是无患子果皮皂素。在丘陵假丝酵母(CGMCC2.1654)发酵中,最终发酵液的酸性增高,复合酵母发酵液呈酸性的特点,并且与空白相对比,经过发酵,丘陵假丝酵母产生了较多的槐糖脂类表面活性物质,在接种量为5%,添加大豆油的样品组中,最后表面活性物质浓度最高,达到52.58 g/L,浓度升高23.4%。
菌株经过发酵生产的表面活性物质,溶液的表面活性物质浓度升高,表面张力值有所下降,说明无
患子表面活性剂与槐糖脂类表面活性剂可以达到很好的相溶性,并且有一定的增效作用。

表1 发酵结束后发酵液表面活性物质浓度
3 小 结
将丘陵假丝酵母经过三代培养后,接入种子培养基,并观察细胞形态,丘陵假丝酵母细胞呈球状,分散排列。无患子水提皂素液经过纤维二糖酶(加入量为每克纤维二糖底物加10 IU)的酶解后,添加发酵培养基,接入不同量的发酵种子菌种液。在发酵过程中,水提液中的葡萄糖完全消耗,2%接种量,溶液中葡萄糖消耗速率最快,且最终溶液表面活性物质达到52.48 g/L,升高了23.4%,溶液最终表面张力值都明显降低。在精制皂素的同时,利用杂质生产生物表面活性剂。无患子水提皂素液精制与生物表面活性剂转化过程耦合,工艺独创。
参考文献:
[1] Nakayama K, Fujino H, Kasai R, et ai. Solubilizing properties of saponins from Sapindus mukurossi Gaertn[J]. Chem Pharm Bull(Tokyo),1986,34:3279-3283.
[2] Kasai R, Fujino H, Kuzuki T, et al. Acyclic sesquiterpene oligoglycoside from pericarps of Sapindus mukurossi[J]. Phytochemistry,1986,25:871-876.
[3] Ni W, Hua Y, Liu H Y, et al. Tirucallane-type triterpenoid saponins from the roots of Sapindus mukorossi[J]. Chem Pharm Bull (Tokyo),2006,54:1443-1446.
[4] 周自圆,朱莉伟,李雪,等.不同居群无患子果实组成比较研究[J].中国野生植物资源,2011,30(4):61-65
[5] Das P, Mukherjee S, Sen R. Genetic regulation of the biosynthesis of microbial surfactants: An overview[J]. Biotechnology and Gen-et Eng Rev,2008,25:165-186.
[6] Mukherjee S, Das P, Sen R. T owards commercial production of m-icrobial surfactants[J]. Trends Biotechnol,2006,24(11):509-515.
[7] Christofi N, Ivshina I B. Microbial surfactants and their use in field studies of soil remediation[J]. J Appl Microbiol,2002,93(6):915-929.
[8] Banat I M, Franzetti A, Gandolfi I, et al. Microbia biosur-factants production, applications and future potential[J]. Applied Microbiology and Biotechnology,2010,87(2):427-444.
[9] 侯如燕,宛晓春,黄继轸.油茶皂苷标准品的制备及定量方法的比较[J]. 食品与发酵工业,2005,31(8):62-65.
