麸皮酶解制备还原糖的工艺研究
2014-03-27刘俊红赵彩霞陆友云
刘俊红,洪 军,赵彩霞,陆友云
(河南城建学院 生命科学与工程学院,河南 平顶山 467036)
0 引言
进入21 世纪以来,人类在能源、资源、环境等方面面临着越来越严峻的挑战.中国的情况尤为突出[1-2]:一方面,中国的石油对外依存度已经过半,大部分石油消费要靠进口,国家的能源安全和经济安全无法得到保证;另一方面,大量使用矿石燃料又严重污染环境.乙醇燃料无疑是化石类能源的最佳替代能源.生物质转化为生物乙醇工艺无论是从可行性、清洁性抑或是经济性来看都具有可大规模工业化应用的前景[3-4].
燃料乙醇的发展经历了两个阶段:淀粉质原料和纤维素原料.前者的发展由于粮食供应问题受到限制,后者的发展是利用农业废弃物为原料展开的,属于清洁、可再生能源,其中以秸秆为原料进行的生物乙醇的研究受到广泛关注.秸秆结构中,纤维素和半纤维素被木质素层层包裹,降低了酶的可及性[5],在同样的处理条件下,酶解效率偏低;麸皮是面粉加工的剩余物,含有粗纤维和淀粉,经酶解后可得到还原糖,进而发酵制备乙醇.麸皮来源广、成本低,为生物乙醇发展提供了丰富的原料.
笔者通过研究温度、时间、pH、PBS(Phosphate Buffered Saline,磷酸缓冲液)的用量及淀粉酶和纤维素酶(以下简称双酶)的配比等因素对双酶降解麸皮还原糖得率的影响,进而找到双酶降解的最佳条件,以利于研究后续的乙醇发酵生产条件.
1 材料与方法
1.1 试验材料
麸皮:市售,烘干后用粉碎机粉碎,过60 目筛密封保存.干燥时使用鼓风干燥箱,温度设定为70℃,避免过高温度[6].
1.2 试验器材与试剂
QE-100 屹立高速中药粉碎机:浙江屹立工贸有限公司;LDZX-75KBS 蒸汽灭菌器:上海申安医疗器械厂;HWS28 型电热恒温水浴锅:上海一恒科学仪器有限公司;KDC-1044 低速离心机:科大创新股份有限公司;721 紫外可见分光光度计:北京普新通用仪器有限公司、PHSJ-3F 型pH 计:上海精密科学仪器有限公司.
3,5-二硝基水杨酸(化学纯):上海科丰化学试剂有限公司;NaOH(分析纯):莱阳市双双化工有限公司;酒石酸钾钠(分析纯):天津市恒兴化学试剂制造有限公司;苯酚(分析纯):天津市大茂化学试剂厂;亚硫酸钠(分析纯):洛阳市化学试剂厂;盐酸(分析纯):洛阳市化学试剂厂;α-淀粉酶:和氏璧生物技术有限公司,2 000-5 000 U/g;纤维素酶:和氏璧生物技术有限公司,20 000 U/g;糖化酶:北京奥博星生物技术有限责任公司,100 000 U/g;磷酸氢二钾(分析纯):天津市科密欧化学试剂开发中心;磷酸二氢钾(分析纯):天津市科密欧化学试剂开发中心.
1.3 方法
1.3.1 试剂配制
DNS 试剂:将6.3 g 3,5-二硝基水杨酸溶于262 mL 的2 mol/L 的NaOH 中,加到500 mL 含有182 g 的酒石酸钾钠的热水溶液中,再加5 g 苯酚和5 g 亚硫酸钠,充分搅拌溶解,冷却后加水定容到1 000 mL,贮藏于棕色瓶中,避光保存,备用.
1.3.2 单因素与正交试验[6-8]
每次称取2 g 过60 目筛的麸皮,初始液固比为5,加入10 mL 1.5%的稀盐酸,在120 ℃下预处理80 min 后,将试样取出冷却至室温,加磷酸盐缓冲液(PBS:0.2 mol/L,pH 7.2)并用稀盐酸调pH值,加入淀粉酶、纤维素酶,反应结束后加入糖化酶40 ℃反应1 h.分析温度、时间、pH 值、PBS 用量、双酶配比等因素对酶解糖化率的影响,得出麸皮酶解的最佳工艺条件.
①温度的选择:双酶配比3∶3,加入8 mL 磷酸盐缓冲液,调整体系的pH 值至4.5,在30~70 ℃(温度增量为10 ℃)之间处理40 h.
②反应时间的确定:双酶配比3∶3,加入8 mL磷酸盐缓冲液,调整体系的pH 值至4.5,50 ℃进行反应,反应时间20~60 h,时间梯度10 h.
③pH 值的影响:双酶配比3:3,加入8 mL 磷酸盐缓冲液,调整体系pH 值至3.5~5.5,梯度为0.5,50 ℃反应40 h.
④PBS 用量:双酶配比3∶3,加入4~20 mL 的磷酸盐缓冲液,增量为4 mL,调整体系pH 值至4.5,50 ℃反应40 h.
⑤双酶比例:双酶配比依次为3∶3、3∶2、3∶1、1∶3、2:3,加入8 mL 的磷酸盐缓冲液,调整体系pH值至4.5,50 ℃反应40 h.
反应结束后,反应液在3 600 r/min 下离心7 min,吸取上清液进行一定比例稀释(吸取1 mL 的反应液,加入6~10 mL 的蒸馏水)后,取2 mL 稀释液到小试管,将2 mL DNS 试剂加入小试管,充分混匀后沸水浴7 min,冷却后测550 nm 处的吸光值.在单因素试验的基础上设计正交试验,得出麸皮酶解的最佳工艺条件.
1.3.3 分析方法
测吸光值采用DNS 进行显色,吸取离心液的上清液进行一定比例稀释后,取2 mL 稀释液到小试管,将2 mL DNS 试剂加入小试管,充分混匀后沸水浴7 min,冷却后测550 nm 下的吸光值,记录试验数据.
还原糖标准曲线:y=7.108 6x-0.096 5(x 为葡萄糖含量mg/mL,y 为OD 值);

2 结果与分析
2.1 单因素试验
2.1.1 温度对还原糖得率的影响
预处理温度对还原糖得率的影响见图1.
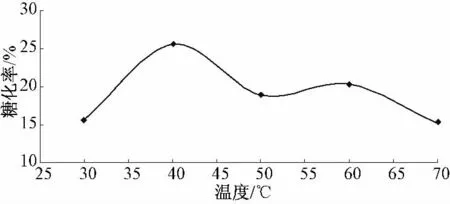
图1 温度对麸皮酶解制备还原糖的影响
由图1 可以看出,随着温度的逐渐升高,酶解糖化率随之增大,当温度达到40 ℃时,酶解总糖化率达到25.64%,即为该反应体系酶的最适反应温度.酶的最适温度是随温度上升酶活性的增强和酶的变性失活两方面综合作用的结果.温度既影响化学反应速度,又影响酶的稳定性和空间构象,进而影响酶的生物活性.当温度继续上升时,酶的活性下降,酶解糖化率开始下降.
2.1.2 时间对还原糖得率的影响
预处理时间对还原糖得率的影响见图2.
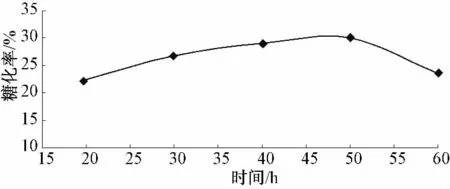
图2 时间对麸皮酶解制备还原糖的影响
图2 显示,随着时间的延长,酶解糖化率随之发生变化,反应50 h 后,总糖化率达到30.1%,以后随着时间的延长糖化率逐渐下降.因为随着反应时间的延长酶降解副产物的增加抑制了酶的生物活性.对于某一定用量的酶,糖化率与时间呈正相关性,这与酶促反应的动力学方程基本一致.在反应开始的前段时间内,没有反馈抑制作用,反应速率加快;当反应持续进行时,随着糖质量分数的不断增加,反馈抑制增强,正向反应的速率降低[9].
2.1.3 pH 对还原糖得率的影响
溶液pH 对还原糖得率的影响见图3.
图3 表明,试样pH 值对双酶糖化反应有显著的影响,当试样pH 4.5 时,酶解糖化率达到了20.79%,pH 4.5 为该反应体系酶的最适pH.过酸或过碱可以使酶的空间结构破坏,引起酶构象的改变,酶活性丧失.当pH 改变不很剧烈时,酶虽未变性,但活力受到影响.pH 影响了底物的解离状态,或者使底物不能和酶结合,或者结合后不能生成产物;pH 影响酶分子活性部位上有关基团的解离,从而影响与底物的结合或催化,使酶活性降低;也可能影响到中间络合物的解离状态,不利于催化生成产物[10].

图3 pH 对麸皮酶解制备还原糖的效果影响
2.1.4 PBS 用量对还原糖得率的影响
PBS 用量对还原糖得率的影响见图4.
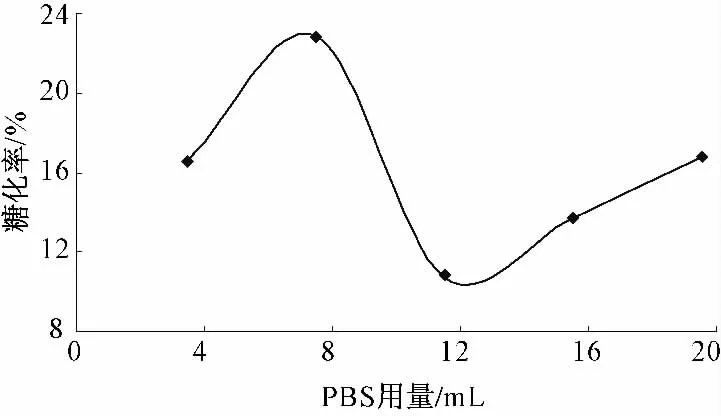
图4 PBS 用量对麸皮酶解制备还原糖的影响
由图4 可以看出,随着PBS 用量的逐渐增大,酶解糖化率随之增大,当PBS 用量达到8 mL 时,此时酶解总糖化率达到22.83%,即8 mL 为该反应体系酶的最适PBS 用量.当PBS 用量继续增大时,酶解糖化率开始下降.随着PBS 量的增大,预处理的糖化液稀释度增大,不利于酶与底物的反应,进而使酶解效率下降.在该反应中加入PBS后,底物浓度和酶浓度被等程度稀释.该过程的变化是由PBS 用量的改变引起的,因此,引起还原糖得率变化的直接原因是PBS.
2.1.5 双酶配比(淀粉酶/纤维素酶)对麸皮酶解制备还原糖效果的影响(图5)
图5 显示,双酶配比对糖化率的影响不是太显著,说明两种酶间相互促进作用不太明显,可结合经济成本进行控制.当双酶配比为3∶1 时,糖化率最低.随着双酶配比的变化,糖化率缓慢升高.当双酶配比为2∶3 时,酶解糖化率最大,达到29.71%.
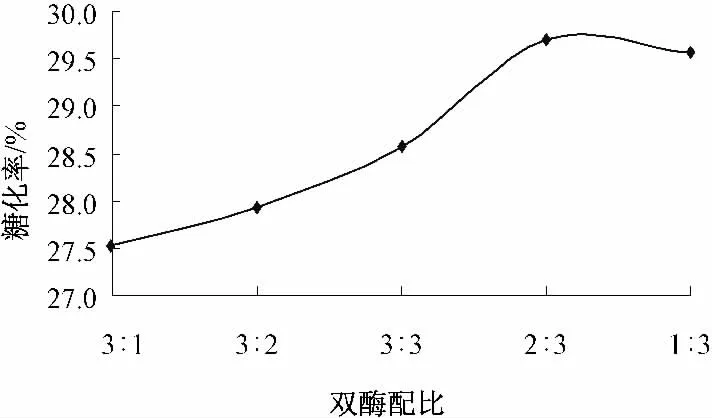
图5 双酶配比对麸皮酶解制备还原糖的影响
2.2 正交试验
在单因素试验及其结果分析的基础上进行正交试验设计,得出麸皮酶解制备还原糖的最佳工艺条件.正交试验安排以及结果与分析见表1 和表2.
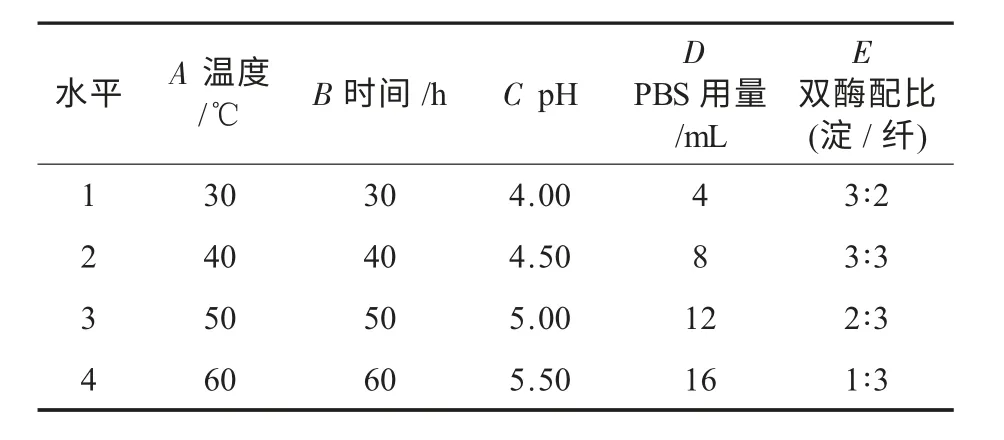
表1 因素与水平

表2 正交试验结果与分析
对正交试验的直观分析显示:16 个工艺组合中A4B2C3D1E4为酶解的优化工艺组合,即当温度60 ℃、时间40 h、pH 5.00、PBS 用量4 mL、双酶配比1∶3 时,还原糖得率为36.72%.
极差分析结果表明:A4B2C2D1E2的条件下,即当温度60 ℃、时间40 h、pH 4.50、PBS 用量4 mL、双酶配比3∶3 时,还原糖的得率为37.23%,高于正交试验的直观分析值.因此,酶解麸皮水解液制备还原糖的最佳工艺条件为A4B2C2D1E2.
3 结论
以面粉加工的剩余物——麸皮为原料,研究了温度、时间、pH 值、PBS 用量和双酶配比等因素对麸皮酶解糖化的影响,通过正交试验对酶解工艺进行了优化.结果显示:温度60 ℃、时间40 h、pH 4.50、PBS 用量4 mL、双酶配比3∶3 为麸皮酶解制备还原糖的最佳工艺条件.以麸皮为原料进行生物乙醇的生产,不失为缓解能源短缺、实现可持续发展的有效途径之一.
[1]陈魏,徐龙君,陈坤.乙醇-磷酸预处理对稻草酶解糖化的影响[J].农业工程学报,2011,27(11):268-272.
[2]宋安东,裴广庆,王风芹,等.中国燃料乙醇生产用原料的多元化探索[J].农业工程学报,2008,24(3):303.
[3]赵永亮,侯启昌,杨霞,等.酶酸结合法降解植物纤维素新工艺[J].中南大学学报:自然科学版,2011(10):2971-2976.
[4]苏小军,熊兴耀,谭兴和,等.燃料乙醇技术研究进展[J].湖南农业大学学报,2007,33(4):480-485.
[5]邵丽,谢文磊.离子液体在纤维素材料及纤维素衍生物生产中的应用[J].河南工业大学学报:自然科学版,2007(6):84-88.
[6]刘俊红,郑学辉,于婷婷,等.纤维素酶和木聚糖酶降解艾蒿纤维素工艺的优化[J].贵州农业科学,2012(5):169-172.
[7]计红果,庞浩,张容丽,等.木质纤维素的预处理及其酶解[J].化学通报,2008(5):329-335.
[8]杨晨阳,冯哲.木质纤维素为原料制备乙醇的工艺[J].黑龙江粮油科技,2011(4):41-45.
[9]王镜岩,朱圣庚,徐长发.生物化学(上册)[M].北京:高等教育出版社,2012:379-380.
[10]Yang B,Wyman C E.Effect of xylan and lignin removal by batch and flow through pretreatment on the enzymatic digestibility of corn stover cellulose[J].Biotechnical Bioenerg,2004,86(1):88-95.
