肿瘤干细胞相关信号转导途径与鳞状细胞癌的研究进展
2014-03-27赵梓纲
夏 珊,赵梓纲,解 方,贺 晶
Makino等最早提出肿瘤干细胞(cancer stem cells,CSCs)的假说,推测肿瘤产生可能是由于CSCs导致[1]。1997年Bonnet等首次实验证实急性髓细胞白血病患者体内含有CSCs。随后各项研究证实了CSCs存在于肿瘤实体中,与干细胞相似,具有以下特性:(1)失控的自我更新能力,CSCs能够无限地分裂产生与自身相同的子细胞,并有自我更新的能力,维持肿瘤细胞的生长;(2)高致瘤性,核型分析或畸胎瘤实验等表明,CSCs的致瘤性高于一般干细胞或其他细胞;(3)多向分化特性,CSCs在特定条件下能够诱导分化成为异质性子代瘤细胞,从而形成新的肿瘤;(4)化疗过程的耐药性,CSCs能够表达ABC家族膜转运蛋白,该蛋白能够将机体代谢产物、药物、毒性物质等排出细胞外,从而致使机体对许多化疗药物产生多重耐药性。肿瘤中CSCs数量很少,比例不足5%,但其对肿瘤的存活、增殖、转移、复发和化疗耐药性有着重要作用,是肿瘤细胞群生命力的支柱[2-3]。近年来,很多对CSCs的研究结果表明,CSCs的相关信号转导途径(如Wnt/β-catenin、JAK-STATs、Hh、PIP3等)对鳞状细胞癌的发生和发展有着重要影响[4-6]。本文主要对影响鳞状细胞癌发生、发展的CSCs内信号转导途径进行阐述,以期为鳞状细胞癌的治疗开辟新的途径。
1 鳞癌干细胞
鳞状细胞癌属于皮肤表皮细胞的一种皮肤肿瘤,临床被称为皮样癌[7]。在皮肤与结膜交界处多发,其中比较常见的有头颈部鳞状细胞癌和食管鳞状细胞癌等。目前临床和研究倾向于认为成体组织干细胞是CSCs的起源细胞,机制可能为:肿瘤细胞是正常细胞至少4~7次突变后累积导致的,一般情况下,正常细胞不会有这么长的寿命,而且不具有累计多次的突变,而干细胞很长的寿命以及累计的突变最终形成CSCs,进而生成肿瘤。肿瘤分化程度可能与肿瘤起源的干细胞的增殖分化阶段也有关。目前研究提示,鳞状细胞癌可能起源于鳞状干细胞增殖分化过程的任何阶段[8]。假如干细胞分化过程早期阶段发生肿瘤,那么便呈现为低分化的特性;若起源于干细胞分化过程后期阶段,则肿瘤呈现为高分化的特性;而良性肿瘤一般起源于干细胞分化链的晚期阶段。干细胞分化成熟过程中的任何一个阶段都可被阻断,最终形成肿瘤分化程度各异性。目前研究者普遍认为,干细胞定居于一个特异性的微环境中,称之为“壁龛(niche)”中。有研究发现,在原发性头颈部鳞状细胞癌中有类似情况的微环境,大多数CSCs在血管周围一定范围内,通过血管内皮细胞能够分泌IL-6等相关因子,激活STAT3、ERK 和Akt等信号通路,使得肿瘤细胞迁移能力增强,同时CSCs受到保护[9]。CSCs进入细胞周期后,可转变为成熟细胞,为维持干细胞池和产生有特定功能的子代细胞起到关键性的作用,而这一过程受到了Wnt,JAK-STATs和hedgehog等信号途径的调控[10]。
2 Wnt信号转导途径
Wnt 蛋白是一种富含半胱氨酸的糖蛋白,其信号转导途径有两种,包括经典途径和非经典途径,经典途径决定细胞命运,非经典途径控制细胞运动及组织极性[11]。当Wnt蛋白与Frizzled(FZD)家族跨膜蛋白受体和低密度脂蛋白受体关联蛋白辅助性受体结合后,可激活Wnt/β-连环蛋白(β-catenin 信号通路),为Wnt经典信号转导途径。当FZD家族受体和ROR2/RYK联合受体结合可以引发相关反应,激活Wnt非经典信号转导途径[12]。Wnt信号通路及其有关的其他通路在胚胎的早期发育、器官形成、组织再生等过程中发挥着重要作用,因此,Wnt 信号通路失调可导致多种恶性肿瘤的发生[13]。正常的成熟细胞β-catenin表达水平低,经典Wnt信号通路处于关闭状态;而CSCs处于活化状态时,β-catenin降解产生障碍,细胞质中游离β-catenin逐渐增多,可与TCF/LEF-1结合进入细胞核,进而激活下游靶基因c-myc、cyclin D1进行转录,从而致使肿瘤的发生和发展[14]。张卫民等[15]利用免疫组织化学方法研究Wnt-1、APC和β-catenin在口腔黏膜鳞状细胞癌中的表达,初步揭示了Wnt信号传导通路组成蛋白Wnt-1、APC和β-catenin在口腔鳞状细胞癌分化和增殖中的作用。结果如表1所示,Wnt-1、APC和β-catenin在高分化鳞状细胞癌细胞膜中呈高表达,而在中、低分化的鳞状细胞癌细胞膜中表达较低,揭示了Wnt信号转导途径对鳞状细胞癌的增殖和分化起着重要作用。
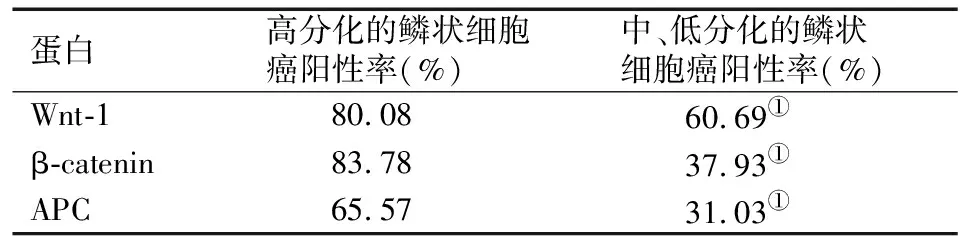
表1 Wnt信号转导组成蛋白与鳞状细胞癌增殖和分化的关系
相关研究证实Wnt信号通路可能与鳞状细胞癌预后及放化疗的敏感程度有密切关系。有研究者通过免疫组织化学检测121例鳞状细胞癌患者标本发现,Axin蛋白表达的量与食管癌浸润深度呈负相关;单因素分析结果表明,食管癌预后相关不良因素与Axin蛋白表达水平降低有关[16]。现阶段研究表明,WISP-1、WIF-1、DKK1等的异常表达可能是根治性术后食管癌患者不良预后指标。研究发现,食管癌细胞株顺铂敏感性与干扰素诱导跨膜蛋白-1(interferon induced transmembrane protein 1,IFITM1)有关,并且LEF-1和β-catenin的异常是导致食管癌细胞放疗无效的重要因素[17]。
3 JAK-STATs信号转导途径
JAK-STATs通路是一条由细胞因子刺激的信号转导通路,在细胞凋亡、增殖和分化过程中起着重要的调节作用,维持人类胚胎干细胞的自我更新[18-19]。最新报道,STATs 蛋白中某些亚型与肿瘤形成、发展高度相关[20]。
激活的STAT1属于STATs 蛋白一类,能够抑制细胞生长,介导细胞凋亡[21]。JAK-STAT1信号转导途径可在分子水平调节细胞的增殖和分化以及凋亡过程,在肿瘤发展过程中具有重要作用。对剔除STAT1基因小鼠的研究表明,细胞能够在IFN-γ诱导下,通过使STAT1磷酸化而凋亡。鳞状细胞癌由于下调了抗原呈递机制,逃避细胞毒性T细胞的捕获,而STAT1信号通路受到IFN-γ激活,从而使肿瘤细胞恢复对CTL的敏感性[22]。
Onishi等[23]应用免疫定位研究发现,JAK、Src信号和EGFR信号在鳞状细胞癌中起着重要作用,其介导新生的上皮钙黏着蛋白,诱导STAT3磷酸化,形成STAT3-Y705,促进上皮细胞的过度增殖和恶性转化。此外,STAT3能激活Bcl-xl、Mcl-1、cyclin D1等抗凋亡基因,进而延长肿瘤细胞的生存周期。Boehm等[24]发现,在头颈部鳞状细胞癌中,Bcl-XL抗凋亡蛋白通过对细胞色素C的释放的影响,进而影响细胞凋亡。
4 Hh信号转导途径
Hh基因编码的一种高度保守的分泌性糖蛋白,具有3种不同亚型,分别编码Shh、Ihh和Dhh蛋白。而跨膜蛋白PTCH1为Hh受体[25]。PTCH1负调控Hh途径,与配体结合可抑制受体活性。Hh缺乏时,PTCH1与SMO结合,抑制SMO活性;存在Hh信号时,Hh与PTCH1结合,SMO释放至胞浆中,作用于转录因子GlI,影响细胞增殖;而HHIP和SUFU复合体为该通路的抑制环节[26]。
研究发现,Hh信号通路中的一些蛋白或下游信号,如BMI1阳性和GlI-1阳性等与鳞状细胞癌患者经新辅助放射化疗后的早期复发及预后不良的相关性显著,其平均DFS和OS等均有显著性差异,提示Hh通路的激活参与恶性肿瘤CRT后的再生和发展[27]。Zhu等[28]分别检测100例新辅助放化疗鳞状细胞癌活检标本的PTCH1和GLI-1,结果发现大部分标本中PTCH1和GLI-1表达量有了很大的升高,二者表达水平与肿瘤大小,局部进展和肿瘤对放化疗反应程度具有显著相关性。单因素分析结果表明,PTCH1和GLI-1高表达与肿瘤局部复发快、DFS和OS差异有很大的关系。
5 其他信号转导途径以及交叉作用
鳞状细胞癌最常见遗传病变机制是EGFR过表达和p53基因突变,Notch信号通路参与上述两者的负调控,且影响Wnt通路,并受到Wnt通路的影响[29]。Isohata等指出,大多数鳞状细胞癌共表达EMT信号和Hh信号基因,首次提出EMT和Hh信号相互交叉的作用。PTK6具有使GSK3和Akt磷酸化程度降低的能力,进而激活β-catenin蛋白。TE-10细胞系和TE-1细胞系体外研究证实,PIP3途径在N-Shh、Gβγ及表皮生长因子的刺激下,能够在Hh信号转导通路中发挥重大作用;MAPK和PIP3协同作用,可使Shh通路促进鳞状癌细胞存活、增殖。He等[30]还发现,Wnt信号通路可被Hh通路经sFRP-1作用而抑制。
【参考文献】
[1] Yu Z,Pestell TG,Lisanti MP,et al.Cancer stem cells[J].The International Journal of Biochemistry & Cell Biology,2012,44(12):2144-2151.
[2] Liu C,Kelnar K,Liu B,et al.The microRNA miR-34a inhibits prostate cancer stem cells and metastasis by directly repressing CD44[J].Nature Medicine,2011,17(2):211-215.
[3] Ito T,Zimdahl B,Reya T.aSIRTing control over cancer stem cells[J].Cancer Cell,2012,21(2):140-142.
[4] Rosner M,Fabian ID.Squamous cell carcinoma[M]//Arun D,Singh MD,Bertil E.Clinical Ophthalmic Oncology.[S.l.]:Springer Berlin Heidelberg,2014:43-51.
[5] Stransky N,Egloff AM,Tward AD,et al.The mutational landscape of head and neck squamous cell carcinoma[J].Science,2011,333(6046):1157-1160.
[6] Clark CA,McEachern MD,Shah SH,et al.Curcumin inhibits carcinogen and nicotine-induced mammalian target of rapamycin pathway activation in head and neck squamous cell carcinoma[J].Cancer Prevention Research,2010,3(12):1586-1595.
[7] Lo WL,Yu CC,Chiou GY,et al.MicroRNA-200c attenuates tumor growth and metastasis of presumptive head and neck squamous cell carcinoma stem cells[J].The Journal of Pathology,2011,223(4):482-495.
[8] Clay MR,Tabor M,Owen JH,et al.Single-marker identification of head and neck squamous cell carcinoma cancer stem cells with aldehyde dehydrogenase[J].Head & Neck,2010,32(9):1195-1201.
[9] Marijuán PC,del Moral R,Navarro J.On eukaryotic intelligence:signaling system's guidance in the evolution of multicellular organization[J].Biosystems,2013,114(1):8-24.
[10] Gorissen M,de Vrieze E,Flik G,et al.STAT genes display diffe-rential evolutionary rates that correlate with their roles in the endocrine and immune system[J].Journal of Endocrinology,2011,209(2):175-184.
[11] Holland JD,Klaus A,Garratt AN,et al.Wnt signaling in stem and cancer stem cells[J].Current Opinion In Cell Biology,2013,25(2):254-264.
[12] Biddle A,Liang X,Gammon L,et al.Cancer stem cells in squamous cell carcinoma switch between two distinct phenotypes that are preferentially migratory or proliferative[J].Cancer Research,2011,71(15):5317-5326.
[13] Takebe N,Harris PJ,Warren RQ,et al.Targeting cancer stem cells by inhibiting Wnt,Notch,and Hedgehog pathways[J].Nature Reviews Clinical Oncology,2011,8(2):97-106.
[14] Wend P,Loddenkemper C,Brinkmann V,et al.Wnt/β-catenin activity is essential to turn the epigenetic state to “ON” in salivary gland stem cells to create cancer stem cells[J].Journal of Stem Cells & Regenerative Medicine,2010,6(2):134.
[15] 张卫民,高岩.Wnt 信号传导通路组成蛋白与口腔鳞状细胞癌的分化和增殖[J].中华口腔医学杂志,2005,40(6):491-494.
[16] 沐雨,李苏宜.肿瘤干细胞相关信号通路与食管鳞癌的研究进展[J].世界华人消化杂志,2013,21(5):373-380.
[17] 荆薇,张晔,刘云鹏,等.ERK 通路对胃癌细胞顺铂敏感性的调节作用[J].世界华人消化杂志,2009,17(28):2931-2935.
[18] Klampfer L.Signal transducers and activators of transcription(STATs):novel targets of chemopreventive and chemotherapeutic drugs[J].Current Cancer Drug Targets,2006,6(2):107-121.
[19] Lo HW,Hsu SC,Ali-Seyed M,et al.Nuclear interaction of EGFR and STAT3 in the activation of the iNOS/NO pathway[J].Cancer Cell,2005,7(6):575-589.
[20] Yao X,Zhu F,Zhao Z,et al.Arctigenin enhances chemosensitivity of cancer cells to cisplatin through inhibition of the STAT3 signaling pathway[J].Journal of Cellular Biochemistry,2011,112(10):2837-2849.
[21] Demyanets S,Kaun C,Rychli K,et al.Oncostatin M-enhanced vascular endothelial growth factor expression in human vascular smooth muscle cells involves PI3K-,p38 MAPK-,Erk1/2-and STAT1/STAT3-dependent pathways and is attenuated by interferon-γ[J].Basic Research In Cardiology,2011,106(2):217-231.
[22] Leibowitz MS,Andrade Filho PA,Ferrone S,et al.Deficiency of activated STAT1 in head and neck cancer cells mediates TAP1-dependent escape from cytotoxic T lymphocytes[J].Cancer Immunology Immunotherapy,2011,60(4):525-535.
[23] Onishi A,Chen Q,Humtsoe JO,et al.STAT3 signaling is induced by intercellular adhesion in squamous cell carcinoma cells[J].Experimental Cell Research,2008,314(2):377-386.
[24] Boehm AL,Sen M,Seethala R,et al.Combined targeting of epidermal growth factor receptor,signal transducer and activator of transcription-3,and Bcl-XL enhances antitumor effects in squamous cell carcinoma of the head and neck[J].Molecular Pharmacology,2008,73(6):1632-1642.
[25] Chiou SH,Yu CC,Huang CY,et al.Positive correlations of Oct-4 and Nanog in oral cancer stem-like cells and high-grade oral squamous cell carcinoma[J].Clinical Cancer Research,2008,14(13):4085-4095.
[26] Chen YC,Chen YW,Hsu HS,et al.Aldehyde dehydrogenase 1 is a putative marker for cancer stem cells in head and neck squamous cancer[J].Biochemical And biophysical Research Communications,2009,385(3):307-313.
[27] 朱振龙,杨艳红,张钰,等.食管鳞状细胞癌中 PINCH 蛋白的表达及意义[J].肿瘤防治研究,2006,33(8):555-557.
[28] Zhu W,You Z,Li T,et al.Correlation of hedgehog signal activation with chemoradiotherapy sensitivity and survival in esophageal squamous cell carcinomas[J].Japanese Journal of Clinical Oncology,2011,41(3):386-393.
[29] 马沛卿,薛丽燕,谢永强,等.早幼粒细胞白血病蛋白在食管鳞状细胞癌及癌前病变中的表达与临床意义[J].国际肿瘤学杂志,2011,38(6):471-475.
[30] He J,Sheng T,Stelter AA,et al.Suppressing Wnt signaling by the hedgehog pathway through sFRP-1[J].Journal of Biological Chemistry,2006,281(47):35598-35602.
