固相萃取-液相色谱-串联质谱法测定水中5种雌激素
2014-03-27王明泉孙韶华贾瑞宝
葛 璇,刘 莉,王明泉,孙韶华,贾瑞宝
山东省城市供排水水质监测中心,山东 济南 250021
近几十年来,激素类药物在人类日常生活中被大量使用,不同种类的雌激素被排放到水环境中。雌激素在极低的浓度下就具有很强的内分泌干扰作用,如20世纪30年代报道的雌激素效应,20世纪80年代在英国的沙布塔河,5%的雄性鲤鱼发生雌雄同体的现象,20世纪90年代在佛罗里达洲和五大湖,发现了爬行类和鱼类动物的雌性化、生殖器怪异的鳄鱼等动物繁殖力异常的现象等[1],这些现象都与水环境中存在雌激素类物质密切相关。而且,雌激素对人类健康危害显著,长期摄入雌激素残留的食品会出现性早熟、性异常、癌症等, 并增加某些疾病的发病危险,其潜在的危害是扰乱激素平衡,导致女童性早熟,男性女性化,诱发女性乳腺癌、卵巢癌等疾病[2-5]。因此,根据农业部2002年4月193号文《食品动物禁用的兽药及其他化合物清单》的规定,部分雌激素药物在中国已禁止生产和使用。目前,中国给水处理仍以常规处理工艺为主,对雌激素活性内分泌干扰物的去除能力有限,而中国现行的《生活饮用水卫生标准》(GB 5749—2006)中也缺少对此类物质的检测方法和限值要求。因此,开展水中雌激素类物质的检测方法研究,对开展中国城市水环境中雌激素污染现状、转化规律及消除控制技术研究具有重要意义。
国内外常见的雌激素检测方法有化学检测方法和生物检测方法。化学检测法包括气相色谱法[6-8]、液相色谱法[9]、气相色谱-质谱法[10]、液相色谱-质谱法[11-13],生物检测法有荧光素酶法、ELISA检测法、生物传感器检测法等。目前,牛奶、鸡肝制品中雌激素的研究已有报道[14-16],但对水中多种雌激素同时测定的方法报道较少。相比其他检测方法而言,液相色谱-串联质谱能有效消除基质干扰,降低检出限。因此,选用固相萃取-液相色谱-串联质谱联用法,开发建立了17β-雌二醇、雌三醇、雌酮、17α-炔雌醇、己烯雌酚等5种雌激素的高通量检测方法。该方法灵敏度高,准确度和精密度好,可为水中雌激素类污染物的检测提供方法参考依据。
1 实验部分
1.1 仪器与试剂
液相色谱-三重四极杆质谱分析仪(1200/6410型,美国);全自动固相萃取仪(AT280型,美国);氮吹仪(DC12H型,美国);液相色谱柱(zorbax SB-C18型,美国); OASIS HLB固相萃取柱(200 mg,6 mL);C18固相萃取柱(500 mg,6 mL);活性炭固相萃取柱(500 mg,6 mL,美国);SAX固相萃取柱(500 mg,6 mL,美国)。
甲醇、乙腈、乙酸乙酯、二氯甲烷均为农残级;Millipore超纯水;冰乙酸为国产优级纯。
1.2 实验方法
1.2.1 样品前处理
采用HLB固相萃取柱,依次用6 mL的甲醇、纯水活化后取1 L水样,加入乙酸调节水样pH为3后上样,上样速度为10 mL/min,用10 mL纯水淋洗,用8 mL甲醇洗脱,洗脱液用氮气缓慢吹干后用乙腈-水(体积比为3∶2)定容至1 mL。
1.2.2 标准溶液的配制
用乙腈-水(体积比为3∶2)配制17β-雌二醇、雌三醇、17α-炔雌醇的浓度分别为5、10、20、40、50、60、80 μg/L,己烯雌酚和雌酮的浓度分别为0.5、1、2、4、5、6、8 μg/L的标准溶液。
1.2.3 液相色谱条件
色谱柱为zorbax SB-C18柱,柱温为40 ℃;流动相为乙腈和水,流速为0.2 mL/min; 进样量为20 μL;采用梯度洗脱,梯度洗脱程序见表1。
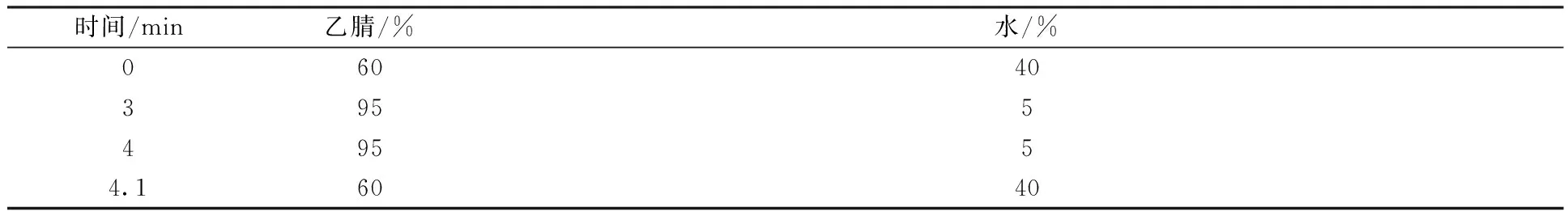
表1 液相色谱梯度条件
电喷雾离子源,负离子模式(ESI-);离子源温度为350 ℃;多反应监测(MRM)模式下采集数据,具体参数见表2。

表2 5种雌激素MRM参数
2 结果与分析
2.1 固相萃取条件的优化
以5种雌激素回收率的高低作为最优化固相萃取条件的选择依据,分别研究了固相萃取中萃取柱、上样速度、样品pH、洗脱溶剂及洗脱溶剂体积5个实验条件参数。取1 L水样,加入乙酸调节pH为3左右,分别加入40 μL 5种雌激素的混合标准溶液,使水中17β-雌二醇、雌三醇、17α-炔雌醇的浓度均为40 μg/L,己烯雌酚和雌酮浓度均为4 μg/L。设定不同的固相萃取条件进行萃取。
2.1.1 固相萃取柱优选
分别选择HLB固相萃取小柱、C18柱、活性炭柱、SAX柱,按照“1.2.1节”中的实验步骤进行前处理,经测定后所得结果见图1。
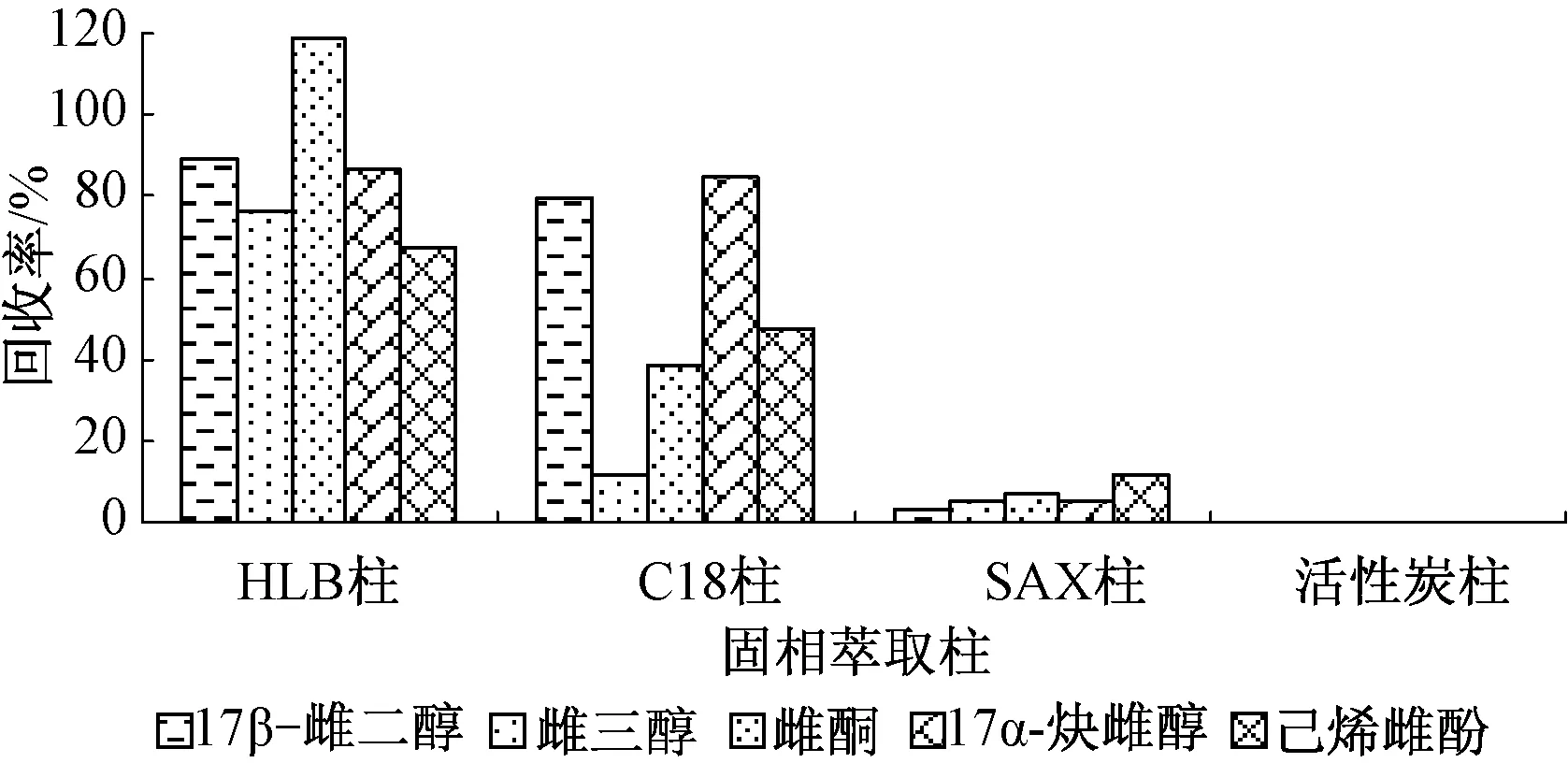
图1 不同固相萃取柱萃取5种雌激素的回收率
由图1看出,用HLB柱进行固相萃取时得到5种雌激素的回收率最高,因此确定选择HLB固相萃取柱。
2.1.2 pH影响
用乙酸分别调节5个平行水样pH为7、5、3、2、1,按照“1.2.1节”中的实验步骤进行前处理,经测定后所得结果见图2。 由图2看出,5种雌激素的回收率随着pH的降低而升高,当pH为3时达到最大值,之后随着pH的降低而下降,因此选择待测样品pH为3。
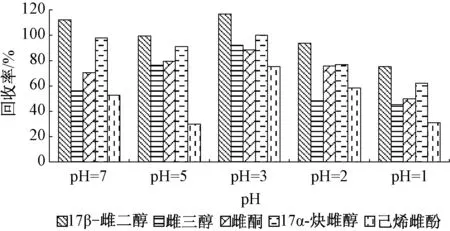
图2 不同pH时萃取5种雌激素的回收率
2.1.3 洗脱剂优选
分别选择甲醇、乙酸乙酯、乙腈、二氯甲烷、正己烷作为固相萃取的洗脱试剂,按照“1.2.1节”中的实验步骤进行前处理,经测定后所得结果见图3。由图3看出,极性最强的甲醇萃取5种雌激素的回收率最高,非极性的正己烷萃取5种雌激素的回收率为零。因此,选择甲醇作为最佳洗脱试剂。
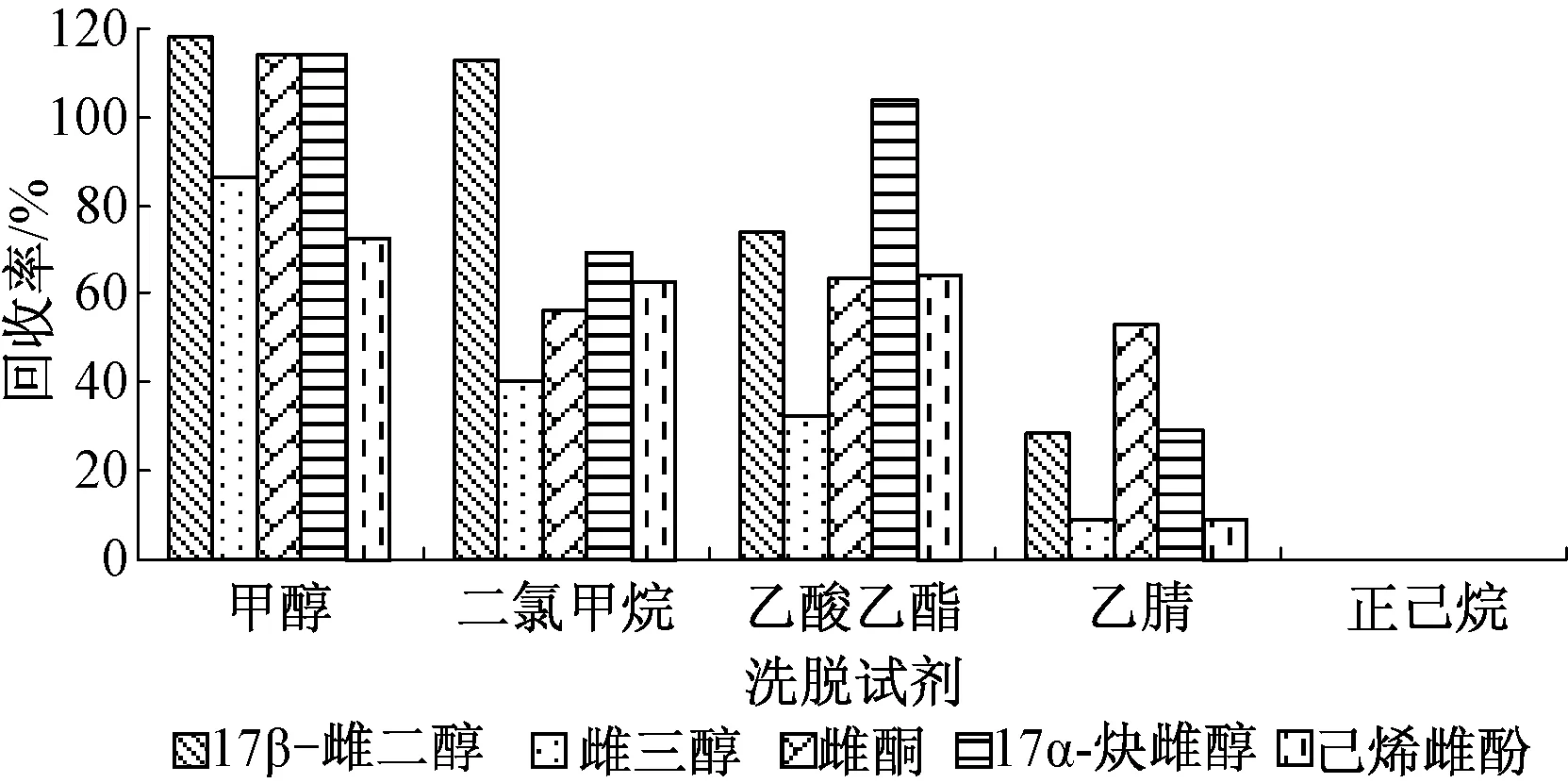
图3 不同洗脱试剂萃取5种雌激素的回收率
2.1.4 洗脱体积优化
分别选择2、4、6、8、10 mL甲醇对固相萃取柱进行洗脱,按照“1.2.1节”中的实验步骤进行前处理,经测定后所得结果见图4。由图4看出,5种雌激素的回收率随着洗脱体积的增加而升高,到8 mL时达到最大值,之后不再随洗脱体积的增加而升高,因此确定优化洗脱体积为8 mL。
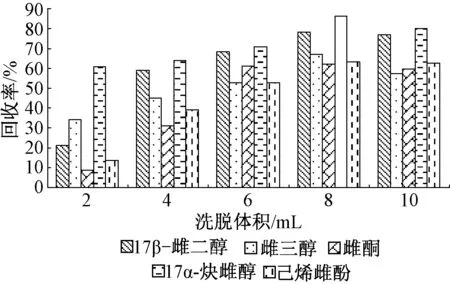
图4 不同洗脱体积时5种雌激素的回收率
2.1.5 上样速度
图5为上样流速分别为5、10 mL/min时的测定结果。由图5可以看出,2种流速所得5种雌激素的回收率相差不大,说明上样速度在5~10 mL/min内时对回收率的影响很小,因此选择10 mL/min作为上样速度。
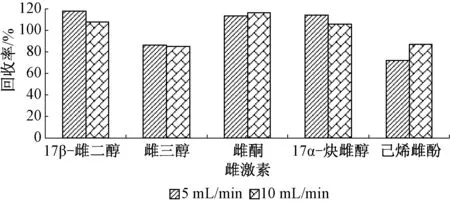
图5 不同上样速度时5种雌激素的回收率
综上,5种雌激素最佳固相萃取条件为水样pH为3,HLB固相萃取柱,上样速度为10 mL/min,洗脱试剂为甲醇,洗脱体积为8 mL。此时5种雌激素可获得满意的回收率。
2.2 方法的评价
2.2.1 线性方程和测定下限
5种雌激素的线性方程、相关系数及测定下限见表3。

表3 5种雌激素的线性方程、相关系数和测定下限
2.2.2 实际样品分析及回收率和精密度
配制17β-雌二醇、雌三醇、17α-炔雌醇浓度为4×10-2μg/L,雌酮、己烯雌酚浓度为4×10-3μg/L的纯水加标平行样6份,对地表水和自来水进行上述浓度的5种雌激素加标,前处理后测定。采用该方法对2012年9月—2013年9月济南市鹊山水库,玉清水库,卧虎山水库,锦绣川水库和玉清水厂、鹊华水厂(2个引黄水厂)的出厂水及济南光大水务污水处理一厂、二厂、三厂、四厂出厂水进行检测(表4、表5)。由表4、表5可见,4个水库水、2个水厂的出厂水和4个污水处理厂出厂水中均未检出5种雌激素,说明在该地区此类雌激素污染水平较低。

表4 5种雌激素的加标回收率及相对标准偏差 %
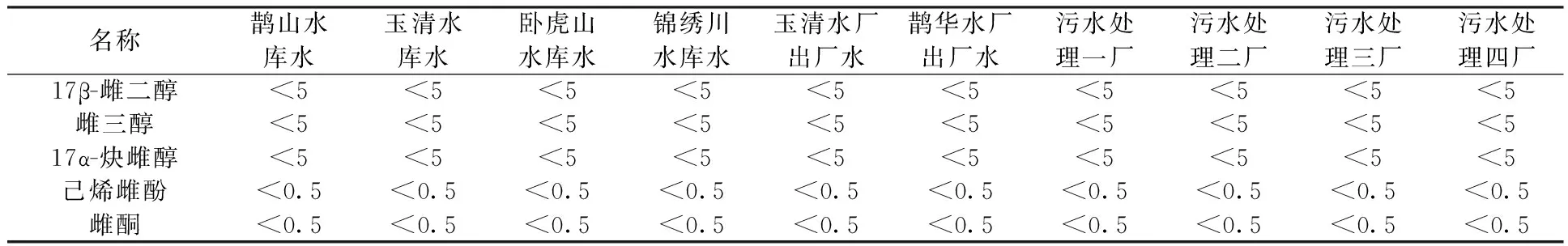
表5 实际水样中5种雌激素的测定浓度 μg/L
3 结论
建立了液相色谱-串联质谱法测定地表水、饮用水和污水处理厂出厂水中17β-雌二醇、雌三醇、雌酮、17α-炔雌醇、己烯雌酚等的高通量检测方法:样品经甲醇作萃取剂过OASIS HLB固相萃取柱富集,氮吹后用1 mL乙腈-水(体积比为3∶2)溶解,后用液相色谱-串联质谱在MRM模式下进行定性及定量分析。5种雌激素纯水加标回收率为63.6%~120.2%,地表水加标回收率为59.8%~91.5%,自来水加标回收率为55.3%~92.1%,精密度分别为3.7%~10.7%,线性方程的相关系数为0.995~0.998。17β-雌二醇、雌三醇、17α-炔雌醇的检出限均为5 μg/L,雌酮、己烯雌酚的检出限均为0.5 μg/L。采用该方法对济南市4个水库水和2个水厂的出厂水及4个污水处理厂出厂水进行检测,均未检出5种雌激素。
[1] Theo C, Dianne D, John Peterson M.Our Stolen Future[M]. New York: The Spieler Agency, 1995:215-220.
[2] Holzman D. Elusive estrogens may hold key to some cancer risk [J].Natl Cancer Inst,1995,87:1 207.
[3] Gail M H, Fears T R, Hoover R N, et al.Reproducibility studies and interlaboratory concordance for assays of serum hormone levels: estrone, estradiol, estrone sulfate, and progesterone [J].Cancer Epidemical Biomarkers Prev,1996,5:835-844.
[4] 徐两蒲, 刘晖, 王子敬. 性早熟女童性激素水平测定分析[J].福建医药杂志,2006,28(4):66-67.
[5] Carlson E, Givercmen A, Keiding N, et al. Evidence for decreasing qualities of semen during past 50 years[J].Br Med J,1992,305:609-613.
[6] 戴国斌, 杨琛, 党志. 池塘底泥中合成激素的气相色谱-质谱测定[J].分析测试学报,2008,27(1): 63-65.
[7] Ternes T A, Andersen H, G Ilberg D, et al. Determination of estrogens in sludge and sediments by liquid ex traction and GC/MS /MS[J].Ana Chem,2002,74(14):3 498-3 504.
[8] 胡伟, 黄荣斌, 陈小君, 等. 用气相色谱考察雌二醇的衍生化方法[J]. 分析测试技术与仪器, 2001,7(1):41-44.
[9] 林春晓, 王起恩, 刘开钳, 等. 食品中五种性激素的高效液相色谱测定法[J]. 中华预防医学杂志, 2003,37(4):275-277.
[10] Helaleh M I H, Takabayash I Y, Fujii S, et al. Gas chromatographic- mass spectrometric method for separation and detection o f endocrine disruptors from environmental w ate r samples[J]. Anal Chim Acta, 2001,428(2):227-234.
[11] Zhang Hongwei,Henion J. Quantitative and qualitative determination of estrogen sulfa tes in hum an urine by liquid chromatog raphy/tandem mass spectrometry using 96-well techno logy[J].Anal Chem,1999,71(18):3 955-3 964.
[12] 应永飞, 朱聪英, 陈慧华, 等. 动物尿液中15种甾类同化激素的液相色谱-串联质谱同时测定[J]. 分析测试学报,2008,27(12):1 308-1 312.
[13] 陈彤,云霞,那广水,等.高效液相色谱-串联质谱法测定海水中雌酮、雌二醇、雌三醇[J].分析试验室,2009,28(11):41-44.
[14] 刘宏程,邹艳红,黎其万,等.高效液相色谱分离牛奶中己烯雌酚、己烷雌酚和双烯雌酚[J].分析化学,2008,36(2):245-248.
[15] 吴银良,刘素英,单吉浩,等.气相色谱-质谱法分析鸡肝中己烯雌酚残留量[J].中国兽药杂志,2005,39(11):8-10.
[16] 林奕芝,司徒潮满,刘奋,等.GC-MS法测定肉中雌激素残留量方法的研究[J].中国卫生检验杂志,2007,17(7):1 165-1 167.
