曲格列酮抑制宫颈癌SiHa细胞增殖中的作用
2014-03-26
宫颈癌发病率居妇科恶性肿瘤之首,中晚期患者死亡率较高[1],寻找高效低毒的药物具有重要的临床意义。研究证实,多种人类肿瘤包括宫颈癌均高表达过氧化物酶体增殖物活化受体γ(peroxisome proliferators-activated receptor γ, PPARγ)[2]。PPAR激动剂噻唑烷二酮类化合物曲格列酮(Troglitazone, TGZ)除用于治疗糖尿病外,还具有潜在的抗肿瘤作用,且其不良反应相对较小[3]。p27是一种广谱细胞周期蛋白激酶CDK的抑制剂,其表达异常导致多种肿瘤的异常增殖[4]。p27基因很少发生突变,其表达调控主要发生在蛋白降解水平,S期激酶相关蛋白2(skp2)可通过促进对蛋白的泛素化降解,从而在多种肿瘤增殖中发挥重要的作用[5]。研究表明在多种肿瘤中,skp2表达的异常增高与肿瘤恶性程度及预后有关。在肝细胞癌等肿瘤中发现[6],曲格列酮可通过调控p27表达,抑制肿瘤细胞的增殖和细胞周期进程。
本研究以宫颈癌SiHa细胞株为研究对象,观察曲格列酮对体外培养的宫颈癌SiHa细胞生物学行为的影响,并对其分子机制进行初步探讨,观察skp2、p27在曲格列酮抗宫颈癌细胞增殖过程中的作用。
1 材料和方法
1.1 材料 曲格列酮终浓度溶于二甲亚砜(DMSO),-20 ℃保存。Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司生产),四甲基偶氮唑蓝(MTT)液(BIOSHARP公司),pcDNA3.1-Myc 载体质粒、pcDNA3.1-Myc-skp2表达质粒由南京凯基生物科技发展有限公司合成,p21、p27、cyclinE1及skp2蛋白抗体购自santa cruz公司。倒置显微镜(Olympus公司,日本),SW-CJ-1FD型超净工作台(苏州净化),酶标仪(BIO-RAD公司),流式细胞仪(FACS Calibur Becton-Dickinson)。
1.2 细胞培养及分组 宫颈癌SiHa细胞株(由南京医科大学药理研究室惠赠)置于含10%胎牛血清高糖型DMEM培养基(含10 U/L青霉素和100 mg链霉素,Hyclone公司)中,于37 ℃,5% CO2饱和湿度培养箱中培养,2~3 d换液1次。细胞分为空白对照组、曲格列酮药物实验组(100、200、400 μg/ml)。
1.3 细胞增殖检测 细胞接种于96孔细胞培养板(5×103个细胞/孔),检测24、48、72 h时细胞增殖情况。每孔加入MTT(5 mg/ml),培养4 h后各孔加入DMSO孵育30 min,微量振荡器振荡10 min使结晶物充分溶解,酶标仪在490 nm波长下检测每孔的吸光度(OD)值,设3个复孔,细胞生长抑制率(%)=(阴性组OD值-实验组OD值)/阴性组OD值×100%。
1.4 细胞周期测定 SiHa细胞(2×105个/ml)接种于6 cm培养皿培养12 h,换DMEM 培养液(0.5% FBS)培养24 h以周期同步化。曲格列酮(400 mg/ml)作用24、48、72 h后,收集细胞制备单细胞悬液,70% 冷乙醇固定,4 ℃过夜,PBS洗去固定液,加 RNaseA 20 μl、37 ℃ 孵育30 min,加碘化丙啶(propidium iodide,PI)染液冰浴30 min,300目筛网过滤后调整细胞密度为1×105/ml,上流式细胞仪检测。
1.5 细胞凋亡率检测 采用Annexin V-FITC染色法检测细胞凋亡,细胞接种于24孔细胞培养板(1×105个细胞/孔),分别检测24、48、72 h时细胞凋亡率。0.25%胰酶(不含EDTA)消化收集细胞,PBS洗涤2次后离心(2000 r/min,5 min),收集并悬浮细胞至流式管,加入5 μl Annexin V-FITC混匀,再加入PI 5 μl混匀;室温、避光反应15 min,流式细胞仪检测(Ex=488 nm;Em=530 nm)。
1.6 质粒转染 按Lipofectamin2000说明书进行,细胞接种于24孔板,贴壁后继续培养至50%~80%密度时进行转染实验;质粒DNA、脂质体分别加入无血清培养基中,再将两者混匀室温孵育30 min,加入培养皿各孔细胞中,转染后24 h更换完全培养基继续培养。
1.7 Western blot检测p21、skp2、p27蛋白的表达 细胞弃培养液,预冷PBS洗3次,RIPA裂解液裂解细胞,提取细胞内蛋白,BCA法进行蛋白质定量,用8%SDS-PAGE凝胶进行电泳分离,转PVDF膜。封闭液室温封闭1 h,按适当比例加入一抗,4 ℃孵育过夜,TBST 洗3次,按1∶3000的稀释倍数加入辣根酶标记的二抗,室温孵育1 h,TBST 洗3次,用ECL显色并曝光于X胶片,Image J软件的图像分析仪分析。
2 结果
2.1 曲格列酮对SiHa细胞增殖的影响
2.1.1 曲格列酮抑制宫颈癌SiHa细胞增殖:与对照组相比,SiHa细胞加入曲格列酮24 h后,药物组可见细胞增殖受到抑制,其中200 μg/ml和400 μg/ml组的生长抑制作用明显增强(P<0.05);药物作用48、72 h时,曲格列酮各组均可见到细胞抑制率明显增加(P<0.05),提示曲格列酮抑制SiHa细胞增殖,随着药物浓度及作用时间的增加,其生长抑制作用明显增强,呈时间和浓度依赖性。见图1。
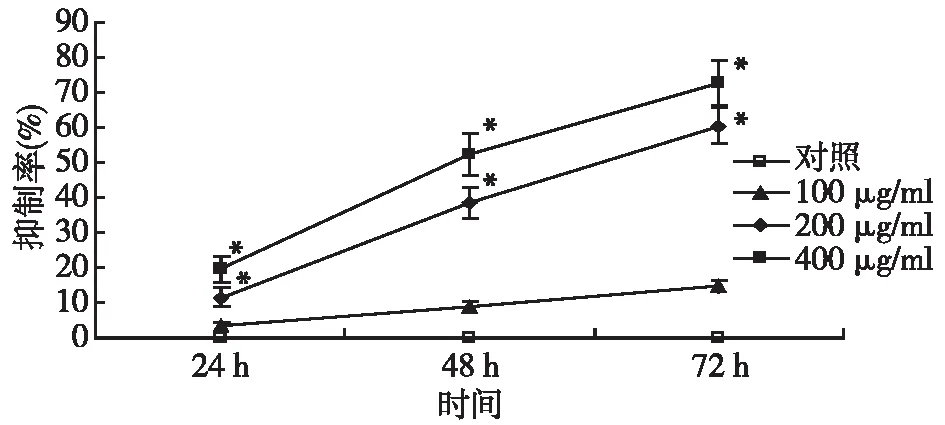
注:与对照组比较,*P<0.05图1 不同浓度曲格列酮药物对宫颈癌SiHa细胞增殖抑制作用
2.1.2 流式细胞术分析曲格列酮对宫颈癌SiHa细胞周期的影响:曲格列酮(400 mg/ml)作用于宫颈癌SiHa细胞0、24、48、72 h时,处于G0/G1期的检测细胞数分别为48.58%、52.96 %、54.83%、69.02%,而G2期和S期的细胞数目则相应减少。见图2。
2.2 曲格列酮对SiHa细胞凋亡的影响 曲格列酮(0、100、200、400 μg/ml)作用于宫颈癌SiHa细胞后,流式细胞仪检测显示24 h总凋亡率分别为2.7%、3.8%、3.7%、6.7%,48 h后凋亡率为3.0%、5.7%、4.3%、5.5%,72 h后凋亡率为4.4%、5.9%、6.1%、7.0%,各时间点及剂量点之间比较,未见显著差异(P>0.05)。

图2 曲格列酮对人宫颈癌SiHa细胞周期的影响
2.3 曲格列酮抑制SiHa细胞增殖的机制研究
2.3.1 曲格列酮对p21、p27表达的影响:PPARγ及其配体可通过细胞周期依赖性激酶抑制素(CKI)抑制细胞增殖。因而,本研究对400 mg/ml浓度曲格列酮作用于SiHa细胞0、24、48、72 h后p21、p27的表达水平进行检测,结果发现,p21在SiHa细胞中表达较弱,并且随作用时间延长,其表达呈现微弱增强;而400 mg/ml浓度曲格列酮作用24 h后p27蛋白表达即出现显著增高,随时间延长表达水平逐渐增高。曲格列酮对p27、skp2蛋白表达的影响:前面实验检测曲格列酮作用于SiHa细胞后,p27表达显著增高,skp2参与p27蛋白表达调控,因而,进一步检测 p27、skp2在曲格列酮(400 mg/ml)作用后的表达变化,结果发现浓度为400 mg/ml曲格列酮作用于SiHa细胞0、24、48、72 h后,p27与skp2的表达呈现明显相反趋势。见图3。

图3 曲格列酮对p21、p27、skp2蛋白表达的影响(GAPDH为内参)
2.3.2 skp2过表达对曲格列酮提高p27表达水平及抑制细胞周期进程的影响:由于曲格列酮作用于SiHa细胞后p27、skp2表达呈明显相反趋势,为了验证p27、skp2蛋白在曲格列酮调节细胞周期中的作用,构建pcDNA3.1、pcDNA3.1-skp2表达质粒并转染SiHa细胞。skp2表达质粒转染后,p27明显下调。曲格列酮(400 mg/ml)作用于转染pcDNA3.1细胞后,p27表达水平随时间延长逐渐升高,skp2表达呈相反趋势;而作用于转染pcDNA3.1-skp2表达质粒的细胞后,前面p27蛋白表达上调现象消失。见图4,5。

图4 skp2表达质粒转染SiHa细胞后p27、skp2表达(GAPDH为内参)

注:图A为pcDNA3.1-Myc空质粒转染;图B为pcDNA3.1-skp2表达质粒图5 pcDNA3.1-Myc空质粒转染及pcDNA3.1-skp2表达质粒(GAPDH为内参)
为进一步验证曲格列酮对转染skp2细胞周期的影响,流式细胞仪实验结果显示,曲格列酮(400 mg/ml)作用于skp2表达质粒转染后的SiHa细胞0、24、48 h后,G1/S期比例为49.4%,52.15%和52.96%,细胞周期的抑制作用明显减弱。
3 讨论
PPAR是一类由配体激活的核转录因子亚型,属于Ⅱ型核受体超家族,其生物学功能复杂,参与调节脂类、糖代谢、炎症反应、肿瘤细胞分化及凋亡等过程,其中PPARγ及其激动剂目前研究最为广泛。噻唑烷二酮类化合物曲格列酮,是一种人工合成的PPARγ激动剂,最初作为胰岛素增敏剂用于糖尿病研究,后来发现其不仅可以调节糖脂代谢作用,还具有抗动脉粥样硬化、抑制炎症反应、抑制血糖效应等生物学活性[7-8]。近年来研究证明,PPARγ 激动剂对多种肿瘤细胞具有诱导抑制分化及抗肿瘤作用[9]。
3.1 曲格列酮抑制宫颈癌细胞生长增殖 本研究显示,曲格列酮对宫颈癌细胞生长具有明显抑制作用,且呈时间和剂量依赖性。在胃癌的研究中[10],曲格列酮均显示了良好的抗肿瘤增殖作用,与本研究结果一致。恶性肿瘤生物学行为包括失控性增殖生长及远处转移,无限增殖能力与细胞周期失调及抗凋亡有关。我们用不同浓度曲格列酮作用于宫颈癌细胞,细胞未见明显核皱缩、边聚的细胞凋亡形态特征。我们对细胞周期进行检测,结果发现:400 mg/L曲格列酮作用后,宫颈癌细胞G0/G1期细胞比例显著增高,S期及G2期比例明显下降, 并呈现明显的时间依赖性,提示曲格列酮作用后,细胞可能发生G1/S期阻滞进而抑制细胞增殖。
3.2 曲格列酮通过调节细胞周期而非凋亡途径抗宫颈癌增殖的机制 本研究首次发现,曲格列酮通过调节细胞周期而非凋亡途径对宫颈癌SiHa肿瘤细胞具有抗增殖作用。与本研究结果不同,近期Chen等[11]在宫颈癌Hela细胞的研究显示,曲格列酮的抗肿瘤效应与凋亡途径有关,并与p53泛素化密切相关,TGZ-PPAR-γ-p53信号通路在TGZ促调亡中发挥了关键性作用。由于不同宫颈癌细胞系之间存在组织病理学、基因表达的差异,Hela细胞为p53基因突变型,而SiHa细胞为p53基因野生型,p53基因在细胞周期调节及凋亡过程中均发挥重要作用,其基因型差异会造成生物学行为不同,未来可扩大研究以进一步明确或发现与之相关的基因表达变化及信号通路。总之,研究提示曲格列酮在不同肿瘤细胞中具有抗肿瘤增殖作用,其作用途径可能存在差异。
既往研究表明人宫颈癌组织存在p27表达下调现象,并与宫颈癌的预后呈明显相关性,而p27作为细胞周期重要抑制素,其主要在G1/S转换期发挥作用,因此,我们用不同浓度曲格列酮作用于宫颈癌细胞,并检测p27蛋白的表达。结果显示曲格列酮显著提高细胞p27的表达水平,并呈明显的剂量依赖性。由于在肿瘤细胞中,p27 mRNA水平相对恒定,p27蛋白水平调节主要发生在蛋白质降解水平[12]。p27蛋白活性及降解与该蛋白的磷酸化、泛素化降解有关。skp2是p27泛素化降解的重要因素,在多种肿瘤中,存在skp2表达上调,从而下调p27水平实现细胞的增殖[13]。因此,我们又进一步检测了skp2、p27表达相关性,结果显示曲格列酮作用于细胞后skp2、p27水平呈现相反趋势,曲格列酮显著提高细胞p27表达水平,提示曲格列酮可能通过skp2调节 p27的表达。宫颈癌SiHa细胞分别转染空质粒和skp2表达质粒后, Western blot检测发现,skp2过表达后,曲格列酮提高细胞p27蛋白表达作用被明显抵消,提示曲格列酮可能主要通过抑制skp2表达从而提高p27的表达水平。进一步研究发现,skp2过表达后,曲格列酮对细胞周期进程抑制作用消失。以上研究说明,曲格列酮可能是通过下调skp2,进而上调G1/S期重要的细胞周期素p27的表达,产生对SiHa细胞的G1/S周期的阻滞作用。
本研究结果发现,曲格列酮体外具有明显抑制宫颈癌SiHa细胞增殖作用,其机制可能通过抑制skp2表达,从而提高细胞p27蛋白水平实现。
[参考文献]
[1] Serkies K,Jassem J.Chemotherapy in the primary treatment of cervical carcinoma[J]. Crit Rev Oncol Hematol,2005,54(3):197-208.
[2] An Z,Muthusami S,Yu JR,et al.T0070907, a PPAR γ Inhibitor Induced G2/M Arrest Enhances the Effect of Radiation in Human Cervical Cancer Cells Through Mitotic Catastrophe[J].Reprod Sci,2014,21(11):1352-1361.
[3] Mahmoud MF,El Shazly SM.Pioglitazone protects against cisplatin induced nephrotoxicity in rats and potentiates its anticancer activity against human renal adenocarcinoma cell lines[J].Food Chem Toxicol,2013,51:114-122.
[4] Fero ML,Randel E,Gurley KE,et al.The murine gene p27Kip1 is haplo-insufficient for tumour suppression[J].Nature,1998,396(6707):177-180.
[5] Wang Z,Gao D,Fukushima H,et al.Skp2: a novel potential therapeutic target for prostate cancer[J].Biochim Biophys Acta,2012,1825(1):11-17.
[6] Motomura W,Takahashi N,Nagamine M,et al.Growth arrest by troglitazone is mediated by p27Kip1 accumulation, which results from dual inhibition of proteasome activity and Skp2 expression in human hepatocellular carcinoma cells[J].Int J Cancer,2004,108(1):41-46.
[7] 刘小北,王扬天,褚晓源.糖尿病与恶性肿瘤[J].实用老年医学,2013,27(6):453-458.
[8] Martin H.Role of PPAR-gamma in inflammation. Prospects for therapeutic intervention by food components[J].Mutat Res,2010,690(1/2):57-63.
[9] Kotta-Loizou I,Giaginis C,Theocharis S.The role of peroxisome proliferator-activated receptor-γ in breast cancer[J].Anticancer Agents Med Chem,2012,12(9):1025-1044.
[10] Wang C,Wang J,Bai P.Troglitazone induces apoptosis in gastric cancer cells through the NAG-1 pathway[J].Mol Med Rep,2011,4(1):93-97.
[11] Chen HM,Zhang DG,Wu JX,et al.Ubiquitination of p53 is involved in troglitazone induced apoptosis in cervical cancer cells[J].Asian Pac J Cancer Prev,2014,15(5):2313-2318.
[12] Bloom J,Pagano M.Deregulated degradation of the cdk inhibitor p27 and malignant transformation[J].Semin Cancer Biol,2003,13(1):41-47.
[13] Hershko DD.Oncogenic properties and prognostic implications of the ubiquitin ligase Skp2 in cancer[J].Can-cer,2008,112(7):1415-1424.
