Fenton助UV/TiO2光催化降解TCAA的研究
2014-03-26赵宝秀
王 芬,赵宝秀,李 想,杨 龙
(青岛理工大学 环境与市政工程学院, 山东 青岛 266033)
沸点高、不可吹脱、致癌风险大的卤代乙酸(HAAs)近二十年来引起了国内外科研人员的广泛关注[1].HAAs的致癌风险占氯化消毒副产物的91.9 %以上,而三氯甲烷(THMs)致癌风险仅占8.1 %以下[2-3].目前我国HAAs主要以氯乙酸为主,而二氯乙酸(DCAA)和三氯乙酸(TCAA)作为饮用水中氯乙酸的主要存在形式,其致癌风险分别是三氯甲烷(THMs)的50倍和100倍[4].杨媛等已研究了DCAA、TCAA对DNA的损伤效应,结果证实了DCAA和TCAA可造成哺乳动物细胞DNA链断裂损伤[5-6].另外,这些消毒副产物还会引起动物肝中毒、神经中毒、代谢紊乱等危害[7].由于现有的污水处理技术只是将水体中的有机物进行转移或者浓缩,无法达到无害、高效降解的效果,因此寻求和研究绿色、安全、高效去除引用水中TCAA、DCAA的水处理技术已成为当前国内环境工作的研究热点之一[8].TiO2光催化技术因其操作简便、氧化性强、反应条件温和、高效且不产生二次污染等优点,被认为是具有发展前景的水处理技术,受到广泛关注.国内外相关学者对TiO2光催化降解氯乙酸作了相关研究[9-10].
本文以TCAA为对象,研究了在自制的光催化反应器中TiO2光催化降解TCAA的最佳反应条件,Fenton助TiO2光催化降解TCAA最佳H2O2/Fe2+投料比,并探讨了其中的相关机理.
1 实验部分
1.1 实验仪器与试剂
LC-20A高效液相色谱仪,日本岛津;紫外光源,15 W,λ=254 nm,广东雪莱特紫外灯有限公司;PHB-4数字pH计,中国雷磁公司;JY2502型电子天平,上海精密科学仪器有限公司,精确到0.000 1 g;光催化反应器,自制.
色谱级甲醇,AR,国药;三氯乙酸,AR,质量分数≥99 %,上海山浦化工有限公司;盐酸,AR,质量分数≥38 %,莱阳康德化工有限公司;氢氧化钠,AR,质量分数≥96 %,天津市大茂化学试剂厂;双氧水,AR,H2O2质量分数≥30 %,国药;六水合硝酸亚铁,AR,质量分数≥98 %,天津市大茂化学试剂厂;二氧化钛,质量分数≥99 %,天津市巴斯夫化工有限公司;实验过程所用水均为超纯水.
1.2 实验过程
实验在带有冷凝循环水和底部曝气装置的石英光催化反应器(如图1所示)中进行,冷凝循环水流速约150 mL/min,光催化反应器底板的曝气速率约40 mL/min.配置初始质量浓度为2.0 mg/L的TCAA溶液200 mL,加入一定量的TiO2,用浓度均为0.01 mol/L的盐酸及氢氧化钠调节溶液pH,并搅拌均匀;然后将上述混合物倒入已通好冷凝循环水并开启底部曝气的光催化反应器中,待TCAA和TiO2粉末在反应器表面达到吸附平衡后启动反应;每隔一段时间在反应器的中部取样口取出约10 mL样品溶液,静置约5 min,取上清液经0.45 μm微孔膜过滤后注入1.5 mL样品瓶中,用岛津高效液相色谱仪进行检测.

图1 光催化反应器
1.3 分析方法
采用液相色谱法进行测定.TCAA液相色谱分析条件为:流动相A为水,流动相B为甲醇,A与B流速均为0.5 mL/min,检测波长为230 nm,保留时间为1.192 min.其中峰面积Y与TCAA质量浓度X之间的线性相关方程为Y=5 967.1X+33.126,相关系数R2=0.999 9.
检测水样中TCAA的降解率公式如公式(1)所示.
(1)
式中:E为降解率, %;ρ0为三氯乙酸初始质量浓度,mg/L;ρt为三氯乙酸在t时刻质量浓度,mg/L.
2 结果与讨论
2.1 UV/TiO2光催化降解TCAA最佳反应条件的确定
为寻求UV/TiO2光催化降解TCAA最佳反应条件,实验研究了通气种类、TiO2用量、反应液初始pH等因素对TiO2光催化降解TCAA效率的影响,并与O2/UV体系对TCAA的降解率进行对比.实验结果如图2所示.
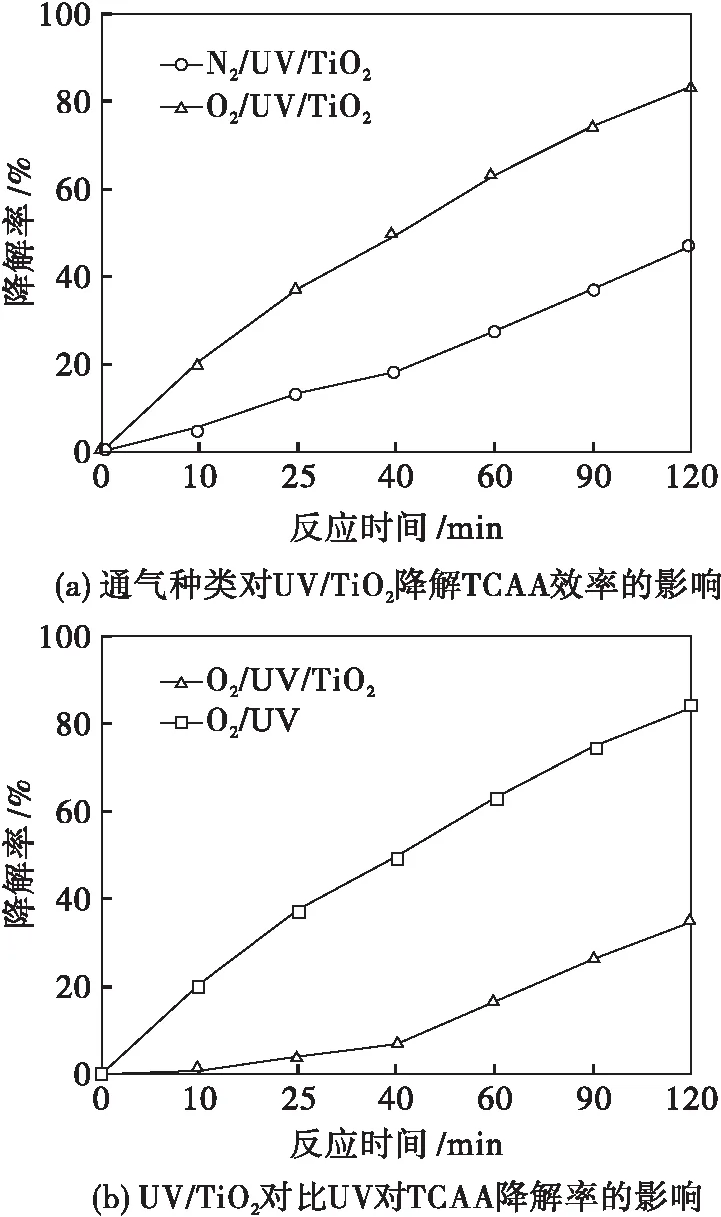
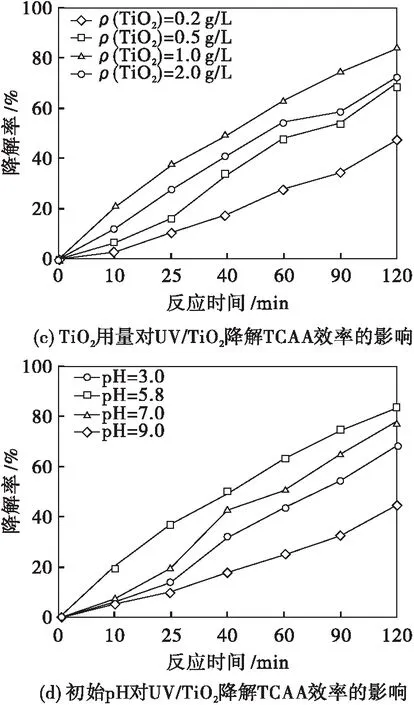
ρ0=2.0 mg/L T=303 K P=15 W
图2(a)表明UV/TiO2光催化降解TCAA最佳反应时间为120 min,通入O2明显更有利于反应的进行.这是因为TiO2光催化降解TCAA属于光催化氧化反应,与通入N2相比,通入O2可促进·OH的生成,某种程度上提高了TiO2光催化降解TCAA的效率.
图2(b)表明O2/UV/TiO2体系对TCAA的去除率明显优于O2/UV体系.这是因为加入催化剂TiO2后可利用它表面产生的·OH促进对TCAA降解反应的进行.
图2(c)表明TiO2光催化降解TCAA效率随TiO2用量的增加呈现出先增大后减小的趋势,最佳催化剂用量为1.0 g/L.这是因为当TiO2质量浓度低于1.0 g/L时,随着TiO2量的增加,由其表面产生的·OH的数目增多,从而增大了TiO2光催化降解TCAA的效率;当TiO2质量浓度高于1.0 g/L时,由于催化剂粒子之间产生部分遮蔽作用,导致TiO2颗粒表面漫反射现象严重,抑制了反应体系内部TiO2对光子的吸收,从而降低了TiO2光催化降解TCAA的效率.
图2(d)表明UV/TiO2光催化降解TCAA反应液最佳初始pH值为5.80.这是因为pH值过低抑制了TCAA的电离,导致富集在TiO2表面的Cl3CCOO-量减少,从而降低了TiO2光催化降解TCAA的效率;反之在碱性环境下,可促进TCAA电离出Cl3CCOO-,但碱性环境中的TiO2表面带负电荷,电荷间库伦斥力的作用使TiO2很难吸附带有同样性质电荷的Cl3CCOO-阴离子,这同样降低了TiO2光催化降解TCAA的效率[11].故在pH=5.8时,TiO2光催化降解TCAA的效率最佳,反应120 min,对TCAA的降解率可达83.38 %.
2.2 Fenton试剂对UV/TiO2光催化降解TCAA效率的影响
2.2.1 最佳Fe2+浓度的确定
为确定Fenton试剂助UV/TiO2光催化降解TCAA最佳Fe2+与H2O2投量比,需先确定最佳Fe2+浓度,实验结果如图3所示.

ρ0=2.0 mg/L T=303 K P=15 W λ=254 nm
由图3可以看出:UV/TiO2光催化降解TCAA的效率随Fe2+浓度的增大呈现出先增大后减小的趋势,其最佳Fe2+浓度为0.10 mmol/L.这是因为不稳定的Fe2+具有可生成空穴的潜势,可被光催化反应过程中生成的H2O2氧化生成Fe3+.在TiO2表面,Fe2+与Fe3+共同存在,Fe3+是光生电子的捕获阱,Fe2+是生成空穴的捕获阱,在两者的协调作用下,光生载流子可以获得有效分离,使TiO2光催化效率大大提高[12].但是,当Fe2+的浓度过高时,会被氧化产生过多的Fe3+,这增大了电子-空穴复合的几率,从而降低TiO2光催化降解TCAA的效率.
2.2.2 Fenton助UV/TiO2光催化降解TCAA最佳Fe2+/H2O2摩尔浓度投量比
Fenton助UV/TiO2光催化降解TCAA最佳Fe2+/H2O2摩尔浓度投量比实验结果如图4所示.
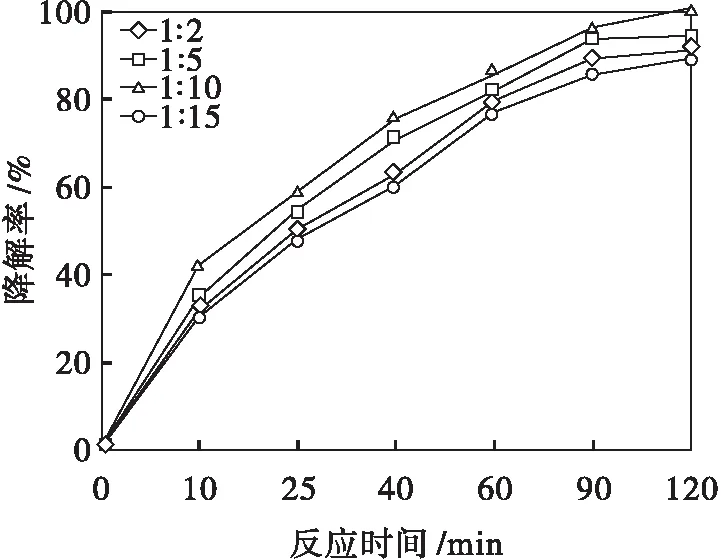
ρ0=2.0 mg/L T=303 K P=15 W λ=254 nm
由图4可以看出:最佳Fe2+/H2O2摩尔浓度投量比为1∶10.这是因为光催化反应实质是利用·OH氧化分解有机物的过程,溶液中共存的Fe2+与H2O2可氧化性极强的Fenton试剂,H2O2浓度的增大可增加反应体系中·OH的生成,同时促进不稳定的Fe2+氧化生成Fe3+,可促进光生载流子进行有效分离,从而使TiO2光催化降解TCAA效率得到大大提高.当Fe2+与H2O2摩尔浓度投量比达到1∶10,继续增大其投加比例,过量的H2O2氧化Fe2+成Fe3+,溶液中过多的Fe3+会增大电子-空穴复合的几率,同时会引发H2O2氧化其他中间产物,造成不必要的消耗,从而降低TiO2光催化降解TCAA的效率[13-14].故当Fe2+与H2O2摩尔浓度投量比为1∶10 时,UV/TiO2光催化降解TCAA的效率最佳,反应120 min,对TCAA降解率可达99.78 %.
2.3 不同反应体系对TCAA的降解率
不同反应体系对TCAA的降解率如图5所示.由图5可以看出:5个反应体系对TCAA的降解率从高到低依次为:Fenton/UV/TiO2、Fe2+/UV/TiO2、H2O2/UV/TiO2、UV/TiO2、UV.
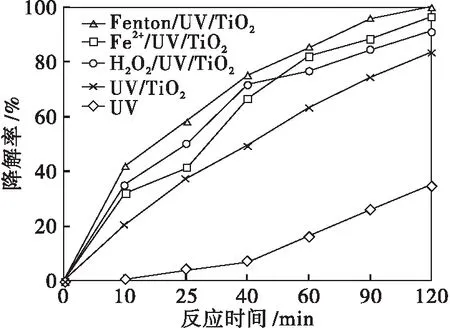
ρ0=2.0 mg/L T=303 K P=15 W λ=254 nm
2.4 TiO2光催化降解TCAA反应动力学研究
用Langmuir-Hinshelwood(L-H)动力学模型[15]来描述TiO2光催化降解TCAA反应动力学方程,结果如图6所示.
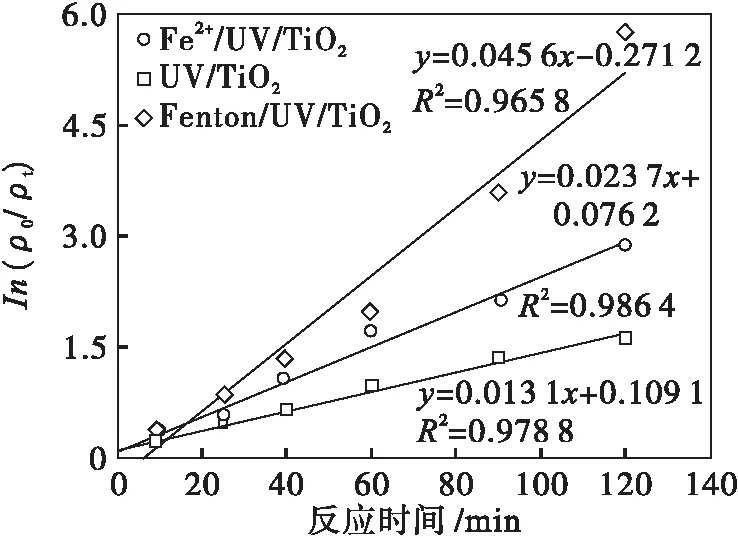
ρ0=2.0 mg/L T=303 K P=15 W λ=254 nm
由图6可以看出:UV/TiO2、Fe2+/UV/TiO2、Fenton/UV/TiO2对TCAA的降解反应均较好的遵循假一级反应动力学方程,其降解速率常数分别为:0.013 1 min-1、0.023 7 min-1、0.045 6 min-1,对应的半衰期分别为52.92 min、29.25 min、15.20 min.由此可见,当Fe2+与H2O2共存于反应液中,形成氧化性极强的Fenton试剂时,一定程度上缩短UV/TiO2光催化降解TCAA反应的半衰期时间,更好地促进UV/TiO2光催化降解TCAA反应的进行.
3 结 论
(1) UV/TiO2光催化降解TCAA最佳条件为:通入O2,初始pH=5.8,TiO2用量1.0 g/L,反应时间120 min,对初始质量浓度为2.0 mg/L的TCAA降解率可达83.38 %.
(2) Fenton助UV/TiO2光催化降解TCAA最佳Fe2+与H2O2摩尔浓度投量比为1∶10,其中共存Fe2+浓度为0.10 mmol/L,H2O2浓度为1.0 mmol/L,反应时间120 min,对TCAA的降解率可达99.78 %.
(3) UV/TiO2、Fe2+/UV/TiO2、Fenton/UV/TiO2对TCAA的降解反应均较好的遵循假一级反应动力学方程,其降解速率常数分别为:0.013 1 min-1、0.023 7 min-1、0.045 6 min-1,对应的半衰期分别为52.92 min、29.25 min、15.20 min.
参考文献:
[1] 刘丽颖,张荣.饮用水消毒副产物成因及控制措施[J].中国公共卫生,2012,28(5):707-709.
[2] 仝重臣,员建,苑宏英,等.饮用水处理中氯化消毒副产物三卤甲烷和卤代乙酸研究进展[J].净水技术,2012,31(2):6-11.
[3] McCulloeh A.Tdchloroacetic Acid in the Environment[J].Chemosphere,2002,47(7):667-686.
[4] Zhou H,Zhang X J,Wang Z S.Occurrence of Haloacetic Acids in Drinking Water in Certain Cities of China[J].Biomedical and Enviormental Sciences,2004,17(3):299-308.
[5] 杨媛,衡正吕.饮水氯化消毒副产物的氯乙酸类化合物的DNA损伤效应[J].环境与健康杂志,2006,23(4):294-296.
[6] Melinck R L,Nyska A,Foster P M,et al.Toxicity and Carcinogenicity of the Water Disinfection Byproduct,Dibromoacetic Acid,in Rats and Mice[J].Toxicology,2007,230(2):126-136.
[7] 赵玉丽,李杏放.饮用水消毒副产物:化学特性与毒性[J].环境化学,2011,30(1):20-34.
[8] 贾光辉,董高钟.氯化消毒副产物的控制研究进展[J].山西建筑,2012,38(20):203-205.
[9] 郑云,潘志明,王心晨.国内光催化研究进展简述[J].催化学报,2013,34:524-535.
[10] 卞战强,毛月英,田向红,等.饮用水中三氯乙酸的紫外光降解研究[J].工业水处理,2013,33(2):67-69.
[11] 牟晓英,崔福义,杨晓楠.水环境里纳米二氧化钛的表征及其零电位点的研究[J].纳米科技,2011,8(1):43-45.
[12] Naseri M T,Sarabadan M,Ashrafi D,et al.Photoassisted and Photocatalytic Degradation of Sulfur Mustard Using TiO2Nanoparticles and Polyoxometalates[J].Environmental Science and Pollution Research,2013,20(2):907-916.
[13] 李先国,周璇,刘金燕,等.光助Fenton氧化法去除水中两种氯乙酸及其动力学研究[J].中国海洋大学学报,2012,42(3):64-69.
[14] 张钰,郑蒙,邓安平,等.α-FeOOH类Fenton可见光光催化降解有毒有机污染物[J].环境科学与技术,2011,34(10):24-28.
[15] 阳海,周硕林,尹明亮,等.百克威光催化降解动力学的研究[J].中国环境科学,2013,33(1):82-87.
