AM真菌摩西球囊霉对盐胁迫条件下高羊茅生长特性的影响
2014-03-26杨海霞刘润进郭绍霞
杨海霞,刘润进,郭绍霞*
(1.青岛农业大学菌根生物技术研究所,山东 青岛266109;2.青岛农业大学园林与林学院,山东 青岛266109)
我国草坪业蓬勃发展,草坪需求日益增大,但是在许多逆境条件下,草坪草的生长受到抑制、草坪质量和功能受到影响、草坪建植出现困难,从而限制了草坪草的推广应用[1]。例如,土壤盐碱化便是绿化过程中常遇到的逆境之一[2]。盐碱地在世界范围内分布较广,全世界约有9.6×105hm2盐碱地,我国有盐渍地总面积约2.7×104hm2,随着生态环境的恶化和不合理地开发利用,仍在进一步扩大[3]。土壤次生盐渍化日益加重,直接影响到植物的生长发育。研究表明,土壤盐渍化对草本植物在生理生化方面产生显著的负面影响,在草坪草上的具体表现就是造成枯斑、发芽晚和早衰、生长不良等,直接影响草坪的美观,降低草坪的价值[4]。因此,降低土壤中有害盐类的含量及其对植物的伤害、提高植物的耐盐性是土壤盐渍土改良的核心问题。近年来,通过生物途径改良盐渍化环境,提高植物在盐渍土壤中的生产力已成为国内外改良盐渍土的新方向[5]。其中,菌根改善植物耐盐性的作用备受关注。
业已表明,丛枝菌根(arbuscular mycorrhizal,AM)真菌能促进植物的生长和发育,提高植物抗病、耐旱、耐受重金属胁迫的能力和耐盐能力[6-10]。盐胁迫下接种AM真菌能增加杜梨(Pyrusbetulaefolia)N、P和K含量,降低叶片的电导率和丙二醛含量[11],可以提高牡丹(Paeoniasuffruticosa)叶片K+/Na+,提高可溶性糖的含量,增强牡丹的渗透调节[12],提高草莓(Fragaria×ananassa)叶片SOD、POD和CAT活性[13],表明接种 AM真菌可通过介导植物生理生化代谢途径提高植物耐盐性。然而,有关AM真菌提高植物耐盐性的作用机制尚需进一步系统研究。
高羊茅(Festucaarundinacea)作为优良的冷季型草坪草,被广泛应用于各种草坪的建植,是目前我国应用最广泛的冷季型草坪草之一[14]。笔者曾观察到AM真菌能在一定程度上促进高羊茅的生长,改善其耐盐胁迫的能力。本文目的是研究AM真菌增强高羊茅耐盐性的作用机制,以期为AM真菌在盐碱地绿化中的应用提供理论依据与技术支持。
1 材料与方法
1.1 试验材料
供试AM真菌菌种为摩西球囊霉(Glomusmosseae,记为G.m),用保存在三叶草(Trifolium)栽培基质中的孢子、菌根根段和菌丝作为接种物,由青岛农业大学菌根生物技术研究所提供。供试草种为高羊茅;基质为壤土(pH 值7.96、有机质含量1.68%、全氮7.39%、速效磷43mg/kg、速效钾495mg/kg、含盐量0.03%),灭菌(121℃,2h);盐处理液采用 NaCl溶液。
1.2 试验处理及方法
接种处理:将高羊茅种子采用10%的过氧化氢消毒10min,于2013年9月10日在日光温室内播种,播种后自然光照,温度约为26℃/15℃(昼/夜)。育苗容器为圆形塑料花盆(上口直径30cm,下口直径22cm,高15 cm)。种子在播种时分别每盆接种摩西球囊霉菌剂5000接种势单位(IP=N×W×K+S,IP为接种势单位,N为单位长度根段内含有的泡囊数量,W为根重,K为单位重量根系长度,S为单位重量或体积接种剂内孢子数量)[15],对照(CK)则加等量灭菌接种物和接种物滤液。播种密度按照人工草坪的密度,高羊茅每盆播种2.8g。
盐胁迫处理:2013年11月10日进行盐胁迫处理。每个处理设4个盐浓度(0%,0.8%,1.2%,1.6%)。即AM真菌(2)×盐浓度(4)共8个处理,每个处理重复10盆,共80盆,随机排列。盐胁迫前控水数天,利于盐水在干燥的培养土中迅速扩散。盐胁迫处理时,为避免盐冲击效应,盐浓度每天按0.3%梯度递增,直至预定浓度,然后每2~3d按预定盐浓度(混有Hoagland营养液成分)浇灌1次,每次浇至约2/3的溶液流出,保持盐浓度的恒定,盐胁迫15d后测定各生理指标。
1.3 测定指标
盐胁迫第15天时,用剪刀剪取高羊茅同一部位叶片清洗干净,擦干,分别装入采样袋中,做好标记,放入液氮中,转移至-80℃超低温冰箱中保存待测,所有测定均重复3次。
抗氧化酶活性的测定:超氧化物歧化酶(superoxide dismutase,SOD)活性参照王学奎[16]氧化硝基四氮唑蓝法测定,SOD活性单位以抑制NBT光化还原的50%为一个酶活单位(U);过氧化氢酶(catalase,CAT)活性参照王学奎[16]紫外吸收法测定,以每分钟A240减少0.1的酶量为1个酶活性单位(U);过氧化物酶(peroxidase,POD)活性参照王学奎[16]愈创木酚氧化法测定,以每分钟A470变化0.01为1个酶活性单位(U)。
矿质元素含量:将植物叶片105℃杀青15min,80℃烘至恒重,用粉碎机粉碎后过筛,称取0.05g加入6mL浓HNO3消化,采用消煮炉消解法处理样品,将样品定容至25mL容量瓶后用ICP-OES-Optima 8x00电感耦合等离子体发射光谱仪(ICP)进行P、Fe、S、Zn、Cu、Na+、K、Ca和 Mg等元素含量的检测[17]。采用凯氏定氮法测定 N 含量[16];硝酸银滴定法测定 Cl- 含量[18]。
取新鲜植物叶片,用比色法测定抗坏血酸(ascorbic acid,AsA)含量[16];酸性茚三酮比色法测定游离脯氨酸(proline,Pro)含量[16];苯酚法测定可溶性糖含量[16];比色法测定丙二醛(malondialdehyde,MDA)含量[16];电解质渗透法测定膜透性(用相对电导度表示)[17]。
色谱检测法测定内源激素脱落酸(abscisic,ABA)、细胞分裂素(isopentenyl adenosine,IPA)、吲哚乙酸(indole-3-acetic acid,IAA)和赤霉素(gibberellin,GA)含量[16]。称取0.5~1.0g新鲜高羊茅叶片,加2mL样品提取液,在冰浴下研磨成匀浆,转入10mL试管,再用2mL提取液分次将研钵洗干净,一并转入试管中,摇匀后放置在4℃冰箱中。样品测定方法,包被→洗板→竞争→洗板→加二抗→洗板→加底物显色→比色[16]。
1.4 数据分析
采用DPSv 7.5软件对所测数据进行双因素方差分析,用LSD法对各测定数据进行多重比较。
2 结果与分析
2.1 AM真菌对盐胁迫下高羊茅抗氧化系统的影响
在同一盐浓度下,接种摩西球囊霉后高羊茅叶片抗氧化酶活性显著提高(P<0.05)。随盐浓度的增大,SOD、POD和CAT活性显著增加(P<0.05)。在1.6%盐胁迫时,接种摩西球囊霉的SOD、POD和CAT活性分别比未接种提高了11.2%,8.3%和10.9%。摩西球囊霉和NaCl对高羊茅SOD、POD和CAT活性均有极显著影响(P<0.01),二者的交互作用对高羊茅SOD和POD活性无显著影响,而对高羊茅CAT活性有极显著影响(P<0.01)(表1)。
接种摩西球囊霉后高羊茅叶片抗坏血酸含量提高。随盐浓度的增大,抗坏血酸含量呈现下降趋势。0.8%,1.2%和1.6%盐胁迫时,接种摩西球囊霉的抗坏血酸含量分别比未接种提高了9.1%,12.4%和19.5%。摩西球囊霉对高羊茅抗坏血酸含量有极显著影响(P<0.01),NaCl和二者的交互作用无显著影响(P>0.05)(表1)。
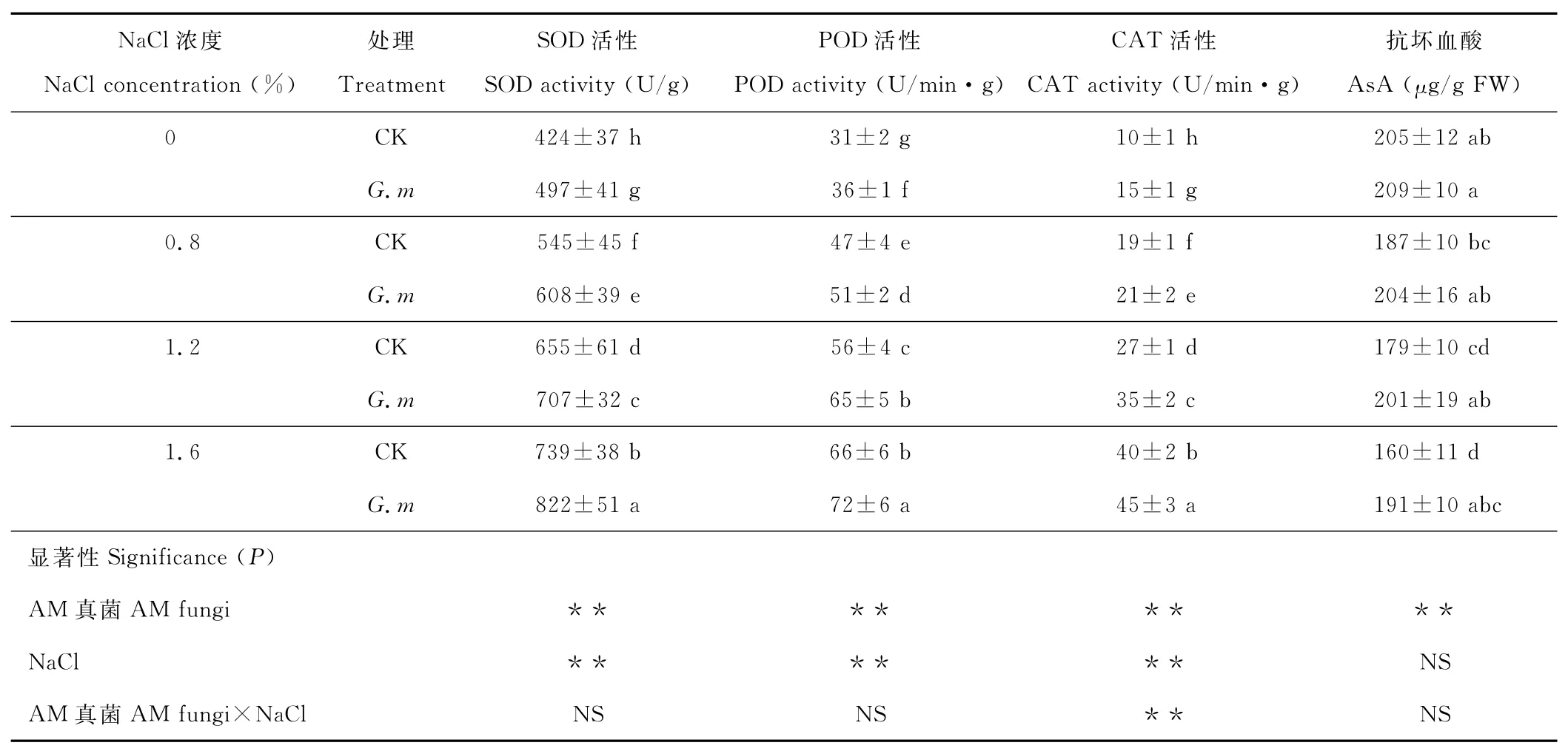
表1 AM真菌对盐胁迫下高羊茅抗氧化系统的影响Table 1 Effects of AM fungi on antioxidant system of F.arundinaceaunder salt stress
2.2 AM真菌对盐胁迫下高羊茅叶片丙二醛和膜透性的影响
在同一盐浓度下,接种摩西球囊霉可显著降低盐胁迫下高羊茅叶片丙二醛含量和膜透性(P<0.05)。随盐浓度的增大,丙二醛含量和膜透性显著增加(P<0.05)。1.2%NaCl胁迫下,接种摩西球囊霉处理高羊茅叶片丙二醛和膜透性与未接种处理相比,降低幅度最大,分别为35.4%和25.6%。NaCl对高羊茅丙二醛含量和膜透性有极显著影响(P<0.01),摩西球囊霉和NaCl二者的交互作用对高羊茅丙二醛含量和膜透性有极显著影响(P<0.01)(图1和表2)。
2.3 AM真菌对盐胁迫下高羊茅营养元素和离子毒害的影响
AM真菌通过扩大植物根系的吸收范围,从而增加植物对营养元素的吸收。接种摩西球囊霉可提高高羊茅叶片N、P、S和Zn含量。随盐浓度的增大,N、P和S含量呈现下降趋势,Zn含量呈上升趋势。在盐浓度0.8%,1.2%和1.6%时,接种摩西球囊霉的高羊茅叶片N含量与未接种处理差异显著(P<0.05),分别比未接种处理提高6.8%,4.5%和5.3%,其中盐浓度0.8%时提高幅度最大。在盐浓度1.6%时,接种摩西球囊霉的高羊茅叶片P含量与未接种处理差异显著(P<0.05),比未接种处理提高26.3%。在相同盐浓度下,接种摩西球囊霉的高羊茅叶片S和Zn含量与未接种处理差异不显著(P>0.05)。摩西球囊霉和NaCl对高羊茅N有显著影响(P<0.05),二者的交互作用对其有极显著影响(P<0.01)(表3)。
随盐浓度增大,Fe含量呈现先上升后下降趋势,在盐浓度1.2%时,Fe含量最大。在盐浓度0%,0.8%和1.2%时,接种摩西球囊霉降低了高羊茅叶片Fe含量。在盐浓度1.6%时,接种摩西球囊霉显著提高了高羊茅叶片Fe含量(P<0.05)。接种摩西球囊霉可降低高羊茅叶片Mn和Cu含量。Mn含量呈现曲折上升趋势。在相同盐浓度下,接种摩西球囊霉的高羊茅叶片Mn含量与未接种处理差异显著(P<0.05)。摩西球囊霉对高羊茅Mn和Cu有显著影响(P<0.05),NaCl对高羊茅Fe和Cu有显著影响(P<0.05),二者的交互作用对高羊茅Fe和 Mn均有极显著影响(P<0.01)(表3)。
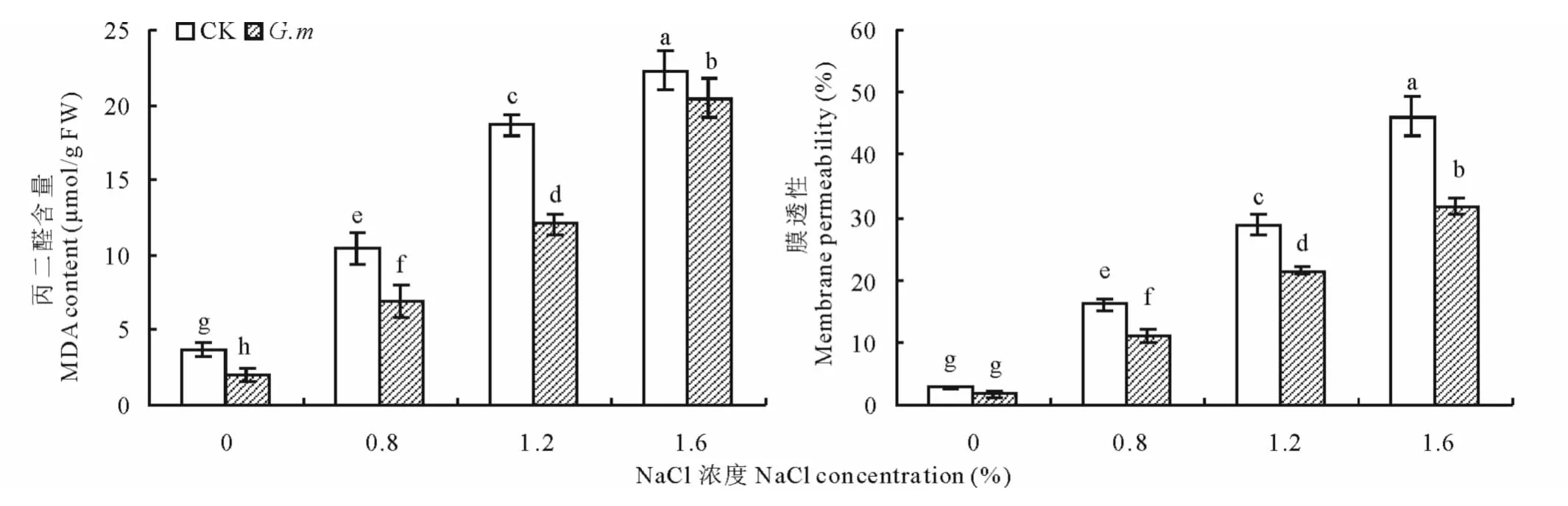
图1 AM真菌对盐胁迫下高羊茅叶片丙二醛和膜透性的影响Fig.1 Effects of AM fungi on MDA and membrane peroxidation in leaves of F.arundinaceaunder salt stress
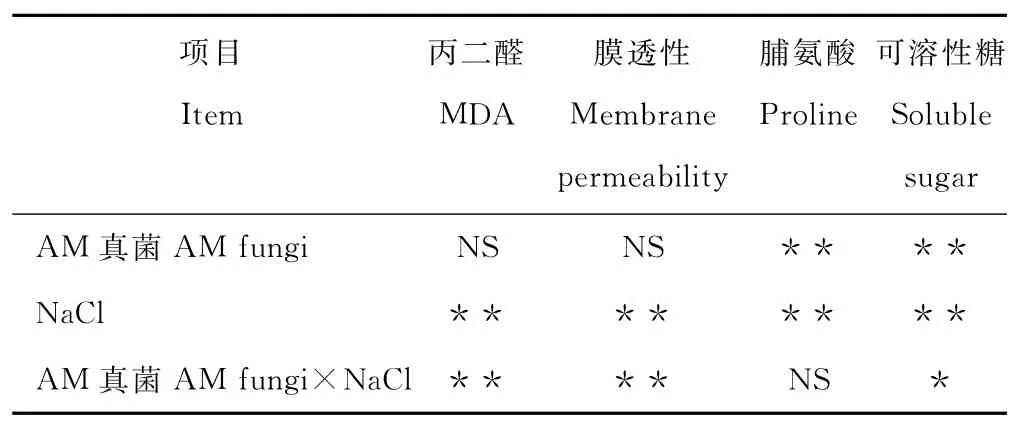
表2 AM真菌对盐胁迫下高羊茅叶片方差分析Table 2 Effects of AM fungi on leaf osmotic regulation of F.arundinaceaunder salt stress

表3 AM真菌对盐胁迫下高羊茅叶片N、P、Fe、S、Zn、Cu和Mn含量的影响Table 3 Effects of AM fungi on N,P,Fe,S,Zn,Cu and Mn content in leaves of F.arundinaceaunder salt stress
接种摩西球囊霉能不同程度地降低Na+和Cl-含量。在盐浓度为1.6%时,接种摩西球囊霉显著降低了高羊茅叶片Na+含量(P<0.05),比未接种处理降低32.2%。随盐浓度的增大,Cl-含量呈显著上升趋势(P<0.05)。在盐浓度0.8%,1.2%和1.6%时,接种摩西球囊霉的高羊茅叶片Cl-含量分别比未接种处理降低5.8%,5.6%和8.1%,其中盐浓度1.6%时降低幅度最大。接种摩西球囊霉后高羊茅叶片K、Ca、Mg含量和K/Na、Mg/Na、Ca/Na值与未接种相比,差异均不显著(P>0.05)。随盐浓度的增大,K、Ca、Mg含量和 K/Na、Mg/Na、Ca/Na值呈下降趋势。摩西球囊霉对高羊茅Cl-和Ca均有极显著影响(P<0.01),NaCl对高羊茅Cl-、Ca和Ca/Na值均有极显著影响(P<0.01),对Na+有显著影响(P<0.05),二者的交互作用对高羊茅Cl-和Mg/Na有显著影响(P<0.05)(表4)。
2.4 AM真菌对盐胁迫下高羊茅叶片渗透调节的影响
接种摩西球囊霉后高羊茅叶片可溶性糖含量显著提高(P<0.05)。随盐浓度的增大,高羊茅叶片可溶性糖含量显著增加(P<0.05)。在盐浓度0.8%,1.2%和1.6%时,接种摩西球囊霉的高羊茅叶片可溶性糖含量分别比未接种处理提高24.2%,16.7%和8.8%,可见,随盐浓度的增加,接种摩西球囊霉提高高羊茅可溶性糖的幅度呈下降趋势。摩西球囊霉和NaCl对高羊茅可溶性糖含量有极显著影响(P<0.01),二者的交互作用对高羊茅可溶性糖含量有显著影响(P<0.05)(图2和表2)。
随盐浓度的增大,未接种处理的高羊茅叶片脯氨酸含量增加显著(P<0.05),而接种处理的增加缓慢。在盐浓度0.8%,1.2%和1.6%时,接种摩西球囊霉的高羊茅叶片脯氨酸含量分别比未接种处理降低31.3%,30.5%和28.9%,可见,随盐浓度的增加,接种摩西球囊霉降低高羊茅脯氨酸的幅度呈下降趋势。摩西球囊霉和NaCl对高羊茅脯氨酸含量有极显著影响(P<0.01),二者的交互作用对高羊茅脯氨酸含量无显著影响(P>0.05)(图2和表2)。
2.5 AM真菌对盐胁迫下高羊茅叶片激素含量的影响
在同一盐浓度下,接种摩西球囊霉后高羊茅叶片ABA、GA、IPA和IAA含量显著提高(P<0.05)。随盐浓度的增大,GA、IPA和IAA含量呈现下降趋势,ABA含量呈现上升趋势。1.6%盐胁迫时,接种摩西球囊霉处理的ABA、GA、IPA和IAA含量分别比未接种处理增加了6.7%,35.8%,20.0%和52.5%。摩西球囊霉和NaCl对高羊茅ABA和IAA均有极显著影响(P<0.01),对IPA有显著影响(P<0.05),二者的交互作用对高羊茅ABA、GA、IPA和IAA均有极显著影响(P<0.01)(表5)。
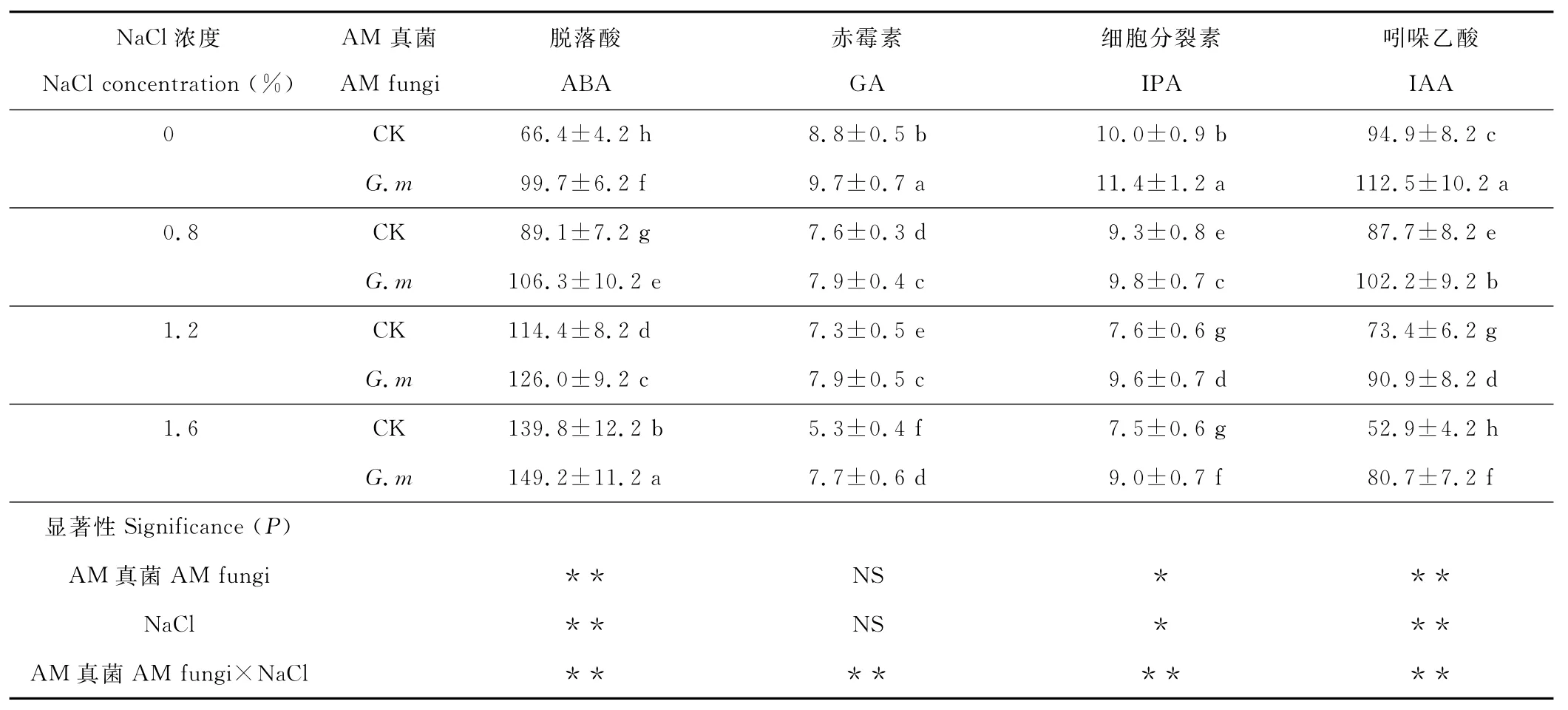
表5 AM真菌对盐胁迫下高羊茅叶片激素含量的影响Table 5 Effects of AM fungi on hormone content in leaves of F.arundinaceaunder salt stress ng/g FW
3 讨论
盐胁迫下接种AM真菌能够提高植物抗氧化酶的活性,增强植物的抗氧化防御系统,降低氧化胁迫造成的伤害[5,19]。本试验表明摩西球囊霉能显著提高高羊茅SOD、POD和CAT活性,表明高羊茅抗氧化酶系统对AM真菌很敏感。AM真菌提高植物抗氧化酶的活性可能与促进植物的生长和对P、N的吸收有关[20]。本试验盐胁迫下AM真菌提高高羊茅叶片N、P、S和Zn含量(表3)和抗氧化酶的活性(表1),则支持了上述观点。Feng等[21]认为菌根化植物增加细胞膜的稳定性是由于菌根作用增强植物对磷的吸收,同时增加了植物中抗氧化剂的合成。抗氧化剂可以阻止活性氧对植物的氧化损伤[22],减少膜脂过氧化作用,因而作为膜脂过氧化产物的丙二醛含量也会减少,接种AM真菌能够使植物细胞膜保持更加好的完整性和稳定性,因此菌根化根系的细胞膜透性要低于非菌根化根系[23-24](表1和图1)。可见,接种AM真菌激发植物抗氧化酶系统是提高植物耐盐性的一个重要生理机制。
有关AM真菌减缓盐离子对植物毒害作用的机制,目前尚无定论。本试验表明接种摩西球囊霉能显著降低盐胁迫下高羊茅叶片Cl-和Na+含量(P<0.05)。随盐浓度增加,不是Na+而是Cl-含量增加明显,菌根植株的K和Ca等增幅更大[22],从而降低了菌根化植株体内盐离子相对含量,有利于减轻盐离子毒害作用。Juniper和Abbott[25]认为AM真菌增加了植株生长,同时相对稀释了有毒离子的浓度,减缓了离子毒害。此外,高效摄取K+、维持较高的K+/Na+值与植物的耐盐性也密切相关[26]。盐胁迫下,接种AM真菌能促进番茄(Lycopersiconesculentum)对K+的吸收,相对提高了K+/Na+值,因而减缓了Na+的毒害作用,增强了植株的耐盐性[27-28]。而且,本试验双因素方差结果显示,摩西球囊霉和NaCl对高羊茅Mg/Na值有显著影响(P<0.05)(表4),这说明接种摩西球囊霉还能通过促进高羊茅对Mg的吸收,相对提高Mg/Na值,来减缓Na+的毒害作用。因此,AM真菌对盐胁迫下不同植物耐Na+和Cl-毒害的作用机制有待进一步研究。
本试验证明,接种摩西球囊霉可以通过提高盐胁迫下高羊茅的渗透调节来提高高羊茅的耐盐性。接种摩西球囊霉使高羊茅可溶性糖含量显著提高(P<0.05)。这些可溶性糖一部分可作为渗透调节物质起作用,一部分为新蛋白质的合成提供碳架,还有一部分可间接转化为脯氨酸等[29]。盐胁迫下,接种摩西球囊霉的高羊茅叶片脯氨酸含量显著低于对照(P<0.05),这与Rabie和Almadini[30]对蚕豆(Viciafaba)的研究结果一致。潘瑞炽和董愚得[31]、薛秀栋等[32]认为盐胁迫下脯氨酸含量大小可以反映植物遭受盐害的程度。因此,该结果可以表明接种AM真菌的高羊茅受到盐胁迫伤害程度较轻,提高了植物的抗逆性。与此相反,接种AM真菌提高了大豆(Glycinemax)[33]和绿豆(Vignaradiata)[34]脯氨酸的含量。一些研究认为脯氨酸是一种渗透保护剂[35-36],脯氨酸的积累是盐胁迫下植物一种保护性措施;而 Wang等[37]建议把脯氨酸的积累看作是盐胁迫的标志,其渗透调节作用与K+相比可忽略不计。因此,关于脯氨酸在植物抗逆性中的作用机制值得深入探索。另外,本试验观察到,随着盐浓度的增加,脯氨酸含量呈升高趋势,且盐对高羊茅脯氨酸含量有极显著影响(P<0.01),这与薛秀栋等[32]得出的结论相一致,其机制可能是盐抑制脯氨酸氧化和促进其合成[32]。而关于AM真菌对脯氨酸的影响及其对高羊茅抗盐性的作用,尚待进一步试验。
盐胁迫下植物能产生一些适应性机制,除了积累一些大分子蛋白和小分子物质外,植物激素含量及激素平衡也发生了变化,这些变化调控植物基因表达来适应盐胁迫,如ABA含量增加[38]。而AM真菌对盐胁迫下植物内源激素的影响研究国内外报道较少。本试验接种摩西球囊霉能显著提高盐胁迫下高羊茅叶片的ABA含量的结果支持了贺忠群等[39]的结论。AM真菌调节该变化的机制尚不清楚。ABA诱导了植株的气孔关闭,而气孔是控制叶片内外水蒸汽和CO2扩散的通道,从而直接影响植物蒸腾和光合过程,保证盐胁迫下的光合作用和水分代谢,从而利于菌株的生长和耐盐性的提高[40]。盐胁迫下接种摩西球囊霉提高植物体内IAA和GA含量的生理效应(表5)与正常条件下的一致[40]。双因素方差结果中,摩西球囊霉对高羊茅ABA和IAA均有极显著影响(P<0.01),对IPA有显著影响(P<0.05)也证实了这一点。但其盐胁迫下AM真菌改变植物内源激素平衡状况的效应与作用机制值得深入研究。
笔者认为AM真菌主要通过增强高羊茅的抗氧化防御系统、降低氧化胁迫造成的伤害、减缓离子毒害、改善高羊茅养分的吸收、强化渗透调节作用和维持植物内源激素平衡状况等机制来增强高羊茅耐盐性。本试验的结果显示AM真菌和NaCl水平之间存在显著的交互效应,可显著影响或极显著影响高羊茅的CAT活性、丙二醛含量、膜透性、N、Fe、Mn、可溶性糖和激素(表1~5),这种交互效应说明AM真菌对这些指标发挥作用不受盐胁迫的影响,能在一定程度上改善高羊茅的抗盐能力,AM真菌和NaCl的交互作用机制仍需要进一步的深入研究。本试验首次比较系统地探索和揭示了AM真菌通过介导植物生理生化代谢途径来提高高羊茅耐盐性机制,这对于今后AM真菌在盐渍土壤改良中的应用具有重要的意义。
[1] 徐胜,李建龙,赵德华.高羊茅的生理生态及其生化特性研究进展[J].草业学报,2004,13(1):58-64.
[2] 陈静波,阎君,张婷婷,等.四种暖季型草坪草对长期盐胁迫的生长反应[J].草业学报,2008,17(5):30-36.
[3] 李源,刘贵波,高洪文,等.紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应[J].草业学报,2010,19(4):79-86.
[4] 梁惠敏,夏阳,杜峰,等.盐胁迫对两种草坪草抗性生理生化指标影响的研究[J].中国草地,2001,23(5):27-30.
[5] 曾广萍,张霞,刘红玲,等.盐胁迫下AM真菌对红花耐盐性的影响[J].植物生理学报,2012,47(11):1069-1074.
[6] 叶少萍,曾秀华,辛国荣,等.不同磷水平下丛枝菌根真菌 (AMF)对狗牙根生长与再生的影响[J].草业学报,2013,22(1):46-52.
[7] 鹿金颖,毛永民,申连英,等.VA菌根真菌对酸枣实生苗抗旱性的影响[J].园艺学报,2003,30(1):29-33.
[8] 柳洁,肖斌,王丽霞,等.盐胁迫下丛枝菌根 (AM)对茶树生长及茶叶品质的影响[J].茶叶科学,2013,33(2):140-146.
[9] 王树和,王晓娟,王茜,等.丛枝菌根及其宿主植物对根际微生物作用的响应[J].草业学报,2007,16(3):108-113.
[10] Liu J,Maldonado-Mendoza I,Lopez-Meyer M,etal.Arbuscular mycorrhizal symbiosis is accompanied by local and systemic alterations in gene expression and an increase in disease resistance in the shoots[J].The Plant Journal,2007,50(3):529-544.
[11] 高崇.接种AM真菌对盐胁迫下杜梨实生苗生长及耐盐性的影响研究[D].重庆:西南大学,2013.
[12] 郭绍霞,刘润进.丛枝菌根真菌Glomusmosseae对盐胁迫下牡丹渗透调节的影响[J].植物生理学通讯,2010,46(10):1007-1011.
[13] 杨瑞红,刘润进,刘成连,等.AM 真菌和水杨酸对草莓耐盐性的影响[J].中国农业科学,2009,42(5):1590-1594.
[14] 樊瑞苹,周琴,周波,等.盐胁迫对高羊茅生长及抗氧化系统的影响[J].草业学报,2012,21(1):112-117.
[15] Liu R J,Luo X S.A new method to quantify the inoculum potential of arbuscular mycorrhizal fungi[J].New Phytologist,1994,128(1):89-92.
[16] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:1-283.
[17] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:1-147.
[18] 劳家柽.土壤农化分析手册[M].北京:农业出版社,1988:656-657.
[19] He Z Q,He C X,Zhang Z B,etal.Changes of antioxidative enzymes and cell membrane osmosis in tomato colonized by arbuscular mycorrhizae under NaCl stress[J].Colloids and Surfaces B:Biointerfaces,2007,59(2):128-133.
[20] Alguacil M M,Hernández J A,Caravaca F,etal.Antioxidant enzyme activities in shoots from three mycorrhizal shrub species afforested in a degraded semi-arid soil[J].Physiologia Plantarum,2003,118(4):562-570.
[21] Feng G,Zhang F,Li X,etal.Improved tolerance of maize plants to salt stress by arbuscular mycorrhiza is related to higher accumulation of soluble sugars in roots[J].Mycorrhiza,2002,12(4):185-190.
[22] Jiang M,Zhang J.Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize leaves[J].Journal of Experimental Botany,2002,53:2401-2410.
[23] Garg N,Manchanda G.Effect of arbuscular mycorrhizal inoculation on salt-induced nodule senescence inCajanuscajan(pigeonpea)[J].Journal of Plant Growth Regulation,2008,27(2):115-124.
[24] Kaya C,Ashraf M,Sonmez O,etal.The influence of arbuscular mycorrhizal colonisation on key growth parameters and fruit yield of pepper plants grown at high salinity[J].Scientia Horticulturae,2009,121(1):1-6.
[25] Juniper S,Abbott L.Vesicular-arbuscular mycorrhizas and soil salinity[J].Mycorrhiza,1993,4(2):45-57.
[26] 李先婷,曹靖,魏晓娟,等.NaCl渐进胁迫对啤酒大麦幼苗生长,离子分配和光合特性的影响[J].草业学报,2013,22(6):108-116.
[27] Al-Karaki G N,Hammad R,Rusan M.Response of two tomato cultivars differing in salt tolerance to inoculation with mycorrhizal fungi under salt stress[J].Mycorrhiza,2001,11(1):43-47.
[28] Niu X,Bressan R A,Hasegawa P M,etal.Ion homeostasis in NaCl stress environments[J].Plant Physiology,1995,109(3):735.
[29] 李洪燕,郑青松,刘兆普,等.海水胁迫对苦荬菜幼苗生长及生理特性的影响[J].植物学报,2010,45(1):73-78.
[30] Rabie G H,Almadini A M.Role of bioinoculants in development of salt-tolerance ofViciafabaplants under salinity stress[J].African Journal of Biotechnology,2005,4(3):210-222.
[31] 潘瑞炽,董愚得.植物生理学[M].北京:高等教育出版社,1995:1-206.
[32] 薛秀栋,董晓颖,段艳欣,等.不同盐浓度下3种结缕草的耐盐性比较研究[J].草业学报,2013,22(6):315-320.
[33] Sharifi M,Ghorbanli M,Ebrahimzadeh H.Improved growth of salinity-stressed soybean after inoculation with salt pre-treated mycorrhizal fungi[J].Journal of Plant Physiology,2007,164(9):1144-1151.
[34] Jindal V,Atwal A,Sekhon B S,etal.Effect of vesicular-arbuscular mycorrhizae on metabolism of moong plants under NaCl salinity[J].Plant Physiology and Biochemistry,1993,31(4):475-481.
[35] Sannazzaro A I,Echeverría M,AlbertóE O,etal.Modulation of polyamine balance inLotusglaberby salinity and arbuscular mycorrhiza[J].Plant Physiology and Biochemistry,2007,45(1):39-46.
[36] 袁星星,王娟,谢彦杰,等.外源一氧化碳对小麦幼苗耐盐性以及根中脯氨酸含量的影响[J].植物生理学通讯,2009,45(6):567-570.
[37] Wang S,Wan C,Wang Y,etal.The characteristics of Na+,K+and free proline distribution in several drought-resistance plants of the Alxa Desert,China[J].Journal of Arid Environments,2004,56(3):525-539.
[38] Munns R,Cramer G R.Is coordination of leaf and root growth mediated by abscisic acid?Opinion[J].Plant and Soil,1996,185(1):33-49.
[39] 贺忠群,李焕秀,汤浩茹,等.丛枝菌根真菌对NaCl胁迫下番茄内源激素的影响[J].核农学报,2010,24(5):1099-1104.
[40] 于建新,李辉,郭绍霞,等.丛枝菌根真菌对番茄植株内源激素含量的影响[J].青岛农业大学学报 (自然科学版),2010,27(2):100-104.
