甲烷部分氧化的热力学模拟研究
2014-03-26余长林周晓春胡久彪樊启哲
余长林, 周晓春, 胡久彪, 樊启哲
(江西理工大学冶金与化学工程学院,江西 赣州341000)
0 前 言
合成气(CO+H2)被认为是制备合成油和烯烃等众多化工产品的枢纽原料.而催化甲烷部分氧化(CPOM)是生产合成气的主要工艺之一[1-5].该工艺对于提高天然气的利用价值“实现天然气化工的长远发展”,具有重要的意义.甲烷具有较稳定的分子结构,室温下一般不与其他物质发生反应.但在高温下,它可以自身裂解为炭和H2[6],或与其他氧化性物质发生氧化还原反应等.甲烷部分氧化反应属于选择性氧化的范畴,因此其产物并非热力学稳定的物质,在反应过程中往往会发生深度氧化形成副产物,即H2O和CO2.在高温下,这两种物质还会与未反应的CH4发生重整反应[7-9],从而使反应体系变得更加复杂.因此,如何对甲烷部分氧化进行理论计算,了解反应温度、压力和CH4/O2进料等因素对反应的影响,可以为实际反应提供理论指导.
Aspen Plus(Advanced System for Process Engineering)软件是由美国麻省理工学院开发的一款通用化工模拟仿真软件,软件内置有丰富的单元操作模块,几乎能满足所有化工生产过程中的计算.根据化工热力学相关知识[10],气相物质的宏观性质,可以通过真实气体的状态方程来描述.当压力不是很高(<10 MPa),温度较高时,运用常见的立方形、两参数状态方程,如SRK(Soave-Redlich-Kwong[11])、PR(Peng-Robinson[12])方程,都能得到相当精确的结果.文中运用Aspen Plus软件结合另一个热力学计算工具 HSC Chemistry软件(芬兰Outotec公司)对甲烷部分氧化的热力学进行模拟分析.
1 数学模型的推导
复杂化学反应平衡的计算往往需要建立数学模型才能解决问题.通过化学反应平衡判据dG=0,寻找反应体系的吉布斯自由能的极小值,可以解算复杂化学平衡时各组分的含量,这种方法称作最小自由能法[12-13].
设体系中含有的原子种类数为M,平衡时的组分数为N.达到化学平衡时的体系吉布斯自由能为


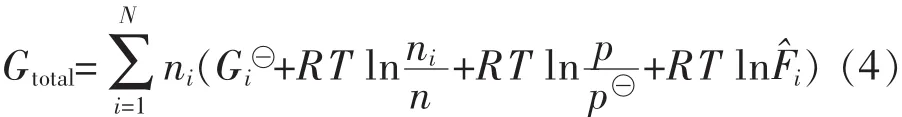
ni由以下限制条件决定
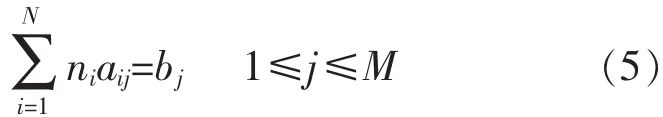
式(5)中:aij是第i组分化学式中j元素原子个数,bj是第j种元素的总物质的量.定义函数F为:
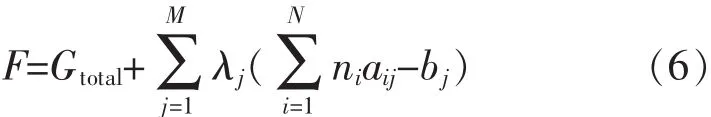
其中λj为拉格朗日乘数.上述推导过程适用于气相反应,甲烷部分氧化反应体系中可能还存在积炭反应,由气固相平衡得到如下关系.
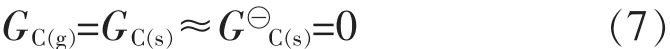
为了得到平衡组分i的物质的量ni,根据最小自由能原理将式(6)对ni求偏导数,令:
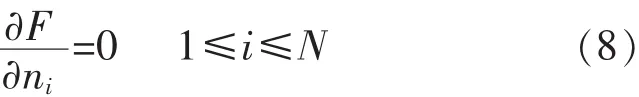
因此通过以上方法即可建立迭代关系:
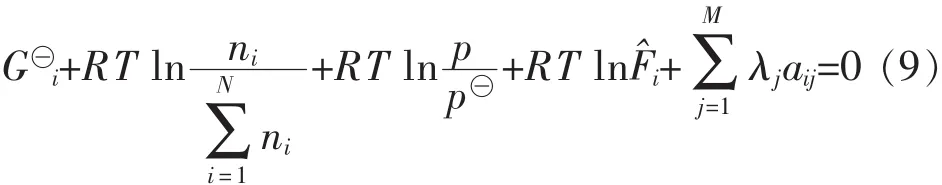
2 甲烷部分氧化反应的模拟分析
2.1 甲烷部分氧化反应中的反应途径
化学反应进行的方向和程度受到化学平衡的影响.对于含有多个化学平衡的复杂反应体系,反应产物的组成将受到体系温度、压力和进料配比等因素的影响.甲烷部分氧化就是这样的一个反应体系,它包含有多个化学平衡,在这个体系中可能发生的化学反应主要包括部分氧化(主反应)、燃烧、重整、水煤气变换、积炭等[14-16].各化学反应方程式和750°C下的反应热见表1.由于甲烷部分氧化通常采用连续流动固定床反应器,属于稳态操作,积炭是非稳态过程,表1中未列出积炭反应.
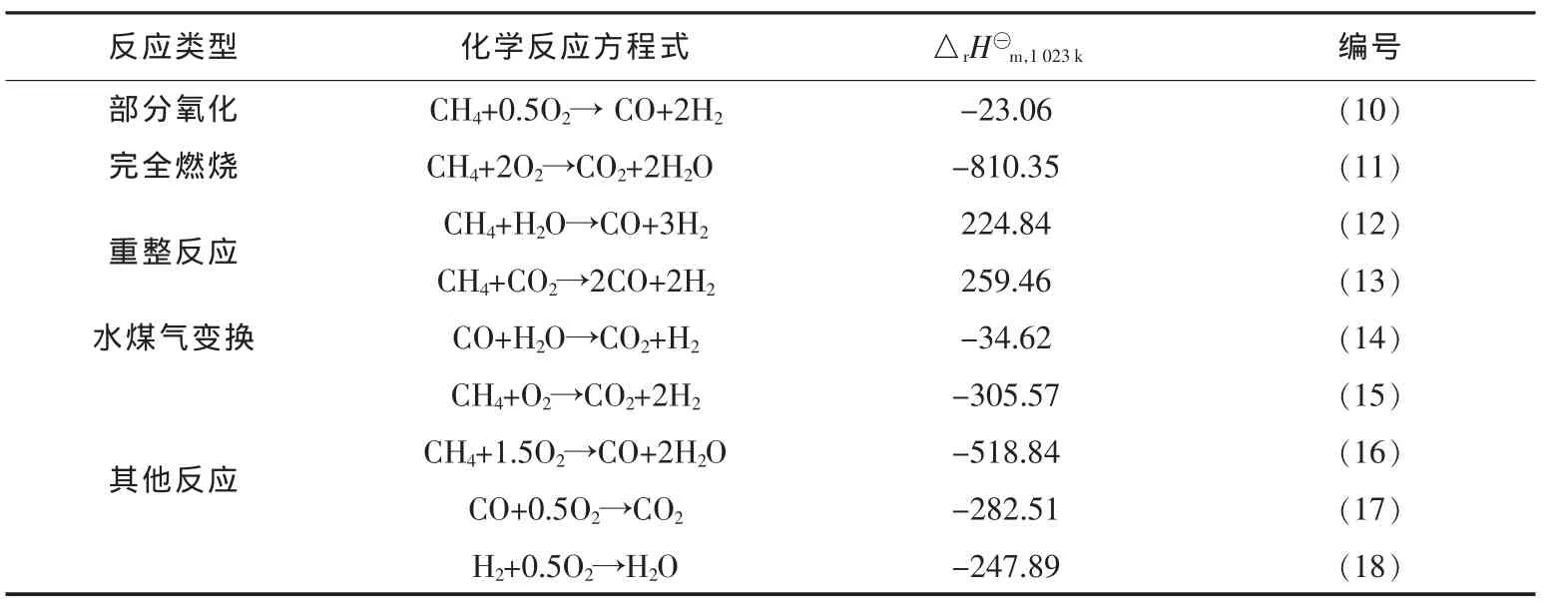
表1 甲烷部分氧化体系中的化学反应
由表1可以看出,部分氧化反应和水煤气变换放热温和,唯独两个重整反应是强吸热反应,因此需要更高的能耗才能驱动反应的发生.在甲烷部分氧化体系中,水煤气变换是一个重要的中间反应,具有明显的可逆性.Lanza等[17]研究发现,中间温度下正/逆水煤气变换在甲烷部分氧化体系中都能快速达到平衡,主要起到调节产物中H2/CO的比例,高温下重整反应占主导地位,是合成气产生的主要途径.实际过程中发生的反应可能不止以上列出的这些反应,因为反应之间可能存在耦合.
2.2 温度、压力和CH4/O2进料影响
图1和图2是运用Aspen Plus软件研究了温度、压力对CH4/O2进料为1∶2时对甲烷部分氧化反应过程中CH4的转化率和CO与H2的选择性的影响.模拟条件为总进料流量100 kmol/h,物性方法选择两参数、立方形的SRK状态方程,软件根据自带的数据库对Binary Interaction参数自动匹配,选择REquil单元操作模块作为反应器,化学反应方程来自于表1所列出的9个反应,以温度为自变量,对产物中各组分的出口流量进行灵敏度分析.由图1,图2可以看出,随着反应温度的升高,压力的减小,CH4的转化率和CO与H2的选择性均呈上升趋势.实际的反应条件选在750℃和1 atm(即:1.013 25×105Pa),此时的反应活性已经相当高了[18].反应物的进料比对甲烷部分氧化有较大的影响,如图2所示,毫无疑问最佳进料比为主反应的化学计量比.偏离最佳进料比,对反应物的转化率和产物的选择性都有相当大的影响.
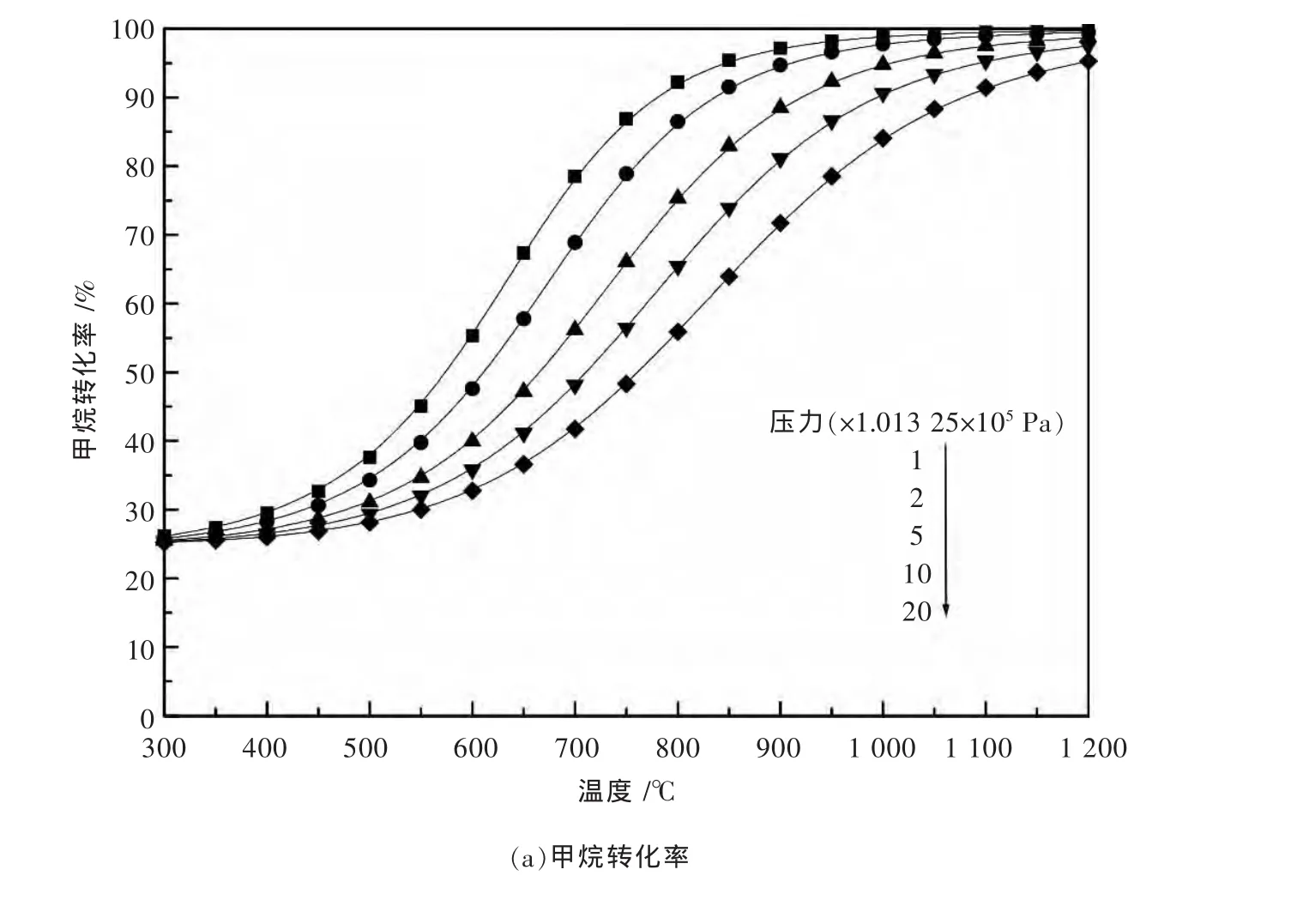
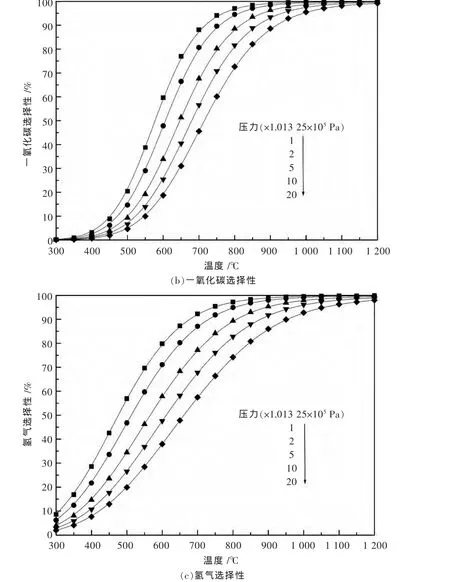
图1 甲烷部分氧化反应的模拟分析:温度与压力的影响
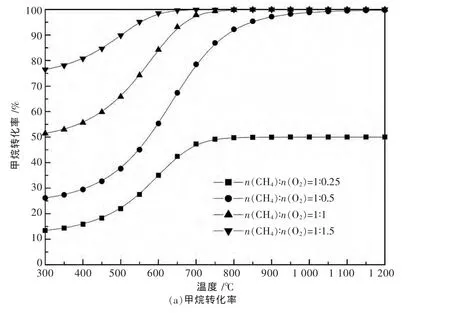
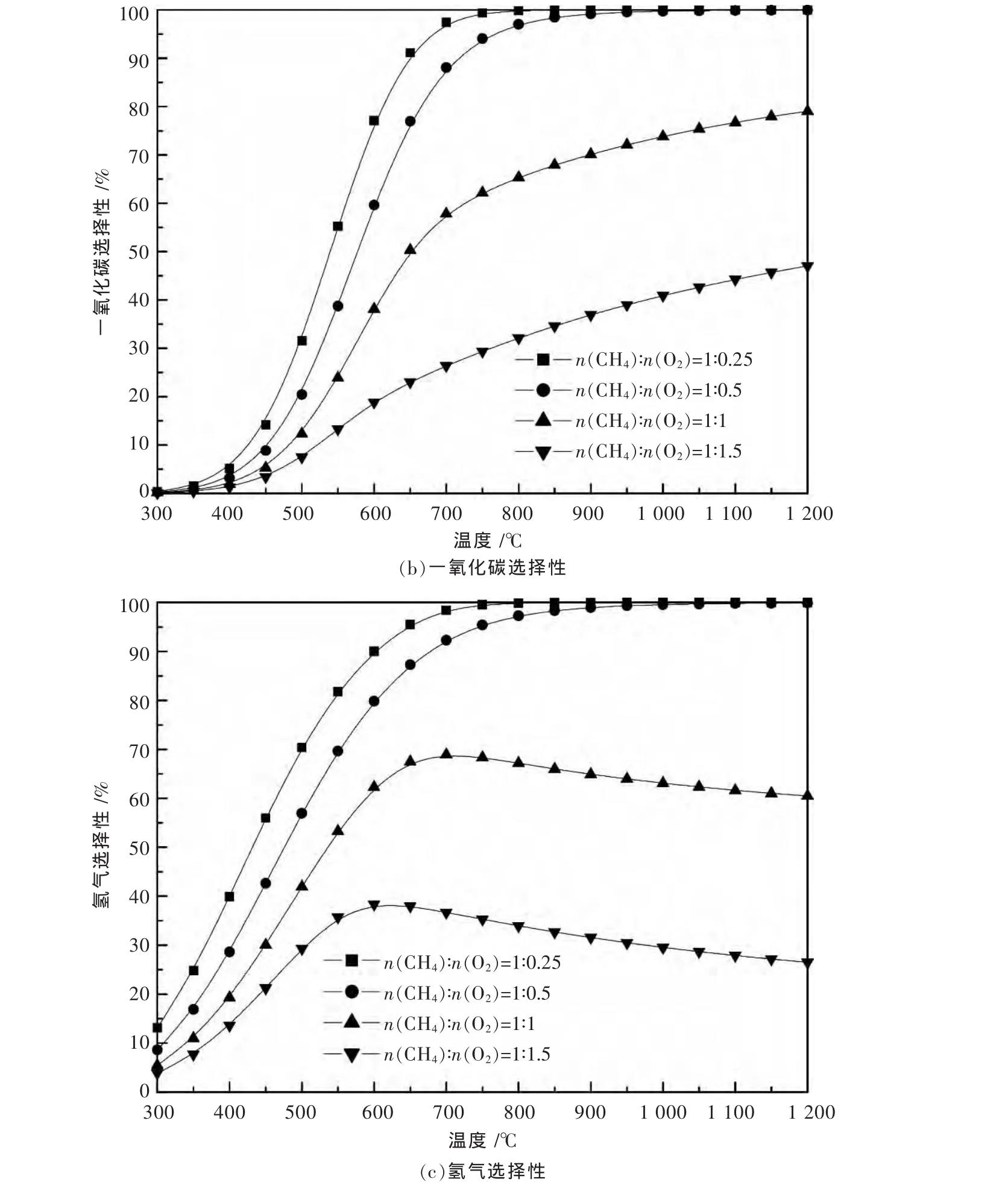
图2 甲烷部分氧化反应的模拟分析:温度与进料比的影响
2.3 平衡产物的热力学分析
由于Aspen Plus软件对非稳态计算的支持不是很好,因此对反应体系的积炭研究比较困难.HSC软件可用于非稳态热力学计算,但HSC在计算过程中不考虑可能发生哪些化学反应,无需选择物性方法,不是过程模拟软件,只是热力学分析计算软件.与Aspen Plus相比,HSC分析结果的真实性略差.
图3是运用HSC对甲烷部分氧化反应产物组成进行热力学计算,计算条件为反应物CH4与O2的物质的量分别为2 mol和1 mol.由图3可知,在300~1 200℃范围内,O2的热力学平衡含量始终为0 mol,300℃时H2O的含量最多,热力学上表明CH4在较低温度下就能进行燃烧.随着反应温度的升高,CO和H2的含量逐渐增加,800℃以上趋于稳定,分别为2 mol和4 mol,说明选择性趋于100%,这与Aspen Plus的计算结果是一致的.图3中显示300℃时就有相当多的积炭,反应温度达到550℃是积炭量达到最大,随后又逐渐减少,直至900℃以上无积炭产生.为了减少积炭的产生,需要提高反应温度.
2.4 积炭副反应分析
催化剂表面的积炭是影响甲烷部分氧化反应的一个重要问题[19-20].积炭形成的方式主要有3种反应类型,反应(19)为甲烷裂解积炭,反应(20)为CO歧化积炭,反应(21)是CO还原积炭[21-22].
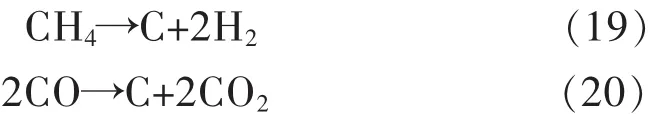
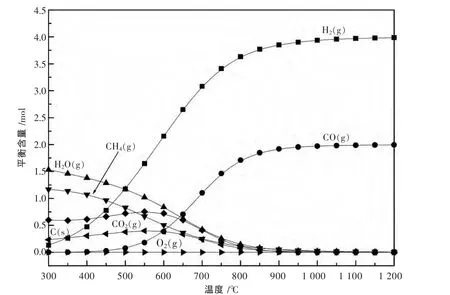
图3 产物的热力学分析
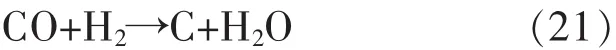
通过HSC软件对不同温度下各积炭副反应的吉布斯自由能变化进行了计算,见图4.由图4可以看出,裂解积炭反应随温度的升高,ΔG减小;歧化积炭和还原积炭反应的ΔG随着温度的升高逐渐增大.选定在750°C下进行甲烷部分氧化反应,在此温度下,反应(19)的ΔG值为负,反应(20)和(21)的ΔG为正值,说明主要发生了甲烷的裂解积炭反应.结合图3,平衡产物中有积炭产生,说明750°C左右的温度范围是甲烷部分氧化反应的热力学积炭区,积炭反应的发生不可避免.

图4 积炭反应的热力学分析
3 结 论
通过热力学模拟分析软件对甲烷部分氧化反应体系和反应过程中各组分的变化进行了详细地分析.甲烷部分氧化体系中包含多个化学反应,提高温度、降低压力和选择恰当的进料配比能够提高CH4的转化率及H2与CO的选择性;高温下以CH4裂解积炭为主,提高反应温度能够降低催化剂表面的积炭量.
[1]余长林,胡久彪,杨 凯,等.制备方法对Ni/CeO2-Al2O3催化剂甲烷部分氧化催化性能的影响[J].燃料化学学报,2013,41(6):722-728
[2]Korup O,Goldsmith C F,Weinberg G,et al.Catalytic partial oxidation of methane on platinum investigated by spatial reactor profiles, spatially resolved spectroscopy,and microkinetic modeling[J].J. Catal.,2013,297:1-16
[3]刘瑞艳,杨美华,黄传敬,等.介孔Co-Al2O3催化剂上甲烷部分氧化制合成气[J].催化学报,2013,34:146-151
[4]余长林,胡久彪,翁维正,等.Co/Ce0.5Zr0.5O2催化剂的制备及甲烷部分氧化制合成气[J].燃料化学学报,2012,40(4):418-423.
[5]余长林,周晓春,胡久彪,等.Co/CexTi1-xO2催化剂的制备及其对甲烷部分氧化反应催化性能[J].石油学报:石油加工,2013,19(6):45-51.
[6]Hermes N A,Lansarin M A,Perez O W.Catalytic decomposition of methane over M-Co-Al catalysts(M=Mg,Ni,Zn,Cu)[J].Catal.Lett., 2011,141(7):1018-1025.
[7]纪红兵,黄莉,谢俊锋,等.耦合甲烷部分氧化与二氧化碳重整用镍系催化剂碱金属与碱土金属改性研究[J].天然气化工,2006,31(1):5-10.
[8]代小平,余长春.LaMO3纳米复合钙钛矿氧载体化学循环重整甲烷制合成气[J].催化学报,2011,32(8):1411-1417.
[9]Hou Z,Yashima T.Supported Co catalysts for methane reforming with CO2[J].React Kinet Catal.Lett.,2004,81(1):153-159.
[10]朱自强,吴有庭.化工热力学[M].3版.北京:化学工业出版社,2009.
[11]Soave G.Equilibrium constants from a modified redlich-kwong equation of state[J].Chem.Eng.Sci.,1972,27(6):1197-1203.
[12]Peng D Y,Robinson D B.A new two-constant equation of state[J]. Industrial&Engineering Chemistry Fundamentals,1976,15(1):59-64.
[13]Chen W H,Lin M R,Lu J J,et al.Thermodynamic analysis of hydrogen production from methane via autothermal reforming and partial oxidation followed by water gas shift reaction[J].Int. J.Hydrogen Energy,2010,35(21):11787-11797.
[14]Li D,Nakagawa Y,Tomishige K.Methane reforming to synthesis gas over Ni catalysts modified with noble metals[J].Appl.Catal., A,2011,408(1/2):1-24.
[15]Haveran V,Dudukovic M P,Lo C S.Conversion of methane and carbon dioxide to higher value products[J].Ind.Eng.Chem.Res., 2011,50(12):7089-7100.
[16]张翔宇,李振花.甲烷部分氧化制合成气催化剂的研究进展[J].化工进展,2002,21(12):903-907.
[17]Lanza R,Canu P,Jaras S G.Methane partial oxidation over Pt-Ru catalyst:An investigation on the mechanism[J].Appl.Catal., A,2010,375(1):92-100.
[18]余长林,周晓春,翁维正,等.碱土Sr对Co/Al2O3催化剂甲烷部分氧化反应的影响[J].燃料化学学报,2012,40(10):1222-1229
[19]Yorka P E,Xiao T,Ggreen M L H.Brief overview of the partial oxidation of methane to synthesis gas[J].Top.Catal.,2003,22(3):345-358.
[20]张军,赵宁,肖福魁,等.NiMgAlO-F催化剂的物化性能及其在甲烷部分氧化制合成气中的应用[J].石油化工,2010,39(12):1319-1325.
[21]王磊,曾少华,张丽娟,等.La0.75Sr0.25Mn1-xNixO3+δ材料的制备及其催化甲烷部分氧化性能[J].催化学报,2009,30(3):247-253.
[22]孙楠楠,闻摇霞,王摇峰,等.反应条件对Ni-CaO-ZrO2催化剂上CH4-CO2重整反应及积炭的影响[J].燃料化学学报,2012,40(3):345-349.
