大豆豆荚特异性启动子的克隆及功能分析
2014-03-26王丕武张学明
宋 阳,王丕武,张学明,曲 静
(吉林农业大学 农学院,吉林 长春130118)
在转基因应用中,启动子对目标基因的表达起着重要的调控作用。根据启动子的作用方式可将其分为组成型、诱导型和组织特异型3类[1]。目前组成型启动子应用最多的是CaMV 35S启动子,Carlos等[2]从大豆中分离出大豆聚泛素启动子,用其启动的GFP基因的表达量比CaMV 35S高2~5倍。诱导型启动子的活化受物理或化学信号刺激的诱导,能够驱动外源基因实现高效表达;其中有的诱导型启动子也有组织特异型启动子的特性,如已克隆的果实特异性表达的E8基因的启动子同时存在乙烯应答元件,故也可看作是乙烯诱导型启动子[3]。组织特异型启动子能够驱动外源基因在特定部位和特定发育阶段表达,实现外源基因在空间和时间上的调控;现已分别在根、茎、叶、果实、花等几乎各种组织中克隆出其相应的组织特异型启动子[4-8],并广泛应用于水稻、玉米、番茄、甘薯等诸多农作物的遗传转化研究中。目前组织特异型启动子在大豆中的应用较为广泛,已克隆了伴大豆球蛋白、球蛋白、凝集素等大豆种子特异性启动子,并在增加转基因植物种子营养含量的研究中得到应用[9]。此外,大豆根部和种皮特异性启动子也都相继克隆成功[10-11]。豆荚特异性启动子可以增加外源基因在结荚期荚中的表达量,最大程度减少对植物其他器官的不利影响,为提高基因工程育种的精确性和安全性提供了新的元件。
大豆(Glycinemax)是我国重要的粮油兼用作物,有着极高的营养价值,是人们日常生活中必备的食用作物之一,但大豆又是一种极易受病虫害侵袭的作物[12]。目前在生产上危害较大的病虫害有大豆灰斑病、荚枯病、大豆食心虫、大豆蚜虫和豆荚螟等[13],其中大部分为害大豆粒荚,严重影响了大豆的产量和品质,因此,针对豆荚特异性启动子控制外源基因在荚中高效表达的研究具有重要的理论和实践意义。为此,本研究利用PCR技术,根据在NCBI数据库中搜索到的豆荚特异性表达的msg基因序列,从大豆基因组DNA中分离其核心启动子片段,并将该片段与GUS报告基因重组,构建报告表达载体,转入烟草中进行功能验证,以期为研究抗病虫基因在大豆荚中的特异表达奠定基础。
1 材料与方法
1.1 材 料
供试大豆品种“吉农28”、烟草品种“NC89”、质粒pBI121、大肠杆菌DH5α(E.coliDH5α)和农杆菌EHA105等,均由吉林农业大学植物生物技术中心提供。
试验试剂DNA GeL Extraction Kit凝胶回收试剂盒购自V-gene公司,pMD18-T Vector 载体试剂盒、DNA Marker DL2000、PCR Kit购自TaKaRa公司,限制性内切酶(Hind Ⅲ、XbaⅠ)、T4DNA Ligase购自Fermentas公司,X-gal、IPTG、X-Gluc、Triton X-100购自北京鼎国生物公司(Sigma分装),DIG High Prime DNA Labeling and Detection Starter Kit Ⅱ试剂盒购自Roche公司。其他试剂均为国产分析纯。
主要仪器设备有PCR仪、紫外及可见光分光光度仪、电泳仪、凝胶成像仪、低温离心机、恒温振荡培养箱、智能人工气候光照培养箱、超净工作台、超低温冰箱和高压灭菌锅等。
1.2 豆荚特异性启动子PSP片段的克隆和序列分析
取大豆品种“吉农28”的幼嫩叶片,用CTAB法[14]提取植物基因组DNA。根据NCBI上发表的大豆豆荚特异性表达基因msg(登录号:AJ239127.1)的启动子序列,用Primer Premier 5.0软件设计1对特异性引物,PSPs:5′-GGGAAGCTTCTAGATGAACTGCTTTAAGG-3′和PSPas:5′-GGGTCTAGATCTTGAATTCAAATAATTGC-3′,其中划线部分分别为加入的Hind Ⅲ和XbaⅠ酶切位点,引物由北京三博远志生物技术有限公司合成。双酶切体系为20 μL,其中限制性内切酶Hind Ⅲ 2 μL、限制性内切酶XbaⅠ 1 μL、质粒5 μL,Buffer 2×Tango 4 μL,ddH2O 8 μL,37 ℃反应2 h。PCR扩增体系为50 μL,其中10×buffer 5 μL、MgCl25 μL、dNPT 0.8 μL、50 pmol/L上下游引物各2 μL、模板0.1 μg、Taq酶 0.5 μL、ddH2O 32.7 μL。PCR扩增条件为:94 ℃预变性8 min;94 ℃变性50 s,45 ℃退火50 s,72 ℃延伸50 s,32个循环;72 ℃延伸10 min。PCR扩增产物用V-gene凝胶回收试剂盒纯化后连入克隆载体pMD18-T Vector;连接产物转化大肠杆菌DH5α感受态细胞,通过蓝白斑筛选,挑取白斑提取质粒DNA,通过PCR扩增和酶切鉴定获得重组质粒,对重组载体测序后进行BLAST分析。测序由北京三博远志生物技术有限公司完成。利用生物数据库PLACE (http://www.dna.affrc.go.jp/PLACE/signalup.html)对测序结果正确的PSP序列进行启动子调控元件分析。
1.3 豆荚特异性报告载体pPSP-GUS的构建及遗传转化
分别对重组克隆载体pMD18-T-PSP和植物表达载体pBI121进行Hind Ⅲ、XbaⅠ双酶切,回收pMD18-T-PSP小片段和pBI121大片段,利用T4DNA连接酶连接,用豆荚特异性启动子PSP的片段替换pBI121的CaMV 35S启动子,与GUS报告基因融合,构建重组豆荚特异性报告载体pPSP-GUS,具体操作参照王关林等[14]的方法。然后采用农杆菌介导法[15]对烟草“NC89”进行遗传转化。
1.4 转化烟草植株的分子生物学检测
采用改良的CTAB法,从烟草叶片中提取基因组DNA作为模板,以豆荚特异性报告载体pPSP-GUS为阳性对照,以未转化植株为阴性对照,以PSP基因和GUS基因的特异性引物进行PCR扩增,其中PSP基因的引物和PCR扩增条件同1.2。GUS基因的引物序列为GUSs:5′-TGTGATATCTACCCGCTTC -3′和GUSas:5′-GGTTTTTCACCGAAGTTCA-3′。PCR扩增体系为25 μL,其中10×buffer 2.5 μL、MgCl22.5 μL、dNPT 0.5 μL、50 pmol/L上下游引物各1 μL、模板0.1 μg、Taq酶 0.3 μL、ddH2O 16.2 μL。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性40 s,54 ℃退火45 s,72 ℃延伸40 s,40个循环;最后72 ℃延伸8 min。PCR扩增产物经1%琼脂糖凝胶电泳分离鉴定。
对PCR检测为阳性的转基因植株,采用CTAB法大量提取叶片基因组DNA,然后进行Southern杂交检测。以纯化的PSP基因为模板制备探针,采用随机引物标记法进行标记,杂交及检测的其他步骤均按照DIG High Prime DNA Labeling and Detection Starter Kit Ⅱ试剂盒说明书操作。
1.5 转基因植株的GUS活性组织染色
选取转基因植株的根部、叶片、萼片和花荚等部位的组织样品进行GUS组织化学分析,GUS染色按照Jefferson[16]的方法进行。以转pBI121质粒烟草(GUS基因由CaMV 35S启动子驱动)和未转化烟草作为对照,观察转pPSP-GUS质粒烟草(GUS基因由豆荚特异性启动子PSP驱动)根部、叶片、萼片和花荚等各组织中的GUS表达活性。
2 结果与分析
2.1 大豆豆荚特异性启动子PSP片段的克隆
以大豆“吉农28”植株幼嫩叶片总 DNA 为模板进行 PCR 扩增,扩增出大小约1 270 bp、特异性强、单一的扩增带(图1A),结果与预期相符。将PCR产物电泳回收后连入克隆载体获得pMD18-T-PSP。重组克隆载体pMD18-T-PSP的PCR结果(图1B)和Hind Ⅲ、XbaⅠ双酶切结果(图1C)表明,获得的片段长度与目的片段大小一致,说明扩增片段已成功连入克隆载体中。
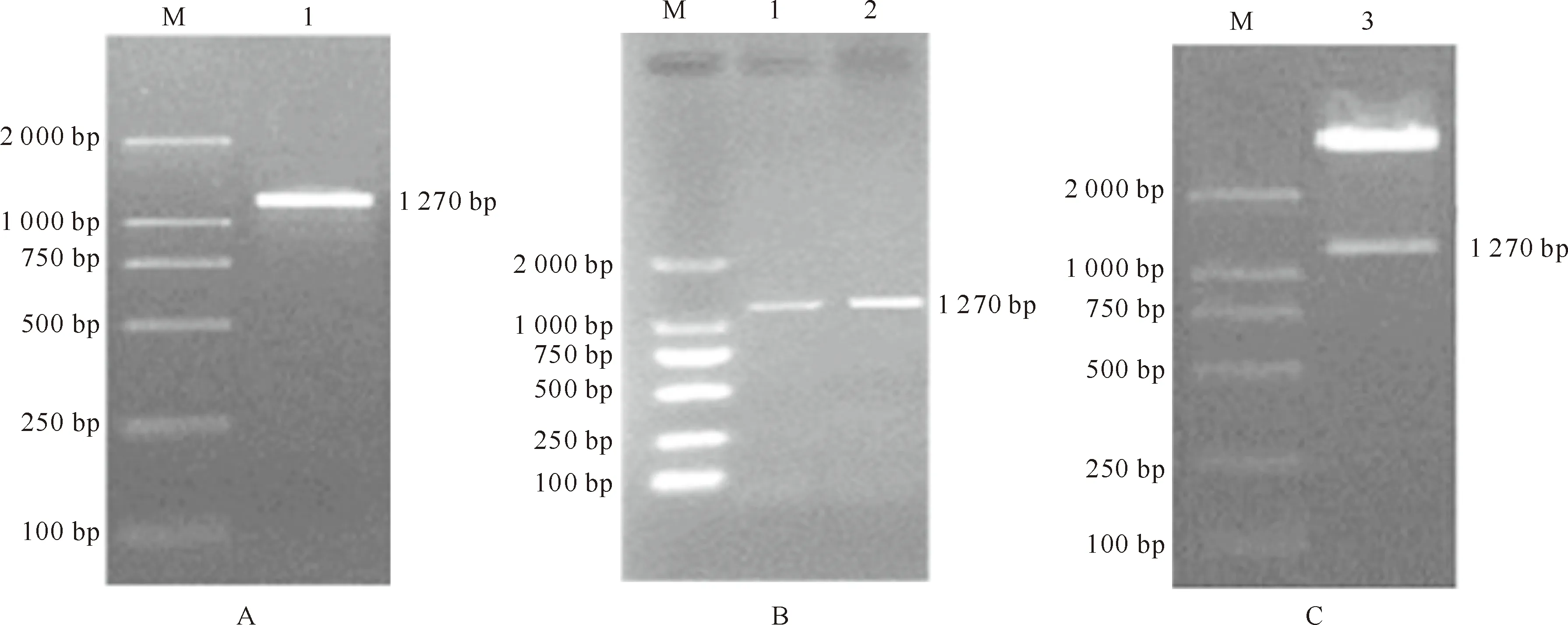
图1 大豆豆荚特异性启动子PSP片段的电泳结果
2.2 大豆豆荚特异性启动子PSP片段的序列分析
对重组克隆载体pMD18-T-PSP的插入片段PSP进行测序,序列分析结果表明,该片段长1 270 bp(图2),与已发表的msg基因序列(登录号为AJ239127.1)的同源性为98%。利用生物数据库PLACE对PSP序列进行启动子调控元件分析,结果表明,PSP中含有多种在其他植物启动子中存在的通用启动子元件和豆荚特异表达所必需的调控元件(表1)。其中包括:4个A/T-rich core、11个CAATBOX、10个TATABOX,这些常见的通用元件参与基因的增强表达,在决定启动子转录效率上有着很强的作用,能够在相对较低的水平上引发转录,决定起始点的位置和核心启动子中的定位[17]。该序列中还包含了9个组织特异性表达必需的GATABOX[18]和一些诱导物应答元件,包括11个GT1CONSENSUS(GRWAAW)、6个GTGANTG10(GTGA)、5个IBOXCORE(GATAA)和3个POLLEN1LELAT52(AGAAA)等。由此可以推测,克隆的片段具有启动基因在豆荚中特异性表达的功能。

图2 大豆豆荚特异性启动子PSP片段的核苷酸序列

表1 大豆豆荚特异性启动子中可能存在的相关调控元件
2.3 豆荚特异性报告载体pPSP-GUS的构建
植物表达载体pBI121是含有CaMV 35S-GUS融合基因系统的双元载体。为了研究豆荚特异性启动子PSP的功能,利用限制性内切酶Hind Ⅲ、XbaⅠ分别双酶切pMD18-T-PSP和pBI121,用所克隆的PSP片段取代植物表达载体pBI121中的CaMV 35S组成型启动子,构建豆荚特异性报告载体pPSP-GUS,所得结果如图3所示。
将pMD18-T-PSP小片段和pBI121大片段用T4DNA连接酶连接,转化大肠杆菌DH5α,经PCR和双酶切鉴定,得到1条约1 270 bp的特异性条带(图4),与预期片段大小一致,表明已成功构建由该启动子驱动报告基因GUS的豆荚特异性报告载体pPSP-GUS。
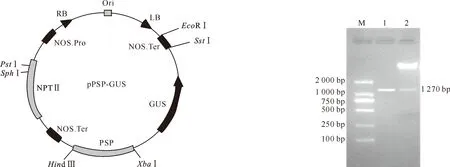
图3 豆荚特异性报告载体pPSP-GUS的构建
2.4 报告载体pPSP-GUS的转化及分子检测
采用农杆菌介导法对烟草“NC89”进行遗传转化,获得了具有卡那霉素抗性的转化植株72株。从再生抗性植株中随机选取42株提取叶片基因组DNA,分别用豆荚特异性启动子PSP的特异性引物和GUS基因的特异性引物进行PCR检测,分别扩增出大小为1 270 bp的PSP片段(图5A)和1 007 bp的GUS片段(图5B),结果得到PCR阳性植株35株,阳性率达83.3%。
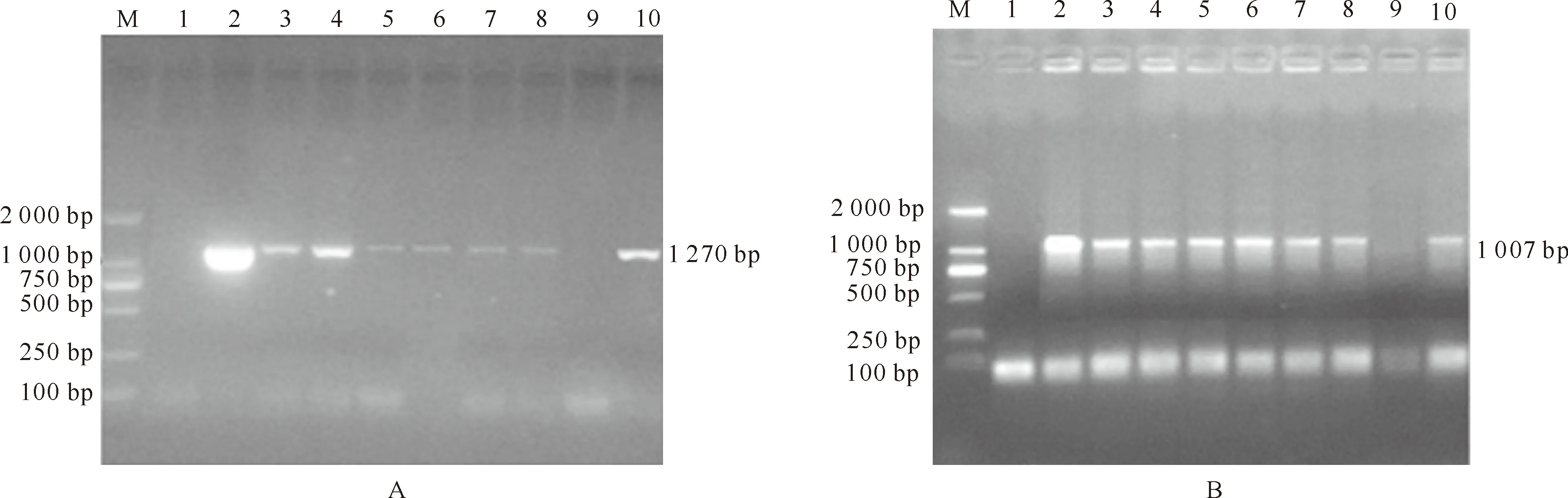
图5 转入报告载体pPSP-GUS烟草的PCR检测
随机选取4株经PCR检测为阳性的转基因植株,以未转化烟草植株为对照,进行Southern杂交检测,结果表明,PCR检测为阳性的4株转基因烟草均具有明显的杂交信号,而未转基因对照植株无杂交信号产生(图6),进一步证明这4株转基因植株是转基因阳性植株,说明外源基因PSP目的片段已经整合到烟草的基因组中,整合形式均为单拷贝形式。其中标号为4和6的转基因植株外源基因整合位点基本相同,标号为3和5的转基因植株与其他2株的外源基因整合位点均不相同。
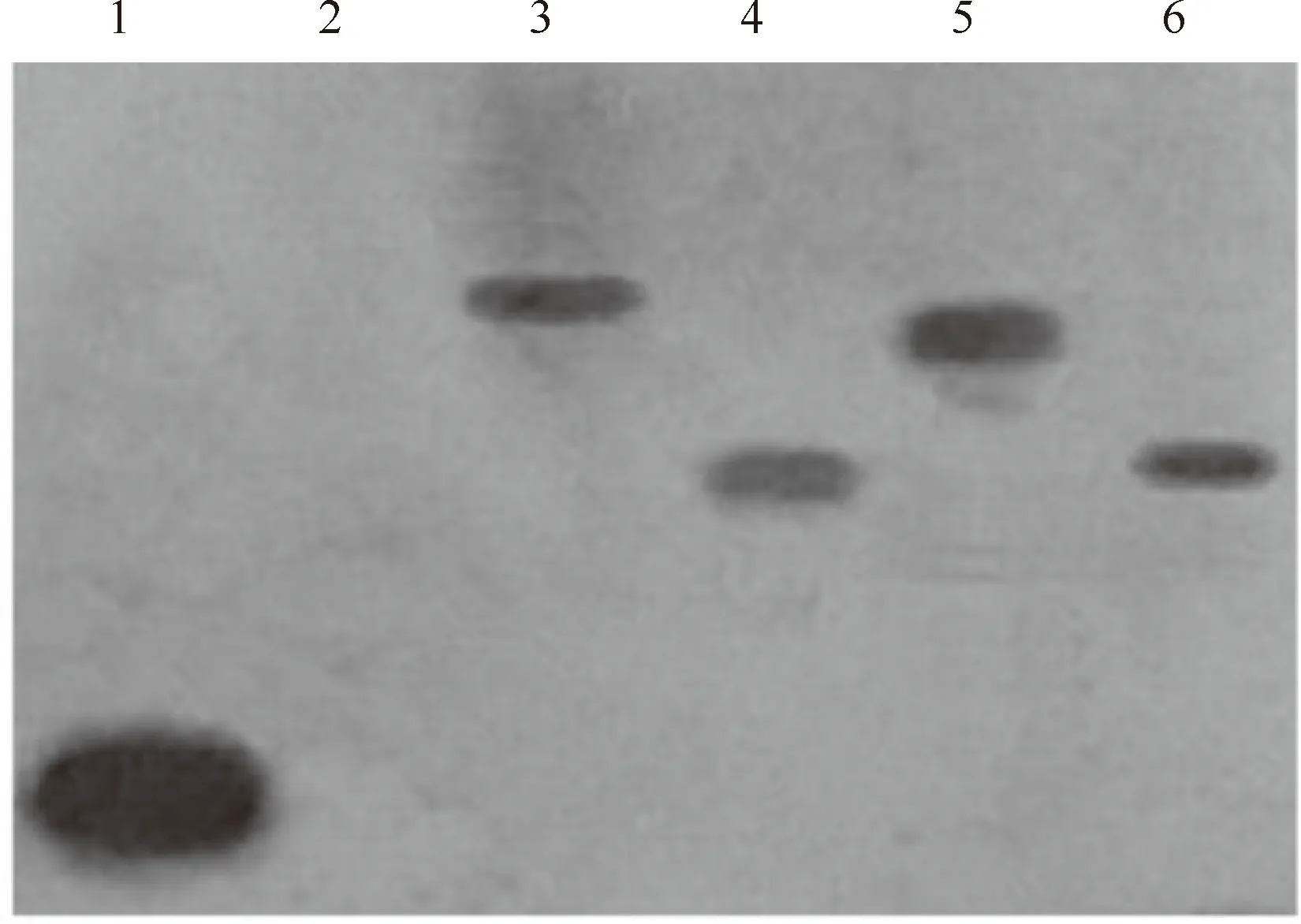
图6 转入报告载体pPSP-GUS烟草的Southern杂交检测
2.5 转基因烟草的GUS活性检测
对PCR和Southern杂交检测为阳性的转基因烟草植株进行GUS活性组织化学染色,结果(图7)表明,在未转化烟草植株的根部、叶片、萼片和花荚中均未检测到GUS活性。在转pBI121质粒烟草的根部、叶片、萼片和花荚中均检测到了GUS活性。在转pPSP-GUS豆荚特异性报告载体的转基因烟草的根和叶片中检测不到GUS活性,而在其萼片和花荚中检测到了GUS活性;且在转基因烟草萼片部位的GUS活性表达效果明显低于转pBI121表达载体(GUS基因由CaMV 35S启动子驱动)的对照,而在其花荚中的表达效果远远高于转pBI121表达载体的烟草植株。以上结果表明,转基因烟草的GUS基因是在豆荚特异性启动子PSP的调控下特异性表达的,证明所克隆的1 270 bp的PSP基因片段具有豆荚特异性启动子的功能。
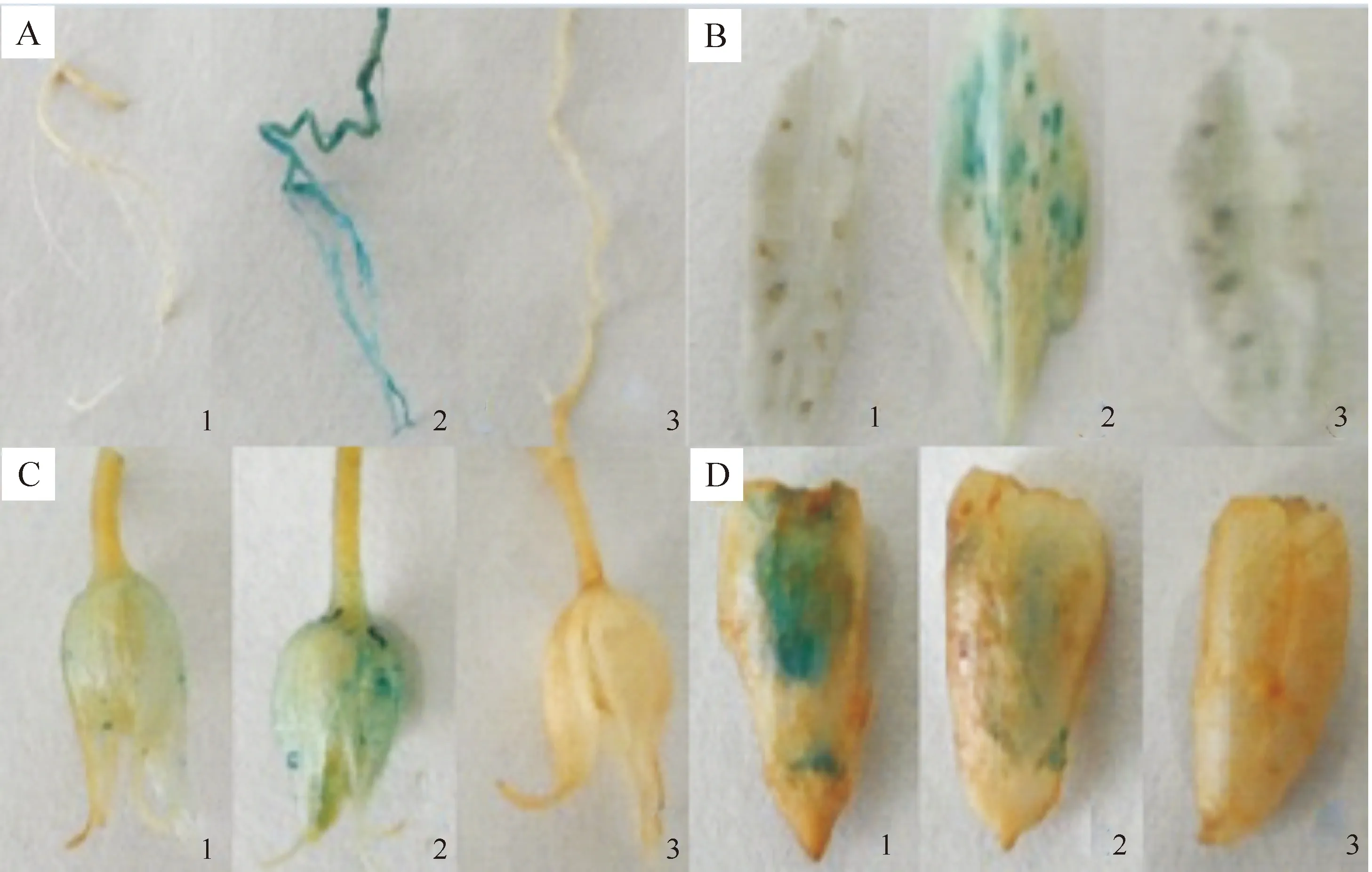
图7 转入报告载体pPSP-GUS烟草的GUS组织化学染色
3 讨 论
本研究通过提取大豆品种“吉农28”全基因组DNA,利用PCR方法成功克隆了大豆豆荚特异性启动子PSP的核心片段,大小为1 270 bp。通过在线软件分析发现,该片段含有典型的启动子元件和组织特异性表达启动子必需的元件,其中包括参与和光响应有关的花荚形成及开花过程的GATABOX[19],许多光响应启动子都包含GATABOX和与其有关的核蛋白。有研究表明,启动子中控制基因组织特异性表达的序列一般位于TATABOX附近[20],本研究所得PSP片段的9个GATABOX中有6个位于TATABOX附近。根据其结构特点初步推测所克隆得到的片段为大豆豆荚特异性启动子。
GUS活性检测结果显示,由pPSP-GUS豆荚特异性报告载体启动的GUS基因在转基因烟草的根和叶片中检测不到GUS活性,但其可以在花荚和萼片中表达,且在花荚中的表达效果明显高于萼片,结合PSP片段中启动子元件和序列位置的特点,推测其参与花荚形成,能够驱动外源基因在萼片部位低水平表达,在花荚中高效表达,在植物的根和叶片部位基本不表达,证实PSP片段确有豆荚特异性表达功能。
本研究克隆得到的豆荚特异性启动子序列,大小为1 270 bp,与吴书音等[21]分离的Pmsg启动子片段相比,虽少约1 000 bp,但典型的启动子元件和组织特异性表达启动子必需元件均包含在内,且GUS活性在花荚中的表达效果明显,并构建了豆荚特异性报告表达载体pPSP-GUS,这为进一步研究抗病虫基因在大豆荚中的特异表达奠定了基础。
[参考文献]
[1] 聂丽娜,夏兰琴,徐兆师,等.植物基因启动子的克隆及其功能研究进展 [J].植物遗传资源学报,2008,9(3):385-391.
Nie L N,Xia L Q,Xu Z S,et al.Progress on cloning and functional study of plant gene promoters [J].Journal of Plant Genetic Resources,2008,9(3):385-391.(in Chinese)
[2] Carlos M H,Adriana P M,Robert A B,et al.A soybean (Glycinemax) polyubiquitin promoter gives strong constitutive expression in transgenic soybean [J].Plant Cell Rep,2009,28:837-849.
[3] Deikman J,Kline R,Fischer R L.Organization of ripening and ethylene regulatory regions in a fruit-specific promoter from tomato (Lycopersiconesculentum) [J].Plant Physiol,1992,100(4):2013-2017.
[4] Noh S A,Lee H,Huh G H,et al.A sweetpotato SRD1 promoter confers strong root-,taproot-,and tuber-specific expression inArabidopsis,carrot,and potato [J].Transgenic Research,2012,21(2):265-278.
[5] Singer S D,Hily J M,Cox K D.The sucrose synthase-1 promoter fromCitrussinensisdirects expression of the β-glucuronidase reporter gene in phloem tissue and in response to wounding in transgenic plants [J].Planta,2011,234(3):623-637.
[6] 刘 莉.水稻叶片衰老特异性启动子的克隆和利用及剑叶早期衰老上升表达基因的鉴定 [D].武汉:华中农业大学,2008.
Liu L.Cloning and application of a senescence-specific promoter in rice leaf and identification of early senescence-associated genes in flag leaves [D].Wuhan:Huazhong Agricultural University,2008.(in Chinese)
[7] Carine G,Mourad A M,Aline L M,et al.Regulation of the fruit-specific PEP carboxylase SlPPC2 promoter at early stages of tomato fruit development [J].PLoS one,2012,17(5):e36795.
[8] Imai A,Takahashi S,Nakayama K,et al.The promoter of the carotenoid cleavage dioxygenase 4a-5 gene ofChrysanthemummorifolium(CmCCD4a-5) drives petal-specific transcription of a conjugated gene in the developing flower [J].Plant Physiol,2013,170(14):1295-1299.
[9] 赵 艳,刘晓鑫,张庆林,等.大豆种子特异性启动子研究进展 [J].大豆科学,2010,29(1):151-156.
Zhao Y,Liu X X,Zhang Q L,et al.Advances of studies on seed-specific promoters of soybean [J].Soybean Science,2010,29(1):151-156.(in Chinese)
[10] Choi D W,Song J Y,Oh M H,et al.Isolation of a root-specific cDNA encoding a ns-LTP-like protein from the roots of bean (PhaseolusvulgarisL.) seedlings [J].Plant Mol Biol,1996,30(5):1059-1066.
[11] 魏雯雯,王丕武,付永平,等.大豆种皮特异性启动子的克隆及功能分析 [J].大豆科学,2010,29(3):390-393.
Wei W W,Wang P W,Fu Y P,et al.Cloning and identification of the seedcoat specific promoter from soybean [J].Soybean Science,2010,29(3):390-393.(in Chinese)
[12] Miranda V D,Coelho R R,Viana A A,et al.Validation of reference genes aiming accurate normalization of qPCR data in soybean upon nematode parasitism and insect attack [J].Bio Med Central,2013,13(6):196-204.
[13] 王 娟,刘 淼,王志坤,等.大豆抗病、虫转基因研究进展 [J].大豆科学,2011,30(5):865-873.
Wang J,Liu M,Wang Z K,et al.Advances in transgenic soybean resistant to disease and pest [J].Soybean Science,2011,30(5):865-873.(in Chinese)
[14] 王关林,方宏筠.植物基因工程 [M].北京:科学出版社,2002:744.
Wang G L,Fang H J.Plant genetic engineering [M].Beijing:Science Press,2002:744.(in Chinese)
[15] Pathi K,Tula S,Tuteja N.High frequency regeneration via direct somatic embryogenesis and efficient Agrobacterium-mediated genetic transformation of tobacco [J].Plant Signal Behav,2013,8(6):e24354.
[16] Jefferson R A.Assaying chimeric genes in plants:The GUS gene fusion system [J].Plant Molecular Biology Reporter,1987,5(4):387-405.
[17] Sugihara F,Kasahara K,Kokubo T.Highly redundant function of multiple AT-rich sequences as core promoter elements in the TATA-less RPS5 promoter ofSaccharomycescerevisiae[J].Nucleic Acids Research,2011,39(1):59-75.
[18] Turbendian H K,Gordillo M,Tsai S Y,et al.GATA factors efficiently direct cardiac fate from embryonic stem cells [J].Development,2013,140(8):1639-1644.
[19] Jose C R,Isabel M P,Francisco J F.The GATA family of transcription factors inArabidopsisand rice [J].Plant Physiol,2004,134(4):1718-1732.
[20] 糜赛男,曹明富.植物组织特异性启动子的研究进展 [J].生物学教学,2010,35(7):2-4.
Mi S N,Cao M F.The research progress on tissue specific promoter in plants [J].Biology Teaching,2010,35(7):2-4.(in Chinese)
[21] 吴书音,郭玉双,柏 锡,等.豆荚特异性启动子Pmsg的克隆及抗大豆食心虫植物表达载体的构建 [J].东北农业大学学报,2008,39(3):58-63.
Wu S Y,Guo Y S,Bai X,et al.Clone of the pod- specific promoter and construction of expression vectors resistant to soybean bean pod borer [J].Journal of Northeast Agricultural University,2008,39(3):58-63.(in Chinese)
