替吉奥维持治疗晚期转移性乳腺癌临床观察
2014-03-26于韦韦张捷时淑珍
于韦韦 张捷 时淑珍
乳腺癌是女性最常见的恶性肿瘤之一,其发病率逐年上升,乳腺癌已经成为妇女健康的最大威胁[1]。目前晚期乳腺癌治疗仍以蒽环类及紫杉类为基础,但因其不良反应对晚期乳腺癌伴有一般状况较差的患者无法耐受,因此探索晚期转移性乳腺癌的治疗,提高生活质量及延长生存期是目前肿瘤工作者面临的课题。大连市第三人民医院自2011年1月~2013年4月,采用替吉奥单药维持治疗晚期转移性乳腺癌患者22例,现总结如下。
1 资料与方法
1.1入组标准 ①有术后病理诊断;②IV期患者;③有实际可测量病灶;④预计生存期6个月;⑤ECOG评分≤2分;⑥术后接受过蒽环类和(或)紫杉类药物治疗;⑦血常规、肝肾功及心电图均正常。
1.2一般资料 22例女性患者均为有病理证实的晚期乳腺癌患者,年龄35~62岁,平均年龄51.45岁;绝经前9例,绝经后13例;ER阳性16例,阴性6例;PR阳性14例,阴性8例;Her-2过表达6例,低表达或未表达16例;单个部位转移9例,多个部位转移13例;肺转移17例,肝转移10例,锁骨上淋巴结转移4例,骨转移3例,腋窝淋巴结转移1例,胸壁转移1例。
1.3方法 根据体表面积不同,替吉奥单药口服,40~60 mg(<1.25 m240 mg;1.25~1.5 m250 mg;>1.5 m260 mg)连续治疗直至病情进展或出现无法耐受的严重不良反应。2周期治疗后按照RECIST疗效评价标准评价疗效。化疗期间每周查血常规及肝肾功,出现II°以上骨髓抑制,停药并予集落刺激因子治疗,直至恢复正常,若不能恢复大于2周,则治疗停止。
1.4疗效标准 按照RECIST1.1实体瘤治疗评价标准[2]:分完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),CR+PR为总有效率(RR),CR+PR+SD为疾病控制率(DCR)。不良反应按WHO的抗癌药物急性及亚急性毒性反应分度标准分0~Ⅳ度[1]。
1.5生存时间 中位无进展生存期(PFS)为从化疗开始到疾病进展的时间的中位数。末次观察时间为2013年11月。
2 结果
2.1临床疗效 22例患者中,完成2个周期化疗者7例,4个周期者8例,6个周期者4例,8个周期者1例,10个周期者1例,中位周期数3.9个。CR 0例,PR 7例,SD 8例,PD 7例,总有效率(RR)31.8%,疾病控制率(DCR)68.2%,中位无进展生存期(PFS)6.8月,1例PR患者及1例SD患者因不良反应终止治疗。
2.2不良反应 患者主要不良反应为骨髓抑制及胃肠道反应,多数为Ⅰ~Ⅱ度,极少数出现III度骨髓抑制。少见不良反应为乏力、口腔黏膜炎。详见表1。
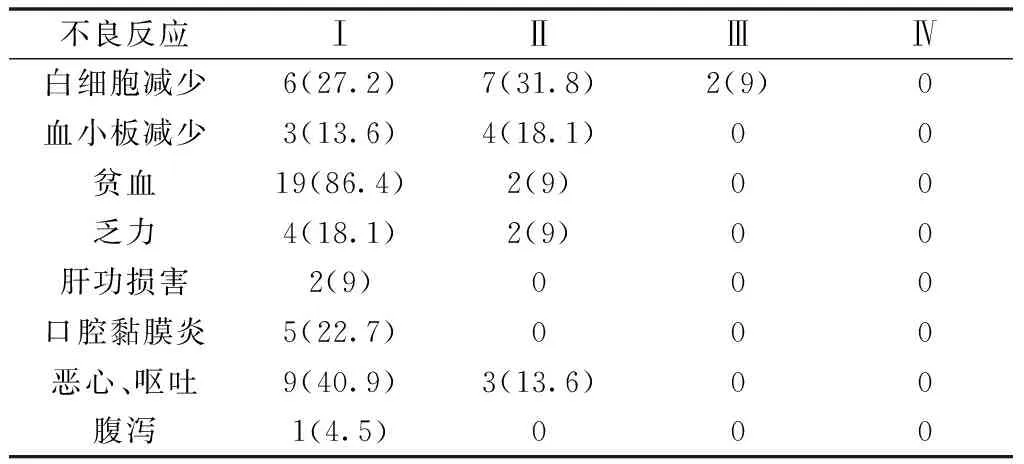
表1 替吉奥不良反应[n(%)]
3 讨论
替吉奥(S-1)是继卡培他滨之后另一种氟尿嘧啶(FU)衍生物类口服抗癌药物,由替加氟(tegafur,FT)、吉美嘧啶(gimeracil,CDPH)和奥替拉西钾(oterecil potassium,OXO)组成。其活性成分FT是抗肿瘤药物氟尿嘧啶的一种口服前体药物,半衰期长达12 h, 经肝脏微粒体的细胞色素酶系统作用能在活体内转化为氟尿嘧啶。CDPH能抑制二氢嘧啶脱氢酶,从而使从FT释放出来进行氟尿嘧啶的分解代谢,有助于长时间维持血液和肿瘤组织中氟尿嘧啶的有效浓度。OXO能阻断氟尿嘧啶的磷酸化,影响氟尿嘧啶在胃肠道的分布,从而减轻氟尿嘧啶的毒性[3]。
该药1999年在日本首次获准上市,已在日本被批准用于晚期胃癌、进行性或复发性头颈部肿瘤、进行性或转移性结肠直肠癌、进行性非小细胞肺癌、转移性乳腺癌和转移性胰腺癌等治疗[4]。日本一项Ⅱ期非盲法试验对替吉奥在转移性乳腺癌的疗效和安全性做出评价。该试验共108例,接受替吉奥治疗最多6个疗程。结果有10例和35例获得完全和部分缓解,总有效率41.7%,中位OS为872 d,不良反应较轻[5]。另一项由Shien T等[6]报道的S-1对于三线或三线以后治疗,其中PR1例(3%),SD2例(5%)。张频等[7]报道的卡培他滨二线治疗晚期乳腺癌10例患者中,PR3例。代醒等[8]报道的替吉奥与卡培他滨治疗老年转移性乳腺癌对照研究中,两组有效率、疾病控制率、中位PFS无明显统计学差异。但对于不良反应特别是手足综合症发生率,替吉奥明显优于卡培他滨。本组研究结果与国内外学者报道的结果相似。
综上所述,替吉奥治疗转移性乳腺癌的近期疗效较好,耐受性好,不良反应轻,患者生活质量高,故对于晚期乳腺癌可作为维持治疗,值得进一步推广。但此种治疗手段需要大规模研究进一步证实。
[1] 孙燕,石远凯.临床肿瘤内科手册.北京:人民卫生出版社,2013:142-145,425-449.
[2] Julka P K,Doval D C,Gupta S,et al.Response assessment in solid tumours a comparison of WHO,SWOG and RECIST guidelines.Br J Radiol,2008,81(966):444-449.
[3] Shirasaka T, Tsukuda M, Inuyama Y,et al.New oral anticancer drug, TS-1 (S-1) from bench to clinic.Gan To Kagaku Ryoho,2001,28(6):855-864.
[4] 马培奇.抗肿瘤新药替吉奥钾研究进展.中国医药导刊,2007,9(6):499-502.
[5] Saeki T, Takashima S, Sano M,et al.A phase II study of S-1 in patients with metastatic breast cancer-a Japanese trial by the S-1 Cooperative Study Group,Breast Cancer Working Group.Breast Cancer,2004,11(2):194-202.
[6] Shien T, Shimizu C, Akashi-Tanaka S,et al.Clinical efficacy of S-1 in pretreated metastatic breast cancer patients.Jpn J Clin Oncol,2008,38(3):172-175.
[7] 张频,董梅,冯奉仪.希罗达作为二线药物治疗晚期乳腺癌10例报告.实用癌症杂志,2001,16(5):524-526.
[8] 代醒,李向柯,吴海波,等.替吉奥单药治疗老年晚期乳腺癌的临床疗效与安全性.肿瘤防治研究,2013,40(5):481-484.
