黄芩苷联合干扰素α治疗慢性乙型肝炎疗效及对细胞免疫的影响
2014-03-26李新成王宏伟申保生宋新文
李新成 王宏伟 申保生 宋新文
我国是乙型肝炎的高发区,乙型肝炎病毒感染易慢性化作且可导致肝硬化的发生。肝纤维化是慢性乙肝向肝硬化发展的必经病理过程,且与细胞免疫功能紊乱密切相关[1]。α干扰素是目前临床常用的抗乙型肝炎病毒的药物。黄芩苷(baicalin)是唇形科植物黄芩的有效成分之一,具有清热解毒、抑菌抗炎、抗变态反应和抑制HBV复制等作用[2]。本研究观察了黄芩苷联合干扰素α-2b对慢性乙型肝炎患者(CHB)肝功能、肝纤维化指标、HBeAg和HBV-DNA转阴率及细胞免疫方面的影响,以探讨其对慢性乙型肝炎的疗效。
1 资料与方法
1.1一般资料 92例慢性乙型肝炎患者均为本科门诊或住院患者,诊断参照《慢性乙型肝炎防治指南(2010年版)》[3]。随机分为治疗组和对照组。对照组44例,男26例,女18例,平均年龄(32±5.1)岁。治疗组48例,男28例,女20例,平均年龄(32±5.2)岁。两组年龄、性别、病程及肝功能差异无统计学意义(P>0.05)。
1.2治疗方法 治疗组给予黄芩苷胶囊(规格:0.25 g,江西普众药业有限公司)口服,每次0.5 g,3次/d,同时给予干扰素α-1b(规格:600万IU,深圳科兴生物技术有限公司)600万IU,皮下注射,每周3次;对照组单给予干扰素α-1b 600万IU,皮下注射,每周3次。两组疗程均为6个月。治疗期间不用其他抗病毒药和免疫调节剂。
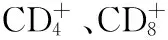
1.4统计学方法 用SPSS17.0软件分析,计量资料采用随机分组t检验,记数资料采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1血清ALT、AST、HA、C-Ⅳ、LN水平 对照组治疗后血清ALT、AST、HA、C-Ⅳ水平低于治疗前,差异有统计学意义(P<0.01),LN水平低于治疗前,但差异无统计学意义(P>0.05);治疗组患者血清ALT、AST、HA、C-Ⅳ、LN水平均明显低于治疗前及对照组治疗后,差异有统计学意义(P<0.01),见表1。

表1 两组治疗前后血清ALT、AST、HA、C-Ⅳ、LN水平
注:与治疗前比较aP<0.01,与对照组治疗后比较:P<0.01
2.2两组HBV-DNA和HBeAg转阴率 治疗六个月后对照组HBV-DNA转阴率为31.8%(14/44),HBeAg转阴率为20.5%(9/44);治疗组HBV-DNA转阴率为64.6%(31/48),HBeAg转阴率为39.6%(19/48)。经χ2检验,黄治疗组HBV-DNA和HBeAg转阴率在治疗六个月后均明显优于对照组(P<0.01,P<0.05)。


表2 两组治疗前后外周血T淋巴细胞亚群水平
注:与治疗前比较aP<0.01,与对照组治疗后比较:P<0.01
3 讨论
HBV感染人体后可影响人体免疫功能,诱发肝细胞损伤。研究认为慢性乙型肝炎的发生发展是在病毒感染过程中长期免疫耐受的结果。在此过程中,机体存在细胞免疫功能紊乱,异常激活的细胞毒性T淋巴细胞可对肝细胞进行攻击造成肝损伤[4]。纤维化亦是慢性病毒性肝炎向肝硬化进展过程中的一种病理改变,血清HA、C-Ⅳ和LN可以较好地反映肝纤维化程度[5]。
α干扰素作为一种广谱抗病毒及免疫调节剂,对慢性乙型肝炎具有确切的长期疗效[6]。其与细胞膜上特异受体相结合后诱导合成抗病毒蛋白,通过激活细胞内2’-5’寡核苷酸合成酶催化寡核苷酸合成,进而激活内源性核酸内切酶,导致病毒mRNA裂解,从而抑制肝炎病毒的复制,同时可增强自然杀伤细胞、巨噬细胞裂解病毒感染细胞的功能,增强淋巴细胞对靶细胞的细胞毒性,起到免疫调节作用[7],是目前治疗乙型肝炎的首选药物之一。本研究显示应用干扰素治疗慢性乙型肝炎,6个月后ALT、AST、HA和C-Ⅳ与治疗前相比下降,差异有显著性,且在HBV-DNA和HBeAg转阴率方面具有一定的疗效。但研究显示单用干扰素疗效有限,且易复发,联合用药已成为慢性乙型肝炎治疗的研究热点[8]。
黄芩苷为黄酮类化合物,是唇形科植物黄芩的有效成分之一,具有清除氧自由基、超氧阴离子自由基、抑菌抗炎、抗病毒、抑制细胞异常凋亡、抗变态反应等多种功能[9]。研究显示黄芩苷对流感病毒、人类免疫缺陷病毒、丙型肝炎病毒、乙型肝炎病毒等多种病毒具有抑制作用[10]。体外实验表明[11]:黄芩苷对能显著抑制2.2.15细胞HBsAg、HBeAg的表达,对乙肝病毒的复制具有明显抑制作用。同时其能降低大鼠肝纤维化模型肝脏线粒体脂质过氧化物丙二醛的含量,通过其抗脂质过氧化作用而抑制肝星状细胞活化,减少α-平滑肌肌动蛋白表达和Ⅰ型胶原的分泌,具有抑制肝纤维化的作用。黄芩苷可以显著抑制多克隆刺激剂ConA或PMA介导的小鼠T细胞的活化和增殖,具有增强免疫功能、抑制变态反应的作用[12]。
[1] Kennedy PT, Sandalova E, Jo J, et al. Preserved T-cell function in children and young adults with immune-tolerant chronic hepatitis B. Gastroenterology,2012,143(3):637-645.
[2] 柴玉爽,雷帆,邢东明,等.黄芩苷对模式识别受体TLR2/4-NOD2的作用及其成药性意义.中国中药杂志,2013,38(16):2639-2644.
[3] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版).中华肝脏病杂志,2011,19(1):13-24.
[4] Chisari FV, Isogawa M, Wieland SF. Pathogenesis of hepatitis B virus infection. Pathol Biol (Paris),2010,58(4):258-266.
[5] Diang XC, Ma LN, Li YF, et al. Association between serum platelet-derived growth factor BB and degree of liver damage, fibrosis and hepatitis B e antigen (HBeAg) status in CHB patients.Hepatogastroenterology,2012,59(120):2357-2360.
[6] Huang R, Hao Y, Zhang J, et al. Interferon-alpha plus adefovir combination therapy versus interferon-alpha monotherapy for chronic hepatitis B treatment: A meta-analysis.Hepatol Res,2013,43(10):1040-1051.
[7] Micco L, Peppa D, Loggi E, et al. Differential boosting of innate and adaptive antiviral responses during pegylated-interferon-alpha therapy of chronic hepatitis B.J Hepatol,2013,58(2):225-233.
[8] Dusheiko G. Treatment of HBeAg positive chronic hepatitis B: interferon or nucleoside analogues. Liver Int,2013,33 (1):137-150.
[9] Wang SC, Chen SF, Lee YM, et al. Baicalin Scavenges Reactive Oxygen Species and Protects Human Keratinocytes Against UVC-induced Cytotoxicity.In Vivo,2013,27(6):707-714.
[10] 万巧凤,顾立刚,李根茂,等.黄芩苷在流感病毒致肺纤维化早期进展中的作用机制.中国药理学通报,2013,29(9):1303-1307.
[11] CHENG Y, PING J, XU HD, et al. Synergistic effect of a novel oxymatrine-baicalin combination against hepatitis B virus replication, alpha smooth muscle actin expression and type I collagen synthesis in vitro. World J Gastroenterol,2006,12(32):5153-5159.
[12] 辛文妤,宋俊科,何国荣,等.黄芩素和黄芩苷的药理作用研究进展.中国新药杂志,2013,22(6):647-659.
